ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 3. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ - 2017
ЧАСТЬ III. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ
ПРИЛОЖЕНИЕ Б.
Краткие решения задач и ответы на вопросы
Решения алгебраических задач представлены в численном виде, причем число значащих цифр ответа обосновано.
Глава 1
1. а) Диаметр увеличенной клетки составляет 500 мм; б) 2,7-1012 молекул актина; в) 36 000 митохондрий; г) 3,9-1010 молекул глюкозы; д) 50 молекул глюкозы на молекулу гексокиназы.
2. а) 1 • 10-12 г = 1 пг; б) 10%; в) 5%.
3. а) 1,6 мм; в 800 раз длиннее клетки: ДНК очень плотно упакована; б) 4000 белков.
4. а) Скорость метаболизма ограничена диффузией, которая в свою очередь определяется площадью поверхности; б) 12 мкм-1 для бактерии, 0,04 мкм-1 для амебы; у бактерии отношение площади поверхности к объему в 300 раз выше.
5. 2 • 106 с (около 23 суток).
6. Молекулы витамина из двух источников идентичны, и организм не может отличить природную молекулу от синтетической. От источника фермента зависит только наличие в нем тех или иных примесей.
7.
8. Два энантиомера по-разному взаимодействуют с хиральным биологическим «рецептором» (белком).
9. а) Только в аминокислотах есть аминогруппы, поэтому разделение может быть основано на заряде или реакционной способности этих групп. Жирные кислоты хуже растворяются в воде, чем аминокислоты. Кроме того, эти два типа молекул различаются по размеру и по форме. Разделение может быть основано на различиях этих параметров, б) Молекула глюкозы по размеру меньше молекулы нуклеотида, так что разделение может быть основано на разнице размеров молекул. Кроме того, азотистое основание и фосфатная группа обеспечивают нуклеотидам такие свойства (растворимость, заряд), которые можно использовать для их отделения от глюкозы.
10. Вряд ли кремний мог бы стать основой жизни, особенно в кислородной атмосфере, окружающей нашу Землю. Длинные цепи, состоящие из атомов кремния, синтезировать достаточно сложно, так что врядли удалось бы получить полимерные макромолекулы, необходимые для реализации сложных функций. Кислород разрушает связи между атомами кремния, а образующиеся связи между кремнием и кислородом чрезвычайно прочные, что затрудняет разрыв и образование химических связей, что все время происходит при процессах жизнедеятельности.
11. Физиологической активностью обладает лишь один энантиомер. Препарат декседрин состоит именно из этого энантиомера, а бензедрин представляет собой рацемическую смесь.
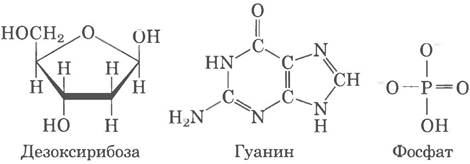
12. а) Три фосфорильные группы, α-D-рибоза, гуанин; б) холин, фосфорная кислота, глицерин, олеиновая кислота, пальмитиновая кислота; в) тирозин, два глицина, фенилаланин, метионин.
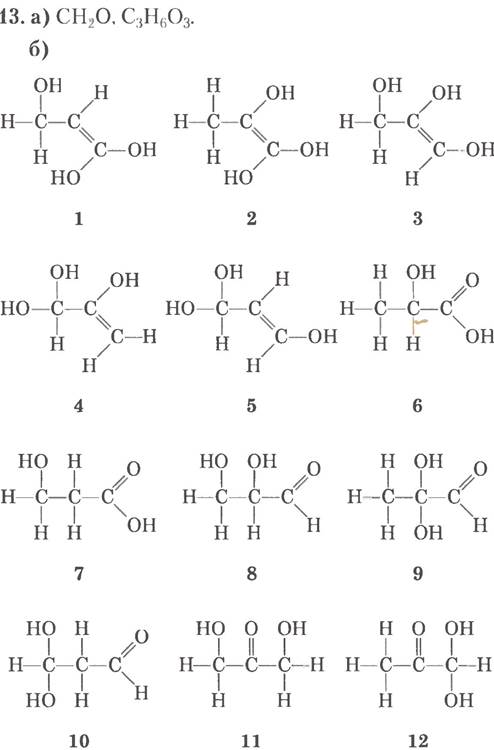
в) X содержит хиральный центр, так что можно исключить все структуры, кроме 6 и 8; г) X содержит кислую функциональную группу, и это позволяет исключить структуру 8; структура 6 соответствует всем условиям; д) структура 6; различить два возможных энантиомера мы не можем.
14. а) Большее отрицательное значение ∆С° соответствует большей величине Кeq для реакции связывания, так что равновесие сдвигается в сторону продуктов реакции и более сильного связывания и, следовательно, более сладкого вкуса и большего значения относительной сладости, б) Определение сладости на животных занимает слишком много времени; компьютерные программы для предсказания сладости веществ, возможно, не всегда отличаются высокой точностью, но позволяют химикам гораздо быстрее сконструировать эффективные подсластители. Затем такие молекулы-кандидаты должны быть опробованы на животных или на людях, в) В отрезке длиной от 0,25 до 0,4 нм укладывается от 1,5 до 2,5 длин «типичных» одинарных связей. Используем изображенный ниже шаблон в качестве линейки: любой атом, попадающий в розовый прямоугольник, находится на расстоянии от 0,25 до 0,4 нм от начала линейки.
В данных молекулах содержится множество возможных групп АН-В; ниже выделены некоторые из них.
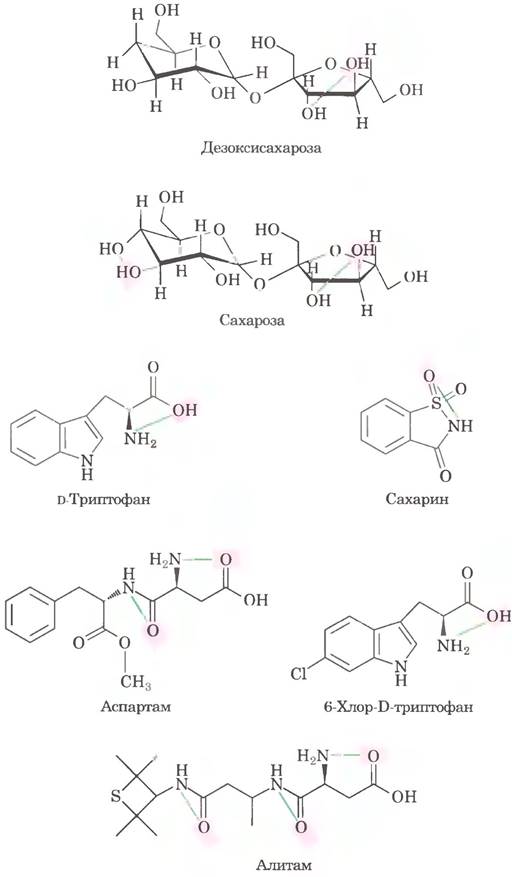
г) Вопервых, в каждой из приведенных молекул есть несколько групп АН-В, так что трудно определить, какие из них играют определяющую роль. Во- вторых, группа АН-В очень простая и часто встречается во многих несладких молекулах, д) Сахароза и дезоксисахароза. Дезоксисахароза не имеет одной из групп АН-В, имеющихся в молекуле сахарозы, и обладает чуть более низким значением относительной сладости, как и следует ожидать, если эти группы АН-В определяют сладость вещества.
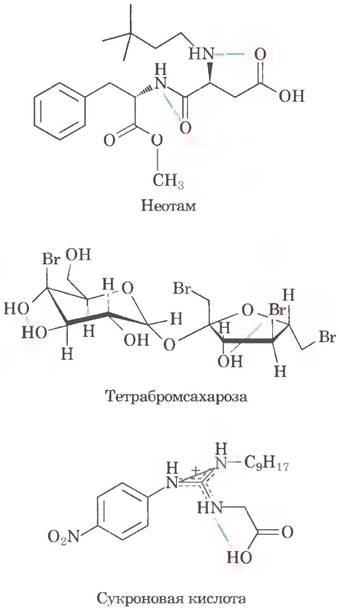
е) Таких примеров много, вот некоторые из них: (1) D-триптофан и 6-хлор-D-триптофан имеют одну и ту же группу АН-В, но значения относительной сладости для этих молекул очень сильно различаются. (2) Аспартам и неотам также имеют одинаковые группы АН-В, но сильно различаются по относительной сладости. (3) Неотам имеет две группы АН-В, а алитам - три, но неотам более чем в 5 раз слаще. (4) Бром обладает менее выраженной электроотрицательностью, чем кислород, и, следовательно, должен бы ослаблять активность групп АН-В, однако тетрабромсахароза гораздо слаще сахарозы. ж) При достаточной «подгонке» параметров модели к выборке данных любая модель сможет более или менее адекватно описывать эту выборку. Поскольку исследователи хотели создать модель, способную предсказать ∆G° для молекул, которые не были протестированы in vivo, они должны были показать, что модель хорошо описывает молекулы, на которых ее не «тренировали». Степень отклонения
результатов моделирования от истинных значений для тестируемых молекул показывает, насколько хороша предложенная модель, з) Относительная сладость связана с Keq, которая в свою очередь экспоненциальным образом зависит от ∆G°. Поэтому увеличение значения ∆G° на постоянную соответствует умножению относительной сладости на постоянную. На основании представленных значений можно сказать, что изменение ∆G° на 1,3 ккал/моль соответствует 10-кратному изменению относительной сладости.
Глава 2
1. Этиловый спирт полярная молекула, а молекула этан нет. Гидроксильная группа этилового спирта может участвовать в образовании водородных связей с молекулами воды.
2. а) 4,76; б) 9,19; в) 4,0; г) 4,82.
3. а) 1,51 • 10-4 М; б) 3,01 • 10 7 М: в) 7,76 • 10-12 М.
4. 1,1.
5. а) НСl <-> Н+; б) 3,3; в) NaOH <-> Na++ ОН-; г) 9,8.
6. 1,1.
7. 1,7 • 10-9 моль ацетилхолина.
8. 0,1 М HCl.
9. 3,3 мл.
10. a) RCOO-; б) RNH2; в) Н2РO4; г) НСO3.
11. а) 5,06; б) 4,28; в) 5,46: г) 4,76; д) 3,76.
12. а) 0,1 М HCl; б) 0,1 М NaOH; в) 0,1 М NaOH.
13. Вариант (г). Бикарбонат - слабое основание и титрует -ОН-группы, превращая их в О-, в результате чего соединение становится более полярным и лучше растворяется в воде.
14. Из желудка. Нейтральная форма аспирина, присутствующая при более низких значениях pH, является менее полярной и легче проникает через мембраны.
15. 9.
16. 7,4.
17. а) при pH 8,6 10.6; б) 4 5: в) 10 мл: г) pH = рКа - 2.
18. 1,4.
19. NaH2PO4• H2O - 5,8 г/л. Na2HPO4 - 8.2 г/л.
20. [А]/[НА] = 0,10.
21. Смешать 150 мл 0,10 М раствора ацетата натрия и 850 мл 0,10 М уксусной кислоты.
22. Раствор уксусной кислоты; рКа уксусной кислоты ближе всего к заданному pH.
23. а) 4,6; б) 0,1 единицы pH; в) 4 единицы pH
24. 4,3.
25. 0,13 М ацетат и 0,07 М уксусная кислота.
26. 1.7.
27. 7.
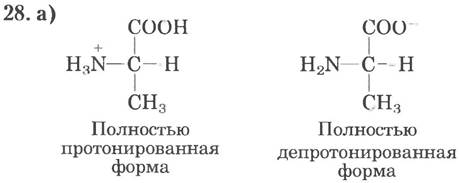
б) Полностью протонирован; в) цвиттерион; г) цвиттерион; д) полностью депротонирован
29. а) pH крови контролируется буферной системой диоксид углерод/бикарбонат: СO2 + Н2O <-> Н+ + НСO3. При гиповентиляции легких [СO2] артериальной крови повышается, что приводит к повышению |Н+] и снижению pH. б) При гиперввнтиляции легких [СО2] артериальной крови понижается, что приводит к снижению [Н+] и повышению pH а 7,4 (выше нормы), в) Лактат — кислота средней силы; при физиологических условиях он полностью диссоциирует, снижая pH крови и жидкостей мышечной ткани. Гипервентиляция удаляет H+, что сопровождается повышением pH крови и тканей, т. е. противодействует эффекту лактата.
30. 7,4.
31. Растворение дополнительного количества СO2 приводит к повышению содержания Н в крови и внеклеточных жидкостях, что снижает pH:
СO2(d) + Н2O <-> Н2СО3 <-> Н+ + НСO-3
32. а) Сначала использовать вещество в форме ПАВ. что позволит перевести разлитое масло в эмульсию, собрать эмульсию, а затем переключить вещество в форму «не-ПАВ». б) Равновесие реакции сильно сдвинуто вправо. Более сильная кислота Н2СO3 (более низкое значение рКa) отдает протон сопряженному основанию более слабой кислоты — амидина (более высокое значение рКa). в) Активность ПАВ зависит от гидрофильности функциональной группы в головке: чем сильнее выражены гидрофильные свойства головки, тем более активные свойства ПАВ. Амидиний значительно более гидрофильное соединение, чем амидин, поэтому он является более мощным ПАВ. г) Точка А: амидиний; СO2 имел достаточно времени для взаимодействия с амидином, чтобы перевести его в форму амидиния. Точка В: амидин; Аr удалил СO2 из раствора, оставив ПАВ в форме амидина. д) Проводимость возрастает по мере того, как незаряженный амидин взаимодействует с СO2 и превращается в заряженный амидиний. е) Проводимость падает по мере того, как Аr удаляет из системы СO2, сдвигая равновесие в сторону образования незаряженного амидина ж) Следовало бы обработать переключаемый ПАВ СO2 для его перевода в форму амидиния и использовать для эмульгирования масла. Затем обработать эмульсию Аr, чтобы удалить СO2 и вернуться к неактивному амидину. Масло отделится от воды, и его можно будет собрать.
Глава 3
1. L; следует определить абсолютную конфигурацию заместителей у α-атома углерода и сравнить с молекулами D- и L-глицеральдегида.
2. а) I; б) II; в) IV; г) II; д) IV; е) II и IV; ж) III; з) III; и) V; к) III; л) V; м) II; н) III; о) V; п) I, III и V.
3. а) рI> рKа для α-карбоксильной группы и рI <рКа для α-аминогруппы, так что обе группы заряжены (ионизованы), б) Одна на 2,19 • 107; рI аланина составляет 6.01. Из таблицы 3-1 и уравнения Хендерсона Хассельбаха следует, что незаряженными остается одна карбоксильная группа из 4680 и одна аминогруппа из 4680. Доля молекул аланина, в которых не заряжены обе группы, равна обратной величине произведения этих двух чисел.
4. а)-в)
pH |
Структура |
Суммарный заряд |
Движется к |
1 |
1 |
+2 |
катоду |
4 |
2 |
+1 |
катоду |
8 |
3 |
0 |
не движется |
12 |
4 |
-1 |
аноду |
5. a) Asp; б) Met; в) Glu; г) Gly; д) Ser.
6. а) 2; б) 4; в)
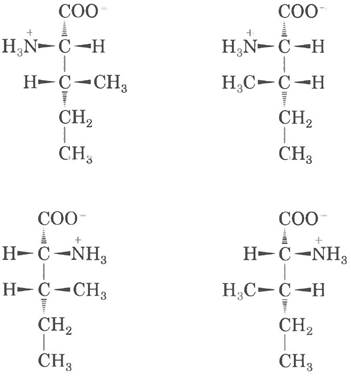
7. а) Структура при pH 7:
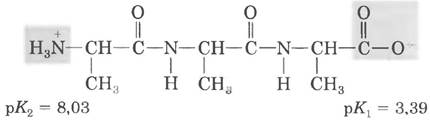
б) Электростатическое взаимодействие между карбоксилатным анионом и протонированной аминогруппой цвиттер-иона аланина способствует ионизации карбоксильной группы Это электростатическое взаимодействие ослабевает по мере удлинения последовательности поли(Аlа), что выражается в увеличении рК1. в) Ионизация протонированной аминогруппы разрушает электростатические взаимодействия, описанные в пункте (б). При увеличении расстояния между заряженными группами облегчается удаление протона от аминогруппы в молекуле поли(Аlа), и рК2 уменьшается. Внутримолекулярное влияние амидных (пептидных) связей проявляется в уменьшении рKа по сравнению с рKа алкилзамещенных аминов.
8. 75 000.
9. а) 32 000. При образовании пептидной связи выделяется молекула воды, так что молекулярные массы остатка триптофана и свободного триптофана не равны; б) 2.
10. Белок состоит из четырех субъединиц с молекулярными массами 160, 90, 90 и 60 кДа. Субъединицы с молекулярной массой 90 кДа (возможно, они идентичные) связаны одной или несколькими дисульфидными связями.
11. а) При pH 3 — +2, при pH 8 — 0, при pH 11— -1; б) рI = 7,8.
12. рI ~ 1; карбоксилатные группы; Asp и Glu.
13. Lys, His и Arg; отрицательно заряженные фосфатные группы молекул ДНК взаимодействуют с положительно заряженными боковыми группами гистонов.
14. a) (Glu)20; б) (Lys-Ala)3; в) (Asn-Ser-His)5; г) (Asn-Ser-His)5.
15. а) Удельная активность фермента: 200 ед., мг после стадии 1, 2 600 ед./мг после стадии 2, 3 250 ед./мг после стадии 3, 4 000 ед., мг после стадии 4, 15 000 ед./мг после стадии 5, 15 000 ед./мг после стадии 6.; б) стадия 4; в) стадия 3; г) Да. Поскольку удельная активность на стадии 6 не увеличилась; провести электрофорез в полиакриламидном геле в присутствии SDS.
16. a) [NaCI] = 0,5 мМ: б) [NaCl] = 0.05 мМ.
17. Первым сходит пептид С, вторым пептид В, а третьим пептид А.
18. Tyr-Gly-Gly-Phe-Leu.
19.
Стрелки указывают пептидную связь -СО —> NH-
20. 88%, 97%. Процент (x) правильных аминокислотных остатков, высвобожденных в цикле n, составляет xn/x. Все остатки, высвобожденные в первом цикле, правильные, даже если эффективность расщепления неидеальная.
21. a) Y (1), F (7) и R (9); б) положения 4 и 9; К (Lys) чаще встречается в положении 4, R- (Arg) всегда присутствует в положении 9; в) положения 5 и 10; чаще всего в обеих положениях встречается Е (Glu); г) положение 2; S (Ser)
22. а) Белок, который предстоит выделить (цитратсинтаза, ЦС), составляет довольно малую фракцию всего клеточного белка. Проведение выделения на холоде тормозит процесс деградации белка, а сахароза обеспечивает изотоническую среду, в которой при гомогенизации лучше сохраняется целостность органелл. б) На этой стадии клеточные органеллы разделяются в зависимости от их размера, в) Первое добавление сульфата аммония позволяет удалить из гомогената некоторые балластные белки. При добавлении дополнительного количества сульфата аммония ЦС тоже выпадает в осадок, г) Для перевода ЦС в раствор необходимо удалить сульфат аммония, но сделать это нужно при таких значениях pH и ионной силы, чтобы сохранить нативную конформацию белка, д) Молекулы ЦС больше размера пор хроматографического геля. Белок можно идентифицировать по поглощению света с длиной волны 280 нм, что характерно для остатков Туr и Тrр. е) ЦС несет на себе положительный заряд и поэтому связывается с отрицательно заряженными группами катионообменника. Сначала с колонки смываются нейтральные и отрицательно заряженные белки, а затем ЦС смывается с помощью раствора с более высоким значением pH, который изменяет заряд на молекуле ЦС. ж) разные белки могут иметь одно и то же значение рI. Но SDS-электрофорез подтверждает, что в данной фракции содержится единственный белок. Полностью удалить SDS из белкового препарата трудно, и в его присутствии нарушаются кислотно-основные свойства белка, включая значение рI.
23. а) В любой линейной полипептидной цепи есть лишь два типа свободных аминогрупп: единственная α-аминогруппа на N-конце цепи и ε-аминогруппы в боковой цепи остатков лизина. Эти аминогруппы реагируют с FDNB с образованием DNP-производных аминокислот. Инсулин образует два разных α-амино-DNР-производных, что говорит о существовании двух N-концов и, следовательно, двух полипептидных цепей, одна из которых имеет на N-конце остаток Gly, а другая — остаток Phe. Поскольку лизин образует e-DNP-лизин, он не является N-концевым остатком, б) Да. Цепь А имеет на N-конце остаток Gly; цепь В имеет на N-конце остаток Phe и неконцевой (в позиции 29) остаток Lys. в) Phe-Val-Asp-Glu-. Пептид В1 имеет на N-конце остаток Phe. В пептиде В2 также содержится остаток Val, но поскольку DNP-Val не образуется, Val не является N-концевым остатком, а должен находиться со стороны С-конца от Phe. Следовательно, В2 имеет последовательность DNP-Phe-Val. Аналогичным образом, В3 имеет последовательность DNP-Phe-Val-Asp, и цепь В начинается последовательностью Phe-Val-Asp-Glu-, г) Нет. Известно, что В-цепь инсулина начинается с последовательности Phe-Val-Asn-Gln-. При определении аминокислотной последовательности по методу Сенгера Asn и Glu превращаются в Asp и Glu соответственно по той причине, что на стадии гидролиза (стадия 7) происходит гидролиз амидных связей в Asn и Gin (как и пептидных связей), в результате чего образуются Asp и Glu. На этой стадии анализа Сенгер с соавторами не могли отличить Asp от Asn, a Glu от Gin. д) Она в точности совпадает с последовательностью, представленной на рис. 3-24. Для каждого представленного в таблице пептида приведена информация, позволяющая определить, в каком случае Аsх является аспарагином, а в каком аспарагиновой кислотой, а Glх — глутамином или глутаминовой кислотой.
Ас1: остатки 20-21. Это единственная последовательность Суs-Asх в цепи А; в этом пептиде содержится примерно одна амидная группа, так что это должна быть последовательность Суs-Аsn;
Ар15: остатки 14-15-16. Это единственный участок с последовательностью Туr-Glх-Leu в цепи А. В нем содержится примерно одна амидная группа, так что это должна быть последовательность Туr-Gln-Leu:
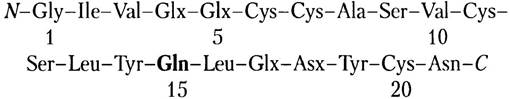
Ар14: остатки 14-15-16-17. Здесь содержится примерно одна амидная группа, и нам уже известно, что в положении 15 находится Gln, так что в положении 17 — Glu:
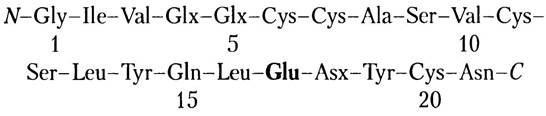
Ар3: остатки 18-19-20-21. Здесь содержится примерно две амидные группы. Мы знаем, что в положении 21 находится Аsn, так что в остаток 18 также Аsn:

Ар1: остатки 17-18-19-20-21. В положениях 18 и 21 находится Asn.
Ар5ра1: остатки 1-2-3-4. Здесь нет амидных групп, значит, в положении 4 находится остаток Glu:

Ар5: остатки от 1 до 13. Здесь содержится примерно одна амидная группа. Нам уже известно, что в положении 4 находится Glu, так что в положении 5 должен стоять Gln:

Глава 4
1. а) Более короткие связи имеют большую кратность (по сравнению с одинарными связями) и прочность. Пептидная вязь С-N прочнее одинарной связи и занимает промежуточное положение между простой и двойной связью, б) Вращение вокруг пептидной связи при физиологических условиях затруднено, поскольку отчасти она имеет характер двойной связи.
2. а) Основной структурной единицей шерстяного волокна (α-кератина) является виток α-спирали, повторяющийся через каждые 5,4 Â; длина витка спирали составляет около 5,2 Â. Нагревание и растягивание волокна приводит к образованию растянутой β-конформации, в которой расстояние между соседними R-группами составляет -7,0 Â. Когда полимер возвращается в исходную α-спиральную конформацию, волокно вновь укорачивается, б) Под действием влаги и тепла шерстяное волокно возвращается из β-конформации в нативную α-спиральную конформацию и происходит опять укорачивание. Структура белка шелка — β-лист, где небольшие боковые цепи аминокислотных остатков упакованы достаточно плотно, и такая структура оказывается прочнее структуры шерсти.
3. ~ 42 пептидные связи в секунду
4. При pH >6 карбоксильные группы поли(Glu) де- протонированы. Взаимное отталкивание между отрицательно заряженными карбоксильными группами приводит к разворачиванию белковой цепи. Аналогичным образом, при pH 7,0 протонированы аминогруппы поли(Lys). Взаимное отталкивание между этими положительно заряженными группами тоже приводит к разворачиванию цепи.
5. а) Дисульфидные мостики образованы ковалентными связями, и поэтому они гораздо прочнее нековалентных взаимодействий, стабилизирующих большинство белковых структур. Дисульфидные мостики образуют перекрестные сшивки между полипептидными цепями, повышая их жесткость и механическую прочность, б) Наличие дисульфидных связей между остатками цистеина предотвращает полное разворачивание белка.
6. а) Изгибы с наибольшей вероятностью возникают у остатков 7 и 19; наличие остатков Pro в цис- конфигурации способствует возникновению поворотов. б) Остатки Cys в положениях 13 и 24 могут образовывать дисульфидные связи, в) На внешней поверхности находятся полярные и заряженные остатки (Asp, Gln, Lys), внутри глобулы — неполярные и алифатические остатки (Ala, Ile). Хотя Thr и является полярной аминокислотой, его индекс гидропатии близок к нулю, так что он может находиться как на поверхности глобулы, так и внутри.
7. 30 аминокислотных остатков; 0,87.
8. Миоглобин — это и то, и другое, и третье. Мотив «глобиновой укладки» встречается во всех глобинах. Полипептидная цепь образует один-единственный домен в данном белке.
10. а) Число молей DNP-валина, образующееся из 1 моль белка, равно числу N-концевых остатков и, следовательно, числу полипептидных цепей, б) 4; в) При проведении SDS-электрофореза различные полипептидные цепи, возможно, давали бы отдельные полосы.
11. Пептид (а), поскольку в нем больше аминокислотных остатков, способствующих образованию α-спиральнй структуры (см. Таблицу 4-1).
12. а) По-видимому, остатки ароматических аминокислот играют важную роль в стабилизации амилоидных волокон. Поэтому молекулы с ароматическими группами могли бы ингибировать образование амилоида, препятствуя взаимодействию ароматических боковых цепей аминокислотных остатков, б) При диабете II типа в поджелудочной железе образуются амилоидные волокна, как и в головном мозге при болезни Альцгеймера. Хотя амилоидные волокна при этих двух заболеваниях состоят из разных белков, основная структура амилоида по сути одна и та же и стабилизирована одинаковым образом. Поэтому лекарства, способные разрушать эту структуру, возможно, эффективны в обоих случаях.
13. а) Транскрипционный фактор NFkB, также называемый трансформирующим фактором RelA. б) Нет. Результаты похожи, но списки родственных белков разные, в) Белок состоит из двух субъединиц. Существует множество вариантов этих субъединиц, но лучше других охарактеризованы варианты с молекулярной массой 50, 52 или 65 кДа. Они образуют разнообразные гомо- или гетеродимеры. Структуру некоторых из них можно найти в базе данных PDB. г) Транскрипционный фактор NFkB представляет собой димерный белок, который связывается со специфической последовательностью ДНК, усиливая транскрипцию соседних генов. Среди этих генов, в частности, ген легкой к-цепи иммуноглобулина, в связи с чем транскрипционный фактор и получил свое название.
14. a) Aba является подходящей заменой, поскольку Aba и Cys имеют боковые цепи примерно одинакового размера и одинаковую гидрофобность. Однако Aba не может образовывать дисульфидные связи и поэтому не будет адекватной заменой в том случае, когда такие связи требуются, б) Между синтезированным белком и ВИЧ-протеазой, образующейся в человеческих клетках, существует несколько важных различий — любое из них может объяснить отсутствие активности у синтетического белка. (1) Хотя Cys и Aba похожи по размеру и гидрофобности, этого может быть недостаточно для формирования правильной укладки белка. (2) В фолдинге ВИЧ-протеазы определенную роль могут играть дисульфидные связи. (3) Фолдинг многих белков происходит еще в процессе синтеза на рибосомах, но данный белок складывается только после завершения синтеза. (4) Белки, синтезируемые на рибосомах, могут взаимодействовать с рибосомами в процессе фолдинга, но для данного белка, это невозможно. (5) Состав цитозоля сложнее состава буфера, который использовался в данном исследовании, а для фолдинга некоторых белков могут требоваться специфические и неизвестные пока белки. (6) Для правильного сворачивания некоторым белкам требуются шапероны, которых в буфере пет. (7) В клетках ВИЧ-протеаза синтезируется как часть более длинной цепи, которая затем подвергается протеолитическому процессингу, а белок в данном исследовании был синтезирован как единая молекула, в) Поскольку фермент оказался функциональным даже при замене Cys на Aba, видимо, дисульфидные связи не играют важной роли в формировании ВИЧ-протеазы. г) Модель 1: укладка, как в L-протеазе. Аргумент «за»: ковалентная структура белков одинаковая (за исключением хиральности), поэтому и укладка будет такой же. Аргумент «против»: хиральность — важное свойство, трехмерная структура играет ключевую роль в биологической активности молекул. Поэтому синтетический фермент не может укладываться таким же образом, как L-протеаза. Модель 2: образуется зеркальное отражение L-протеазы. Аргумент «за»: поскольку отдельные элементы синтетического и природного белков являются зеркальными отражениями друг друга, целая молекула синтетического белка тоже примет структуру зеркального отражения природного белка. Аргумент «против»: фолдинг белка обеспечивают очень сложные взаимодействия, так что синтетический белок, вероятно, примет иную структуру. Модель 3: иная укладка. Аргумент «за»: фолдинг белка обеспечивают очень сложные взаимодействия, так что синтетический белок, вероятно, примет какую-то иную структуру. Аргумент «против»: поскольку отдельные структуры синтетического и природного белков являются зеркальными отражениями друг друга, целая молекула синтетического белка тоже примет структуру зеркального отражения природного белка. д) Модель 1: Фермент оказался активным по отношению к энантиомеру природного субстрата и ингибируется энантиомером природного ингибитора. Это означает, что D-протеаза является зеркальным отражением L-протеазы. е) Краситель Эванса — ахиральная молекула и связывается с обеими формами фермента, ж) Нет. Химотрипсин не расщепляет D-протеазу, поскольку протеазы содержат только L-аминокислоты и распознают только L-пептиды. з) Не всегда. В зависимости от особенностей фермента при его синтезе могут возникать различные проблемы, перечисленные в пункте (б), в результате чего фермент может оказаться неактивным.
Глава 5
1. Белок В обладает более высоким сродством к лиганду X: для него полунасыщение достигается при значительно меньшей концентрации X, чем для белка А. Для белка А Кa = 106 М-1, для белка В Кa = 109М-1.
2. Во всех трех случаях nH <1. При связывании лиганда кажущуюся отрицательную кооперативности можно объяснить наличием в белке центров связывания двух или нескольких типов с разным сродством к лиганду или присутствием нескольких белков в растворе. Кажущаяся отрицательная кооперативности часто наблюдается в гетерогенных белковых образцах. Примеров истинной отрицательной кооперативности известно совсем немного.
3. а) Снижается; б) повышается; в) снижается; г) снижается.
4. kd = 8,9 • 10-5 с-1.
5. Кооперативность связывания кислорода гемоглобином обусловлена взаимодействиями между субъединицами этого белка.
6. а) Тот факт, что гемоглобин А (НbА, гемоглобин матери) при рO2 = 4 кПа насыщен примерно на 60%, тогда как гемоглобин F (НbF, гемоглобин плода) в тех же условиях насыщен более чем на 90%, указывает на более высокое сродство НbF к O2 по сравнению с НbА. б) Более высокое сродство НbF к кислороду обеспечивает перемещение кислорода из материнской крови в кровь плода через плаценту. Кровь плода близка к насыщению кислородом за счет сравнительно низкого сродства НbА к кислороду. в) Тот факт, что кривая насыщения НbА кислородом при связывании БФГ сдвигается сильнее, чем кривая насыщения НbF, говорит о том, что НbА связывает БФГ прочнее, чем НbF. Различие в связывании БФГ двумя типами гемоглобина может определять их различное сродство к O2.
7. a) Hb Memphis; 6) HbS, Hb Milwaukee, Hb Providence, возможно Hb Cowtown; в) Hb Providence.
8. Сильнее. Неспособность образовывать тетрамеры ограничивает кооперативность связывания в случае этих вариантов, и кривая связывания принимает более выраженный гиперболический характер. Также повреждается центр связывания БФГ. Кислород, скорее всего, связывается сильнее, поскольку в отсутствие связанного БФГ белок находится в высокоаффинном состоянии R
9. а) 1 • 10-8 М; б) 5 • 10-8 М; в) 8 • 10-8 М; г) 2 • 10-7 М.
Замечание: уравнение 5-8 можно привести к виду [L] = θ Kd/ (1 - θ).
10. Скорее всего, эпитопом является некая структура, которая оказывается скрытой при связывании G-актина с F-актином.
11. Во многих патогенах, включая ВИЧ, возникли механизмы, с помощью которых они могут постоянно изменять структуру поверхностных белков, с которыми изначально связывались компоненты иммунной системы. В результате хозяйский организм каждый раз встречается с новыми антигенами, для уничтожения которых иммунной системе требуется время. Как только иммунная система реагирует на один вариант, сразу же появляется другой.
12. Связывание миозина с АТР вызывает диссоциацию миозина из комплекса с тонкими активновыми филаментами. Когда АТР отсутствует, актин и миозин прочно связаны друг с другом.
14. a) L - легкая цепь, а Н - тяжелая цепь Fab-фрагмента данного антитела. Цепь Y - это лизоцим б) В вариабельной и константной областях фрагмента преобладают β-структуры. в) В тяжелой цепи 218 остатков, в легкой цепи 214 остатков, в лизоциме 129 остатков. В контакте с Fab-фрагментом находится менее 15% молекулы лизоцима, г) Из последовательности Н-цепи в контакте с лизоцимом могут находиться Gly31, Tyr32, Arg99, Asp100 и Туr101. Из последовательности L-цепи - Туr82, Туr49, Туr50 и Тrр92. В зоне контакта антиген-антитело находятся следующие остатки лизоцима: Asn19, Gly22, Туr28, Ser24, Lys116, Gly117, Thr118, Asp119, Gln121и Arg125. Не все эти остатки расположены рядом друг с другом в первичной структуре. Центр связывания антигена образуется из различных участков белковой последовательности при их сближении в процессе укладки.
15. а) Наибольшим сродством к лиганду L обладает белок с Кd = 5 мкМ. В случае Кd = 10 мкМ удвоение [L] от 0,2 до 0,4 мкМ (что намного ниже Кd) приводит почти к двукратному увеличению θ (на самом деле значение возрастает в 1,96 раза). Это свойство гиперболической зависимости; при низких концентрациях лиганда θ почти линейным образом зависит от [L]. Напротив, удвоение [L] от 40 до 80 мкМ (это выше значения Кd; в этой области кривая связывания приближается к своему асимптотическому пределу) приводит к росту θ всего в 1.1 раза. Идентичное увеличение фактора 0 наблюдается для кривых, построенных на основании уравнения 5-11. б) θ = 0,998. в) Результаты зависят от значений вводимых параметров.
16. а)
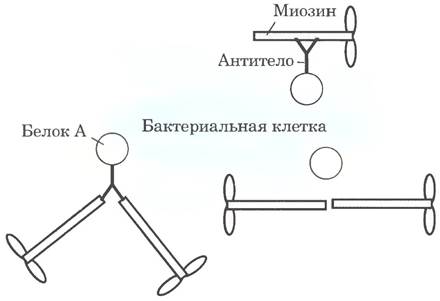
Рисунок выполнен не в масштабе. В реальности на поверхности любой клетки связано гораздо больше молекул миозина, б) АТР является источником энергии, приводящей систему в движение (см. гл. 13). в) Если бы исследователи использовали антитело, которое связывается не с «хвостом» миозина, а с «головкой», где расположен участок связывания актина, это не позволило бы актину связаться с миозином и, следовательно, предотвратило бы перемещение. Антитело, которое связывается с актином, также мешало бы связыванию и перемещению, г) Есть два возможных объяснения. (1) Трипсин расщепляет пептидную связь только у остатков Lys и Arg (см. табл. 3-7), так что в белке существует лишь небольшое число возможных участков расщепления трипсином. (2) Не все остатки Arg и Lys одинаково доступны для фермента; первым расщепляется наиболее доступный сайт, д) Модель S1. «Шарнирная модель» предсказывает, что двигаться могут только комплексы шарик/антитела/НММ (с шарниром), но не комплексы шарик/антитела/SHMM (без шарнира). Модель S1 предсказывает, что двигаться могут оба типа комплексов, поскольку оба содержат «головку» S1. Тот факт, что система шарик/SНММ (без шарнира) движется, подтверждает справедливость модели S1. е) При низкой плотности связывания молекул миозина шарики время от времени были бы отсоединены от актина. Шарики передвигались бы медленно, поскольку после отсоединения одной молекулы миозина требуется время для присоединения следующей. При высокой плотности связывания миозина после отсоединения одной молекулы сразу же связывается вторая, и движение происходит быстрее, ж) Выше определенной плотности молекул миозина скорость перемещения шариков начинает определяться скоростью, с которой молекулы миозина способны перемещать шарики. Поскольку молекулы миозина движутся с максимальной скоростью, добавление новых молекул не приводит к увеличению скорости, з) Поскольку движущая сила формируется в «головке» S1, повреждение «головки» вполне могло инактивировать молекулу, и SНММ мог потерять способность перемещать шарики, и) Скорее всего, формирование «головки» S1 обеспечивают нековалентные взаимодействия и этого вполне достаточно для сохранения функциональности этого фрагмента.
Глава 6
1. При нагревании теряется активность фермента, превращающего сахар в крахмал.
2. 2,4 • 10-6 М.
3. 9,5 • 108 лет.
4. Фермент-субстратный комплекс устойчивее свободного фермента.
5. а) 190 А; б) при фолдинге белка эти аминокислотные остатки сближаются.
6. Скорость реакции можно определить по уменьшению поглощения NADH при 340 нм в процессе реакции. Сначала определяем Км. При концентрации субстрата » Км измеряем начальную скорость реакции (скорость расходования NАDН, определяется с помощью спектрофотометра) при нескольких концентрациях фермента и строим график зависимости начальной скорости от концентрации фермента. График должен быть линейным, а угол его наклона является мерой активности ЛДГ.
7. (б), (д), (ж).
8. а) 1,7 • 10-3 М; б) 0,33; 0,67; 0,91; в) верхняя кривая соответствует ферменту В (для этого фермента [X]> Км), а нижняя кривая — ферменту А.
9. а) 400 с-1; б) 10 мкМ; в) α = 2, α' = 3; г) смешанный тип ингибирования.
10. а) 24 нМ; б) 4 мкМ v0 = 1/2Vmах, так что [А] = Км); в) 40 мкМ (v0 = 1/2Vmaх, так что [А] = 10 Км в присутствии ингибитора); г) не достигает; kcat/Км = 0,33/ (4 • 10-6 М-1 • с-1) = 8,25 • 104 М-1• с-1, что значительно ниже диффузионно контролируемого предела.
11. Vmах ~ 140 мкМ/мин, Км ~ 1 • 10-5 М.
12. а) Vmах = 51,5 мМ/мин, Км = 0,59 мМ; б) конкурентное ингибирование.
13. Км = 2,2 мМ, Vmaх = 0,50 мкМ/мин.
14. Кривая А.
15. kcat = 2,0 • 107 мин-1.
16. Сохраняются те же приближения, что и при выводе уравнения Михаэлиса-Ментен. Реакция находится в стационарном состоянии, поэтому скорость реакции описывается уравнением v0 =k2[ЕS]. Запишем все известные нам соотношения для определения [ЕS]:
[Е1] = [Е] + [ЕS| + [ЕI] и [ЕI] = [Е][I]/КI
[Е] можно определить, пользуясь уравнением 6-19. Далее следует идти тем же путем, что и при выводе уравнения Михаэлиса-Ментен.
17. Минимальное значение Мr = 29 000.
18. Активность фермента простаты определяется как общая активность фосфатазы в крови за вычетом активности фосфатазы в присутствии достаточного количества тартрата, специфически и полностью ингибирующего эту форму фермента.
19. Смешанный тип ингибирования. Поскольку значение Км практически не изменяется, это может быть примером особого случая смешанного ингибирования, называемого неконкурентным ингибированием.
20. Значение [S], при котором v0 = Vmах/2α', можно найти из правой части уравнения 6-30:
[S]/ (αКм + α'[S]) = 1/2 • α'.
21. Оптимум ферментативной активности достигается, когда остаток Glu35 протонирован, а остаток Аsр52 де- протонирован.
22. а) Увеличится в 1,96 раз; v0 = 50 мкМ • с-1; увеличится в 1,048 раз; б) Когда α = 2,0, кривая сдвигается вправо, поскольку Км увеличивается в 2 раза. Когда α' = 3,0, асимптота кривой (значение Vmах) снижается в 3 раза. Когда α = 2,0, а α' = 3,0, кривая круто поднимается по отношению к кривой, для которой α = α' = 1,0, из-за уменьшения Км. Однако асимптота кривой низкая, поскольку Vmах уменьшается в 3 раза, в) Когда α = 2,0, точка пересечения кривой с осью х сдвигается вправо. Когда α = 2,0, а α' = 3,0, точка пересечения с осью х смещается влево.
23. а) В центре связывания фермента дикого типа субстрат удерживается с помощью водородных связей и ион-дипольных взаимодействий между заряженной боковой цепью остатка Arg109и полярной карбонильной группой пирувата. В процессе катализа заряженная боковая группа Arg109стабилизирует поляризованное карбонильное переходное состояние. В случае мутантного фермента связывание гораздо слабее, поскольку осуществляется исключительно водородными связями, и стабилизации переходного состояния не происходит, что снижает каталитическую активность, б) Остатки Lys и Arg имеют приблизительно одинаковый размер и одинаковый положительный заряд, возможно, они обладают похожими свойствами. Кроме того, поскольку пируват, по-видимому, связан с остатком Arg171ионными силами, можно предположить, что замена Arg на Lys не оказывает серьезного влияния на связывание субстрата, в) В конфигурации «вилки» две положительно заряженные группы Arg могут взаимодействовать с двумя отрицательно заряженными атомами кислорода в молекуле пирувата, что способствует образованию двух связей смешанного типа (водородных связей и ион-дипольных взаимодействий). Если место Arg занимает Lys, возникает лишь одна такая связь, что ослабляет взаимодействие, и ориентирование субстрата происходит менее точно, г) Гидрофобный остаток llе250 взаимодействует с гидрофобным циклом NADIL С гидрофильной боковой цепью Gin такое взаимодействие невозможно, д) Расположение аминокислотных остатков в активном центре мутантной ЛДГ представлено ниже.
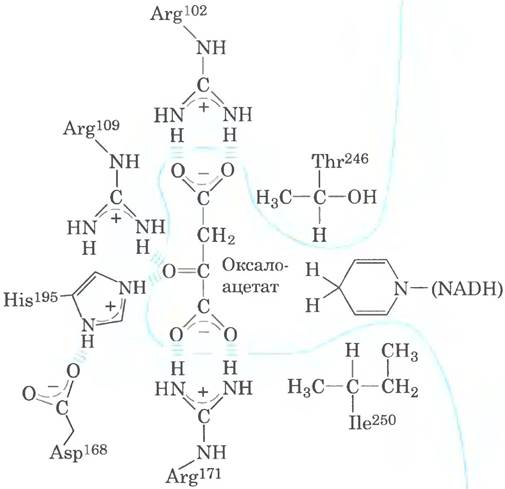
е) Мутантный фермент выталкивает пируват, поскольку гидрофобная метальная группа пирувата не может взаимодействовать с гидрофильной гуанидиновой группой Arg102. Связывание оксалоацетата обеспечивают сильные ионные взаимодействия между боковой цепью Arg102и карбоксильной группой оксалоацетата. ж) Белок должен быть достаточно гибким, чтобы разместить объемную боковую цепь нового аминокислотного остатка и более крупный субстрат.
Глава 7
1. В результате восстановления кислорода карбонила до гидроксила атомы С1 и С3 стали химически эквивалентными: молекула глицерина не имеет хиральных центров.
2. Эпимеры различаются конфигурацией заместителей лишь у одного атома углерода, а) D-альтроза (С2), D-глюкоза (С3), D-гулоза (С4); б) D-идоза (С2), D-галактоза (С3), D-аллоза (С4); в) D-арабиноза (С2), D-ксилоза (С3).
3. При образовании озазона изменяется конфигурация заместителей у атома С2 в альдозах, поэтому альдозы, различающиеся лишь конфигурацией заместителей у атома С2, превращаются в одинаковые соединения с одинаковой температурой плавления.
4. а)
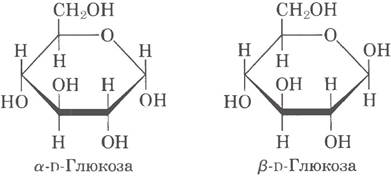
б) Свежеприготовленный раствор α-D-глюкозы или β-D-глюкозы подвергается мутаротации и постепенно образует равновесную смесь α- и β-форм, в) 36% α-формы, 64% β-формы.
5. Для превращения α-D-глюкозы в β-D-глюкозу нужно разорвать связь между атомом С1 и гидроксильной группой у С5 (как на рис. 7-6). Для превращения D-глюкозы в D-маннозу нужно разорвать связь атома С2 либо с - Н, либо с -ОН. Превращения конформации «кресло» не требуют разрыва связей, в этом и заключается главное различие между конфигурацией и конформацией.
6. Нет; глюкоза и галактоза различаются расположением заместителей у атома С4.
7. Оба полимера состоят из звеньев D-глюкозы, но в целлюлозе эти звенья соединены (β1 —> 4)-связыо. а в гликогене (α1 —> 4)-связью. б) Оба соединения -
гексозы, но глюкоза — это альдогексоза, а фруктоза — кетогексоза. в) Оба соединения - дисахариды, но в мальтозе два остатка D-глюкозы соединены (α1 —> 4)-связью, а в сахарозе остатки D-глюкозы и D-фруктозы соединены (α2 «-» 2β)-связью.
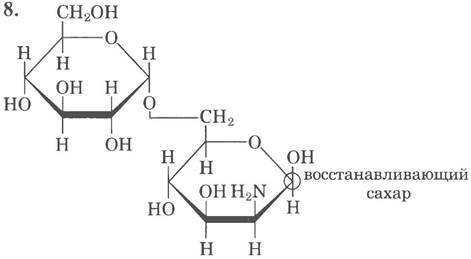
9. Полуацеталь образуется при конденсации альдозы или кетозы со спиртом; гликозид — при конденсации полуацеталя со спиртом (см. рис. 7-5, т. 1, с. 343).
10. При замыкании цикла фруктоза образует либо пиранозу, либо фуранозу. При повышении температуры равновесие сдвигается в сторону фуранозы, а она менее сладкая.
11. Мальтоза; в сахарозе нет восстанавливающей (окисляемой) группы, поскольку аномерные атомы углерода обоих моносахаридных звеньев участвуют в образовании гликозидной связи.
12. Скорость мутаротации достаточно высокая, так что по мере использования ферментом β-D-глюкозы все больше α-D-глюкозы превращается в β-форму, и постепенно окисляется вся глюкоза. Глюкозооксидаза специфична по отношению к глюкозе и не взаимодействует с другими восстанавливающими сахарами (такими как галактоза), которые реагируют с реактивом Фелинга.
13. а) Определить скорость изменения оптического вращения; б) оптическое вращение смеси измеряется относительно раствора сахарозы; в) -2,0°.
14. Смешать сахарозу с водой (начинка), добавить небольшое количество сахаразы (инвертазы) и немедленно покрыть шоколадом.
15. В сахарозе нет свободного аномерного атома углерода, который мог бы подвергаться мутаротации.
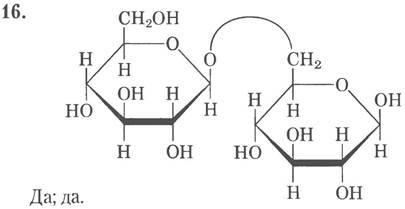
17. N -Ацетил -β-D-глюкозамин — восстанавливающий сахар, его атом С1 может окисляться (см. рис. 7-10. т. 1, с. 347). D-Глюконат — невосстанавливаюший сахар, его атом С1 уже находится в окисленном состоянии, GlсN (α1 «-» 1α)Glс — невосстанавливающий сахар, поскольку аномерные атомы углерода обоих звеньев участвуют в образовании гликозидной связи.
18. В желудочно-кишечном тракте человека нет целлюлаз, и поэтому люди не могут расщеплять целлюлозу.
19. Нативная целлюлоза состоит из мономеров глюкозы, соединенных (β1 —> 4)-гликозидными связями, которые придают цепи вытянутую конформацию. Параллельные цепи образуют между собой водородные связи и собираются в длинные, жесткие и нерастворимые волокна. Гликоген состоит из мономеров глюкозы, соединенных (α1 —> 4)- гликозидными связями, из-за которых полимерные цепи изгибаются и не образуют длинных волокон. Кроме того, гликоген сильно разветвлен и многие из его гидроксилов находятся в контакте с водой, поэтому он легко гидратируется и диспергируется в воде.
Целлюлоза образует структурный каркас- растений, состоящий из протяженных нерастворимых волокон. Гликоген служит запасным веществом в организме животных. Гидратированные гранулы гликогена, содержащие множество невосстанавливающих концов, быстро гидролизуются гликогенфосфорилазой с образованием глюкозо-1 -фосфата.
20. Целлюлоза в несколько раз длиннее; она находится в вытянутой конформации, тогда как амилоза имеет спиральную структуру.
21. 6000 остатков/с.
22. 11с.
23. Шаро-стержневая модель дисахарида на рис. 7-19 (т. 1) не отражает пространственных взаимодействий в молекуле, а вот СРК-модель, в которой относительные размеры атомов соответствуют реальным, может показать стерическое напряжение в конформере -170°, -170°, которого нет в конформере 30°, -40°.
24. Отрицательно заряженные группы в молекуле хондроитинсульфата отталкиваются, что заставляет молекулу принять вытянутую конформацию. Полярные молекулы притягивают множество молекул воды, что увеличивает общий объем молекулы. В сухом виде отрицательные заряды уравновешиваются положительными противоионами, и молекула укорачивается.
25. Положительно заряженные аминокислотные остатки связываются с отрицательно заряженными группами гепарина. Известно, что с гепарином взаимодействует остаток Lys антитромбина III.
26. Восемь возможных последовательностей, 144 связи и 64 стереоизомера - всего 73 728 перестановок!
27.

28. Олигосахарид; мономерные звенья сахаров могут комбинироваться большим числом способов, чем звенья олигопептидов. Каждая гидроксильная группа может участвовать в образовании гликозидной связи, и сама эта связь может иметь α- или β-конфигурацию. Полимер может быть, как линейным, так и разветвленным.
29. а) 2,3 -ди-О-метилглюкоза образуется из остатков, расположенных в точках ветвления, все остальные остатки превращаются в 2,3,6-три-О- метилглюкозу; б) 3,75/о.
30. Остатки D-глюкозы соединены (1 —> 6)-связями; боковые разветвления (примерно через каждые 20 остатков) - (1 —> 3)-связями.
31. а) Нужно растворить небольшое количество образца в разных растворителях, а затем исследовать растворы и нерастворенные осадки, чтобы установить, различаются ли они по химическому составу, б) Все молекулы чистого вещества идентичны, поэтому химический состав этого вещества в растворе и осадке одинаков. В грязном веществе содержится более одного компонента. В каком-то из растворителей один из компонентов может растворяться лучше другого. Поэтому составы раствора и осадка различны, в) Данные количественного анализа позволяют утверждать, что при деградации ферментативная активность не теряется. Для определения структуры молекулы очень важно, чтобы в образце находились только интактные (неповрежденные) молекулы. Если же образец подвергся частичному разрушению, результаты структурного анализа будут неточными и, возможно, неинтерпретируемыми. Количественный анализ позволяет определить очень незначительную ферментативную активность даже при больших разрушениях образца, г) Результаты 1 и 2. Результат 1 согласуется с известной структурой: антиген В содержит три молекулы галактозы, а антигены Л и 0 - только по две. Результат 2: антиген А содержит два аминосахара - N-ацетилгалактозамин и N-ацетилглюкозамин, а антигены В и 0 только один N-ацетилглюкозамин. Результат 3 не согласуется с известными фактами: в антигене А соотношение глюкозамина и галактозамина составляет 1 : 1, а в антигене В - 1 : 0. д) Возможно, образцы содержали примесь или были частично разрушены. Первые два результата оказались верными, поскольку метод анализа был лишь полуколичественным и недостаточно чувствительным, чтобы зафиксировать присутствие примесей. Третий результат количественный и, следовательно, больше отклоняется от предсказанных значений из-за присутствия примеси или разрушения образца. е) Экзогликозидаза. Эндогликозидаза расщепляла бы антиген 0 на галактозу, N-ацетилгалактозамин или N-ацетилглюкозамин, и, хотя бы один из этих сахаров должен был ингибировать расщепление. Поскольку ни один из этих сахаров не ингибировал активность фермента, это была экзогликозидаза, отщеплявшая от цепи лишь концевую группу. Концевым сахаром в молекуле антигена 0 является фукоза, так что фукоза - единственный сахар, который мог бы ингибировать расщепление антигена 0. ж) Эта экзогликозидаза отщепляет N-ацетилгалактозамин от антигена А и галактозу от антигена В. Поскольку в результате этих реакций фукоза не образуется, она не ингибирует расщепление, и образующиеся продукты деградации уже не обладают активностью антигенов А и 0. Однако продукты реакции обладают активностью антигена 0, поскольку расщепление останавливается на фукозе. з) Все результаты согласуются с тем, что изображено на рис. 10-15 (т. 1). На конце антигена 0 расположена фукоза. и лишь фукоза могла бы ингибировать его расщепление. На конце антигена А находится N-ацетилгалактозамин, и лишь этот сахар защищает антиген А от расщепления. Концевой сахар антигена В — галактоза, и это единственный сахар, защищающий антиген В от расщепления.
Глава 8
1. N-3 и N-7.
2. (5') GСGСААТАТТТТGАGАААТАТТGСGС (3'); последовательность содержит палиндром, что позволит отдельным нитям образовывать шпильку, а две нити могут образовать крестообразную структуру.
3. 9,4 • 10-4 г.
4. а) 40°; б) 0°.
5. Спираль РНК имеет конформацию А, а спираль ДНК обычно находится в конформации В.
6. В ДНК эукариот около 5% остатков цитозина метилированы. 5-Метилцитозин спонтанным образом дезаминируется, превращаясь в тимин; образующиеся пары G-Т являются одной из самых распространенных ошибок в ДНК эукариотической клетки.
7. Кольцо рибозы без основания может раскрываться и переходить в нециклическую альдегидную форму. Это, а также исчезновение стекинговых взаимодействий между основаниями может объяснять увеличение подвижности ДНК.
8. Стекинговые взаимодействия в нуклеиновых кислотах приводят к уменьшению поглощения в УФ- области. При денатурации стекинговые взаимодействия исчезают, и поглощение увеличивается.
9. 0,35 мг/мл
10.
Растворимость: фосфат> дезоксирибоза> гуанин Сильнополяризованные фосфатные группы и остатки сахара располагаются на внешней поверхности двойной спирали и находятся в контакте с водой, тогда как гидрофобные основания располагаются внутри спирали.
11. Без наличия в смеси dСТР на месте первого же встреченного в матрице остатка встроится ddСТР, и полимеризация прекратится. В геле лишь одна полоса.
12.
13. (5') Р-GCGCCAUUGC (3')-ОН
(5') Р-GCGCCAUUG (3')-ОН
(5') P-GCGCCAUU (3')-ОН
(5') P-GCGCCAU (3')-ОН
(5') Р-GCGCCA (3')-ОН
(5') Р-GGGCC (3')-ОН
(5') Р-GCGC (3')-ОН
(5') Р-GCG (3')- ОН
(5') Р-GС (3')-ОН
и нуклеозид-5'-фосфаты
14. а) Вода обязательный участник большинства химических реакций, включая те, что вызывают мутации. Снижение содержания воды в эндоспорах ослабляет активность ферментов, вызывающих мутации, и снижает скорость неферментативных потерь пурина, имеющих гидролитический механизм. б) УФ-облучение способствует образованию циклобутановых пиримидиновых димеров. Поскольку В. subtilis обитает в почве, ее споры могут подниматься на поверхность почвы или в воздух и подвергаться длительному УФ-облучению.
15. Концевая группа DMT предотвращает реакцию основания с самим собой.
16. а) Правая спираль. На одном 5'-конце расположен аденин, на другом 5'-конце — цитидин. б) Левая спираль, в) Если вам не удается увидеть стереоизображение, обратитесь к Интернету.
17. а) Это непростая задача. Образцы из одного и того же организма достаточно сильно различаются, а выход никогда не достигает 100%. Значения для С и Т согласуются значительно лучше, чем для А и G, так что для С и Т проще доказать, что все образцы из одного организма имеют одинаковый состав. Однако даже в случае А и G верно следующее: (1) диапазоны значений для разных тканей в значительной степени перекрываются: (2) различия между разными образцами из одной и той же ткани примерно такие же, как и различия между образцами из разных тканей; (3) в образцах с наиболее высоким выходом значения согласуются лучше, б) Данный метод недостаточно чувствителен, чтобы выявить различия между здоровой и опухолевой тканями. Опухоль связана с появлением мутаций, но таких мутаций всего несколько на миллиард, что слишком мало, чтобы выявить их данным методом, в) У разных видов отношения А: G и Т: С очень сильно варьируют. Например, для бактерии Serratia marcescens оба отношения составляют 0,4, что говорит о том, что в последовательности этой ДНК преобладают G и С. Напротив, для бактерии Haemophilus influenzae эти соотношения составляют 1,74 и 1,54, т. е. ее ДНК состоит главным образом из А и Т. г) Для справедливости этого утверждения должны выполняться три условия. (1) А = Т; данные таблицы показывают, что во всех случаях отношение А : Т близко к единице. Очевидно, что вариации этого соотношения значительно слабее, чем вариации отношений А : G и Т : С. (2) G = C; опять же, отношение G : С близко к единице, а другие отношения варьируют сильнее. (3) (А + G) = (Т + С); это соотношение пуринов к пиримидинам, которое также близко к единице, д) Разные фракции «ядра» соответствуют разным участкам ДНК проростков пшеницы. Если бы ДНК представляла собой монотонно повторяющуюся последовательность, нуклеотидный состав всех участков был бы одинаковым. То, что разные фракции «ядра» имеют разный состав, говорит о более сложном характере последовательности.
Глава 9
1. а) (5')---G(3') и (5')ААТТС---(3')
(3')---СТТАА(5') (3')G---(5')
б) (5')---GAATT(3') и (5')ААТТС---(3')
(3')---СТТАА(5') (3')TTAAG---(5')
в) (5')---GAATTAATTC---(3')
(3')---CTTAATTAAG---(5')
г) (5')---G(3') и (5')С---(3')
(3') --- С(5') (3')G---(5')
д) (5')---GAATTС---(3')
(3')---CTTAAG---(5')
е) (5')---CAG(3') и (5')CTG---(3')
(3')---GTC(5') (3')GAC---(5')
ж) (5')---CAGAATTC---(3')
(3')---GTCTTAAG---(5')
з) Метод 1: расщепить ДНК рестриктазой EcoRI, как в пункте (а), обработать, как в пункте (б) или (г), а затем лигировать синтетический фрагмент с двумя тупыми концами с последовательностью узнавания рестриктазы ВamHI. Метод 2 (более эффективный): синтезировать фрагмент ДНК со следующей структурой:
(5')AATTGGATCC(3')
(3')CCTAGGTTAA(5')
Этот фрагмент эффективно лигируется с липкими концами фрагментов, образующихся в результате расщепления рестриктазой EcoRI. Так можно встроить сайт узнавания для рестриктазы ВаmHI, но при этом сайт узнавания EcoRI исчезает.
и) Эти четыре фрагмента (в том же порядке, в котором они упомянуты в вопросе) следующие (N - любой нуклеотид):
(5') AATTCNNNNCTGCA (3')
(3') GNNNNG (5')
(5') AATTCNNNNGTGCA (3')
(3') GNNNNC (5')
(5') AATTGNNNNCTGCA (3')
(3') CNNNNG (5')
(5') AATTGNNNNGTGCA (3')
(3') CNNNNC (5')
2. ДНК фага λ может быть упакована в инфекционные фаговые частицы только в том случае, если ее размер составляет от 40 000 до 53 000 п. н. Поскольку векторы на основе бактериофагов обычно содержат около 30 000 п. н., они не могут образовывать фаговые частицы, если в них не встраивается дополнительная ДНК необходимой длины (от 10 000 до 23 000 п. н.).
3. а) Восстановленные плазмиды pBR322 без вставки чужеродной ДНК, они сохраняют устойчивость к ампициллину. Кроме того, две или более молекул pBR322 могут смыкаться в кольцо как содержащее, так и не содержащее вставки, б) На дорожках 1 и 2 разделены образцы, содержащие вставку ДНК в разной ориентации. На дорожку 3 нанесен образец, содержащий два фрагмента ДНК, встроенных таким образом, что соединенными оказались проксимальные концы, образующиеся при расщеплении EcoRI.
4. Обратим внимание на аминокислоты, для которых существует минимальное число кодонов: Met и Тrр. Лучше всего охватить последовательность от кодона для первого Тrр до первых двух нуклеотидов кодона для llе. Такой зонд имеет следующую последовательность:
(5') UGGUA (U/C) UG (U/C) AUGGA (U/C) UGGAU
Синтезировать нужно так, чтобы в каждой из указанных позиций стоял либо U, либо С, в результате чего получится смесь из восьми 20-нуклеотидных зондов, различающихся только по одной или нескольким из указанных позиций.
5. Понадобятся ДНК-праймеры, термостабильная ДНК-полимераза, дезоксинуклеозидтрифосфаты и термоциклер (аппарат для проведения ПЦР). Праймеры нужно синтезировать так, чтобы они охватывали участок ДНК с повтором CAG. На рисунке изображена кодирующая нить, ориентированная слева направо в направлении 5' —> 3'. Левый праймер должен быть идентичен любой последовательности из 25 нуклеотидов, находящихся слева от повтора CAG. Правый праймер должен быть
представлен последовательностью комплементарной и антипараллельной к последовательности из 25 нуклеотидов, расположенных справа от повтора САG. С помощью этих праймеров можно амплифицировать участок ДНК, содержащий повтор САG, и определить его размер методом электрофореза путем сопоставления с маркерными последовательностями. Длина этого фрагмента ДНК соответствует длине повтора САG; на этом основан диагностический тест.
6. Можно использовать ПЦР-праймеры, комплементарные ДНК из удаленного сегмента, но такие, которые направляют синтез ДНК не навстречу друг другу, а в противоположные стороны. Продукт ПЦР образуется лишь в том случае, если концы удаленного сегмента смыкаются с образованием кольцевой структуры.
7. Чтобы светиться, растению, экспрессирующему люциферазу светляков, нужен субстрат (люциферин), тогда как растение, экспрессирующее зеленый флуоресцентный белок, светится вне зависимости от наличия других веществ.
8. Нельзя исключить ни одного ребенка, так как каждый содержит фрагменты ДНК, которые он мог унаследовать от отца.
9.
10. Исключительно из соображений удобства; Ti- плазмида (200 000 п. н.) даже при удалении Т-ДНК слишком велика, чтобы ее можно было количественно выделить из клеток и манипулировать ею in vitro. Она также слишком велика для обратного внедрения в клетки с помощью стандартной процедуры трансформации. Гены vir облегчают перенос любой ДНК между повторами Т-ДНК, даже если они находятся на разных плазмидах. Вторая плазмида в этой двухплазмидной системе, содержащая только повторы Т-ДНК и несколько последовательностей для отбора плазмиды и ее репликации, имеет сравнительно небольшой размер; ее легко выделить и ею легко манипулировать (в частности, вводить и изменять чужеродную ДНК).
11.
12. Закройте лунку 4, добавьте раствор активированного Т, осветите, отмойте.
1. А-Т 2. G-Т 3. A-T 4. G-C
Закройте лунки 2 и 4, добавьте раствор активированного G, осветите, отмойте.
1. А-Т-G 2. G-Т 3. А-Т-G 4. G-С
Закройте лунку 3, добавьте раствор активированного С, осветите, отмойте.
1. А-Т-G 2. G-Т-С 3. А-Т-G 4. G-С С
Закройте лунки 1,3 и 4, добавьте раствор активированного С, осветите, отмойте.
1. А-Т-G-С 2. G-Т-С-С 3. А-Т-G 4. G-С-С
Закройте лунки 1 и 2, добавьте раствор активированного G, осветите, отмойте.
1. А-Т-G-С 2. G-Т-C-С 3. А-Т-G-С 4. G С-С-С
13. Такие векторы вводятся в клетки, инфицированные вирусом-помощником, который обеспечивает все необходимое для репликации и упаковки, но сам не может упаковываться. С помощью этих векторов рекомбинантная ДНК встраивается в хромосому хозяйской клетки, причем эта интеграция очень стабильная, так как отсутствие функции рекомбинации и упаковки предотвращает делению и рекомбинацию интегрированной ДНК.
14. а) Растворы ДНК очень вязкие, так как содержат очень длинные, переплетенные между собой молекулы. Чем короче молекулы, тем в меньшей степени они переплетаются и тем ниже вязкость их растворов. Поэтому снижение вязкости означает укорочение нитей полимера, что связано с активностью нуклеазы. б) Это эндонуклеаза. Экзонуклеаза отщепляет отдельные нуклеотиды от 5'- и 3'-концов цепи, в результате чего образуются растворимые в ТХУ меченные 32Р нуклеотиды. Эндонуклеаза расщепляет внутренние связи в молекуле ДНК, в результате чего растворимых в ТХУ меченных 32Р фрагментов образуется мало, в) На 5'-конце. Если бы фосфатная группа осталась на 3'-конце, киназа включила бы значительное количество 32Р, поскольку присоединяет фосфатные группы к 5’-концу цепи, и обработка фосфатазой не оказала бы никакого влияния. В таком случае образцы А и В содержали бы значительное количество 32Р. Если же фосфат остается на 5'-конце, киназа не может включать 32Р, поскольку не может присоединять фосфатную группу к уже существующей. Фосфатаза удаляет фосфат с 5'-конца, и тогда киназа может включать значительное количество 32Р. В таком случае в образце А содержится очень мало метки, а в образце В - значительно больше, что и наблюдалось в эксперименте, г) Случайные разрывы привели бы к образованию фрагментов со случайным распределением по размеру; образование специфических фрагментов говорит в пользу специфического действия фермента, д) Фермент распознает фрагмент и расщепляет его. В результате на 5'-конце этого фрагмента остается специфическая последовательность. Если бы расщепление происходило вблизи сайта узнавания, но не в нем самом, последовательность 5'-концов каждый раз была бы разной, е) Эти результаты согласуются с двумя вариантами последовательности (место расщепления показано стрелкой):

Глава 10
1. Липидами называют не соединения со специфической химической структурой, а те вещества, которые лучше растворяются в органических растворителях, чем в воде.
2. а) Число цис-двойных связей. Каждая цис-двойная связь вызывает изгиб углеводородной цепи, снижая температуру плавления, б) Можно создать шесть разных триацилглицеринов, температура плавления которых повышается в следующем ряду:
ООО <OOP = ОРО <РРО = POP < PPP1,
где О = олеиновая кислота, Р = пальмитиновая кислота. в) Жирные кислоты с разветвленной цепью повышают текучесть мембран, поскольку снижают плотность упаковки мембранных липидов.
3. Лецитин, являющийся амфифильным соединением, выступает в качестве эмульгатора, облегчающего солюбилизацию масла.
4.
5. Мята — это (R)-карвон, тмин (S)-карвон.
6.
7. Гидрофобные элементы: (а) две жирные кислоты; (б), (в) и (г) одна жирная кислота и углеводородная цепь сфингозина; (д) стероидное ядро и ацильная боковая группа. Гидрофильные элементы: (а) фосфоэтаноламин; (б) фосфохолин; (в) D-галактоза; (г) остатки сахаров; (д) спиртовые группы (ОH- группы).
8.
9. Процесс приводит к восстановлению двойных связей, что повышает температуру плавления липидов, содержащих соответствующую жирную кислоту.
10. Триацилглицерины в составе животного жира (сала) гидролизуются под действием NaОН с образованием мыла (омыление), которые гораздо лучше растворимо в воде, чем исходные соединения.
11. Это может быть только сфинголипид (сфингомиелин).
12.
13.Длинные цепи насыщенных углеводородов, практически твердые при температуре окружающей среды, образуют на поверхности листьев гидрофобный слой, через который такие полярные соединения, как вода, проникать не могут.
14. а) Свободная ОН-группа у атома С2 и фосфохолиновая головка у атома С3 являются гидрофильными; жирная кислота у атома С1 лизолецитина является гидрофобной, б) Некоторые стероиды, такие как преднизон, ингибируют действие фосфолипазы А2, блокируя отщепление арахидоновой кислоты от атома С2. Арахидоновая кислота является исходным соединением для множества эйкозаноидов, некоторые из них вызывают боль и воспаление, в) Фосфолипаза А2 высвобождает арахидоновую кислоту — предшественник других эйкозаноидов, выполняющих важные защитные функции в организме. Кроме того, фермент расщепляет поступающие с пищей глицерофосфолипиды.
15. Группу крови определяет олигосахарид головной группы мембранного сфинголипида (см. рис. 10-15, т. 1, с. 503). Этот же олигосахарид соединен с некоторыми мембранными гликопротеинами, которые также служат участками узнавания для антител, распознающих группу крови.
16. Диацилглицерин — это гидрофобное вещество, которое остается в мембране. Инозит-1,4,5-трифосфат — полярное и очень хорошо растворимое в воде вещество, которое гораздо легче диффундирует в цитозоль. Оба вещества выполняют функцию вторичных посредников.
17. Водорастворимые витамины быстро выводятся с мочой и не накапливаются в организме. Жирорастворимые витамины очень плохо растворяются в воде и запасаются в организме в составе липидов.
18. а) Глицерин и натриевые соли пальмитиновой и стеариновой кислот; б) D-глицерин-3-фосфохолин и натриевые соли пальмитиновой и олеиновой кислот.
19. Растворимость в воде: моноацилглицерин> диацилглицерин> триацилглицерин.
20. Вещества сходят с колонки в следующем порядке: холестерилпальмитат и триацилглицерин; холестерин и н-тетрадеканол; фосфатидилхолин и фосфатидилэтаноламин; сфингомиелин; фосфатидил- серин и пальмитат.
21. а) Следует подвергнуть продукты кислотного гидролиза каждого соединения хроматографическому разделению (газожидкостная хроматография или тонкослойная хроматография на силикагеле) и сравнить результаты с известными стандартами. Гидролизат сфингомиелина: сфингозин, жирные кислоты, фосфохолин, холин и фосфат; гидролизат цереброзида: сфингозин, жирные кислоты, сахара, но не фосфаты, б) Сильнощелочной гидролиз сфингомиелина приводит к появлению сфингозина, при гидролизе фосфатидилхолина выделяется глицерин. Состав продуктов гидролиза можно проанализировать методом тонкослойной хроматографии путем сравнения со стандартными веществами или с помощью реакции с FDNВ (окрашенный продукт образуется только в реакции со сфинго- зином). Свободные жирные кислоты выделяются при обработке фосфолипазой А1 или А2 только фосфатидилхолина, но не сфингомиелина.
22. Фосфатидилэтаноламин и фосфатидилсерин.
23. а) СМ1 и глобозид. И глюкоза, и галактоза относятся к гексозам, так что «гексоза» соответствует эквимолярной смеси глюкоза + галактоза. Молярные соотношения для четырех ганглиозидов следующие: СМ1 — 1:3:1:1, GМ2 - 1:2 : 1:1, GМ3 - 1: 2 :0:1, глобозид - 1 : 3 : 1 : 0. б) Да, соответствует; при болезни Тея-Сакса накапливается GМ2 (1 : 2 : 1 : 1; см. т. 1, доп. 1-2, рис. 1). в) Этот метод анализа аналогичен тому, что был использован Сенгером для определения аминокислотной последовательности инсулина. Анализ каждого фрагмента позволяет найти только его состав, но не последовательность, но поскольку каждый фрагмент отличается от предыдущего лишь на один остаток сахара, можно определить последовательность звеньев. Структура нормального асиалоганглиозида: церамид-глюкоза-галактоза-галактозамин-галактоза (что соответствует последовательности, изображенной в дополнении 10-2 (т.Neu5Ас). г) Асиалоганглиозид при болезни Тея-Сакса имеет последовательность церамид- глюкоза-галактоза- галактозамин, что соответствует данным, представленным в доп. 10-2 (т. 1). д) Строение нормального асиалоганглиозида GM1 следующее: церамид-глюкоза (2 ОН-группы участвуют в образовании гликозид- ных связей, 1 ОН-группа задействована в кольце, 3 ОН-группы (2,3,6) свободны и подвергаются метилированию) — галактоза (2 ОН — в гликозидных связях, 1 ОН — в кольце, 3 ОН (2,4,6) свободны для метилирования)-галактозамин (2 ОН — в гликозидных связях, 1 ОН — в кольце, 1 NН2 (вместо ОН) и 2 ОН (4,6) свободны для метилирования)- галактоза (1 ОН — в гликозидной связи, 1 ОН в кольце и 4 ОН (2,3,4,6) свободны для метилирования). е) Не хватает следующих данных: (1) какой связью соединены между собой звенья и (2) где присоединена Nеu5Ас?
Глава 11
1. Зная количество липида, его молекулярную массу и площадь поверхности монослоя (определенную, как показано на рисунке), можно рассчитать площадь поверхности одной молекулы.
2. Данные указывают на существование двойного липидного слоя в эритроцитах собаки: единичная клетка с площадью поверхности 98 мкм2 окружена монослоем липидов площадью 200 мкм2. В случае овцы и человека данные указывают на то, что клетки покрыты не двойным, а одинарным липидным слоем. Эти ранние эксперименты были выполнены с довольно низкой точностью, более поздние эксперименты подтвердили существование двойного липидного слоя во всех случаях.
3. 63 молекулы SDS на одну мицеллу
4. а) Липиды, образующие двойной слой, являются амфифильными молекулами: они содержат и гидрофильный, и гидрофобный участки. Для минимизации области контакта с водой липиды образуют двумерные слои, в которых гидрофильные участки обращены к воде, а гидрофобные сосредоточены внутри липидного слоя. Кроме того, чтобы границы слоя не контактировали с водой, двойной липидный слой замыкается сам на себя, б) Эти слои образуют замкнутые мембраны, обволакивающие клетки и внутриклеточные отделы (органеллы).
5. 2 нм; длина двух вытянутых друг за другом молекул пальмитата составляет примерно 4 нм, что приблизительно соответствует толщине типичного двойного слоя липидов.
6. Снижение скорости диффузии. Перемещение отдельных молекул липидов в двойном слое происходит гораздо быстрее при 37 °С, когда липиды находятся в «жидкой» фазе, чем при 10 °С, когда они находятся в «твердой» фазе.
7. 35 кДж/моль, если не учитывать влияние трансмембранного электрического потенциала; 0,60 моль.
8. 13 кДж/моль
9. Большая часть потребляемого тканью кислорода расходуется на окислительное фосфорилирование, за счет которого образуется основное количество клеточного АТР. Следовательно, около 2/3 синтезируемого почками АТР расходуется на перекачивание ионов К+ и Nа+.
10. Не нарушает. Система симпорта может переносить более одного эквивалента ионов Nа+ при переносе каждого моля глюкозы.
11. Экстракция солью указывает на периферическую локализацию белка, а недоступность белка для протеазы в интактных клетках указывает на его внутриклеточную локализацию. Судя по всему, белок X является периферическим белком, находящимся на цитозольной стороне мембраны.
12. Гидрофобные взаимодействия между мембранными липидами являются нековалентными и обратимыми, что позволяет мембранам самопроизвольно восстанавливаться при повреждении.
13. Температура конечностей ниже температуры туловища. Поскольку клеточные липиды даже при низкой температуре должны сохранять подвижность, они должны содержать больше ненасыщенных жирных кислот. Ненасыщенные жирные кислоты снижают температуру плавления липидных смесей.
14. Перемещение полярных и иногда заряженных групп головок через гидрофобную внутреннюю среду двойного липидного слоя очень невыгодно энергетически.
15. При pH 7 триптофан несет и положительный, и отрицательный заряды, а индол не заряжен. Перемещение менее полярного индола через гидрофобную среду внутри двойного липидного слоя требует значительно меньших энергетических затрат.
16 3- 10-12 с
17. Обработать суспензию клеток немеченым NЕМ в присутствии избытка лактозы, затем удалить лактозу и добавить NЕМ, меченный радиоактивной меткой. Использовать электрофорез в присутствии SDS для определения Мr полосы с радиоактивной меткой (переносчик).
18. Построить график гидропатии; гидрофобные участки 20 или более остатков могут составлять трансмембранные сегменты. Определить, взаимодействует ли белок из интактных эритроцитов с проходящими через мембрану реагентами, специфичными к первичным аминам. Если да, то вы имеете дело с переносчиком типа I.
19. Переносчик лейцина специфичен к L-изомеру, однако в его центре связывания может связываться не только L-лейцин, но и L-валин. Снижение Vmах в отсутствии Nа+ указывает на перенос лейцина (или валина) по механизму симпорта с ионами
20. Vmах снижается, Кt не меняется.
21. Около 1%. Оценка получена путем расчета площади поверхности клетки и с учетом наличия 10 000 копий молекул переносчика (на основании размеров молекулы гемоглобина в качестве модели глобулярного белка, см. с. 233).
22.
Аминокислоты (V, L, F и С) с наибольшим индексом гидропатии сосредоточены на одной стороне спирали. Амфифильная спираль как бы погружается в двойной липидный слой атой своей гидрофобной поверхностью, тогда как другая поверхность обращена к воде. В альтернативном варианте несколько спиралей могут сближаться своими гидрофобными участками, которые при этом также обращены к двойному липидному слою.
23. Примерно 22. Чтобы оценить долю поверхности мембраны, покрытой фосфолипидами, нужно знать (или оценить) среднюю площадь поперечного сечения молекулы фосфолипида в двойном слое (например, с помощью эксперимента, описанного в проблеме 1 в данной главе) и среднюю площадь поперечного сечения белка с молекулярной массой 50 кДа.
24. а) Длина участка α-спирали, приходящаяся на одно основание (гл. 4), составляет около 1,5 А = 0,15 нм. Чтобы пересечь двойной липидный слой толщиной 4 нм, спираль должна содержать примерно 27 остатков. Следовательно, чтобы сформировать семь таких участков, белок должен содержать примерно 190 остатков. Белок с массой Мr 64 000 состоит примерно из 580 остатков, б) Для выявления трансмембранных участков пользуются индексами гидропатии, в) Поскольку почти половина этого участка рецептора адреналина состоит из заряженных остатков, возможно, он представляет собой внутриклеточную петлю, соединяющую два соседних трансмембранных участка, г) Поскольку спираль состоит в основном из гидрофобных остатков, этот участок рецептора, вероятно, образует одну из трансмембранных спиралей.
25. а) Модель А: согласуется. Две темные полосы, это либо слои белка, либо головки фосфолипидов, а светлое пространство - соответственно либо двойной слой, либо гидрофобное ядро. Модель Б: не согласуется. Данная модель предполагает более или менее равномерное окрашивание окружающего клетки слоя. Модель В: согласуется, но с одном условием. Две темные полосы - это головки фосфолипидов, светлая зона - хвосты. Это означает, что мембранные белки невидимы, поскольку они не окрашиваю гея осмием или не содержатся в данном участке мембраны, б) Модель А: согласуется. «Голый» двойной слой (4,5 нм) плюс два слоя белка (2 нм) в сумме составляют 6,5 нм, что соответствует экспериментальной толщине мембраны. Модель Б: ничего нельзя сказать, поскольку данная модель не предсказывает толщину мембраны. Модель В: неясно. Результат трудно интерпретировать в рамках данной модели, поскольку она утверждает, что мембрана должна иметь такую же толщину, как «голый» двойной слой (или быть чуть толще из-за выступающих концов встроенных белков). Данные согласуются с моделью только при самых малых из возможных значений толщины мембраны или только если из двойного слоя выступают большие участки белков, в) Модель А: неясно. Результаты трудно интерпретировать в рамках модели. Если белки связаны с мембраной ионными взаимодействиями, в соответствии с моделью белки должны содержать много заряженных аминокислот, но мы видим обратное. Кроме того, поскольку слой белка должен быть очень тонким (см. (б)), для гидрофобного ядра белка остается очень мало места, так что гидрофобные остатки должны выступать наружу. Модель Б: согласуется. В белках есть как гидрофобные остатки (взаимодействующие с липидами), так и заряженные остатки (взаимодействующие с водой). Модель В: согласуется. Белки содержат как гидрофобные остатки (связанные с мембраной), так и заряженные остатки (взаимодействующие с водой), г) Модель А: неясно. Результаты трудно интерпретировать в рамках модели, поскольку предсказанное ею значение соотношения площадей составляет точно 2,0, что довольно трудно себе представить при физиологическом давлении. Модель Б: ничего нельзя сказать, нет прогноза о количестве липидов в мембране. Модель В: согласуется. Некоторые участки поверхности мембраны заняты белками, так что соотношение площадей составляет меньше 2,0, что и наблюдается в физиологических условиях. д) Модель А: неясно. В соответствии с данной моделью белки имеют скорее вытянутую, чем глобулярную форму, так что модель согласуется с реальностью только при предположении, что находящиеся на поверхности белки содержат спиральные фрагменты. Модель Б: согласуется. В рамках модели белки имеют глобулярную структуру (содержащую несколько спиральных участков). Модель В: согласуется. В рамках модели белки имеют в основном глобулярную структуру. е) Модель А: неясно. Фосфатные головки защищены слоем белка, но от действия фосфолипазы фосфолипиды защищены лишь в том случае, если белки полностью покрывают поверхность. Модель Б: согласуется. Большинство полярных головок доступно для действия фосфолипазы. Модель В: согласуется. Все полярные головки доступны для действия фосфолипазы. ж) Модель А: не согласуется. Белки полностью доступны для расщепления трипсином и практически все расщепляются во многих местах, включая гидрофобные участки. Модель Б: не согласуется. Практически все белки находятся внутри двойного слоя и недоступны для действия трипсина. Модель В: согласуется. Участки белков, пронизывающие двойной слой или погруженные в него, защищены от действия трипсина, а те, что оказываются на поверхности, подвергаются расщеплению. Устойчивые к действию трипсина участки отличаются высоким содержанием гидрофобных остатков.
Глава 12
1. Вещество X — это сАМР; его синтез активируется адреналином, а) При центрифугировании происходит осаждение аденилатциклазы, катализирующей образование сАМР. б) Добавление сАМР стимулирует гликогенфосфорилазу. в) сАМР устойчив при нагревании, и его можно получить путем обработки АТР гидроксидом бария.
2. В отличие от сАМР дибутирил-сАМР легко проникает через плазматическую мембрану.
3. а) Повышает концентрацию сАМР; б) сАМР регулирует транспорт Na+; в) требуется постоянно восполнять водный и электролитный баланс в организме.
4. а) В результате мутации R-субъединица теряет способность связывать С-субъединицу, так что С-субъединица остается постоянно активной; б) мутация нарушает связывание сАМР с R-субъединицей, так что С-субъединица ингибируется связанной R-субъединицей.
5. Альбутерол повышает концентрацию сАМР, что приводит к релаксации и расширению бронхов и бронхиол. Поскольку β-адренергические рецепторы контролируют и многие другие процессы, лекарство вызывает ряд нежелательных побочных эффектов. Для их минимизации нужен специфический агонист подтипа β-адренергических рецепторов, содержащихся в гладких мышцах бронхов.
6. Разрушение гормона, гидролиз GTP, связанного с G-белком, расщепление, метаболизм или удаление вторичного посредника, десенсибилизация рецептора, удаление рецептора от поверхности клетки.
7. Получить слитые белки, состоящие из CFP и β-аррестина, YFP и цитоплазматического домена β-адренергического рецептора (или наоборот). Слитые белки облучить светом с длиной волны 433 нм и измерить пропускание при 476 и 527 нм. Если взаимодействие происходит, то при добавлении к клеткам, экспрессирующим слитый белок, адреналина должно наблюдаться увеличение пропускания при 527 нм и уменьшение пропускания при 476 нм. Если взаимодействия нет, проходит только свет с длиной волны 476 нм. Причин этого может быть несколько: (1) слитые белки неактивны или не могут взаимодействовать; (2) они не попадают к месту своей обычной локализации; (3) они подвергаются протеолитическому расщеплению.
8. Вазопрессин повышает концентрацию Са2+ до 10-6 М, активируя протеинкиназу С. Инъекции ЭГТА блокируют действие вазопрессина, но не влияют на реакцию на глюкагон, который использует в качестве вторичного посредника сАМР, а не Са2+.
9. Амплификация сигнала является результатом ферментативного каскада, когда один фермент активирует молекулы другого фермента и т. д., например, каскада с участием рецептора инсулина, IRS-1, Raf, MEK, ERK; ERK активирует транскрипционный фактор, который стимулирует синтез мРНК.
10. Мутация гена ras, имеющая следствием инактивацию GТРазной активности Ras, приводит к образованию белка, который после активации путем связывания GTP продолжает (через Raf) передавать сигнал инсулина.
11. Общие свойства Ras и Gs: оба связывают либо GDP, либо GTP; оба активируются GTP; оба, будучи активированными, активируют следующие ферменты каскада; оба обладают собственной GТРазной активностью, которая отключает их через короткий период времени. Различия между Ras и Gs: Ras - маленький мономерный белок, Gs - гетеротример. Функциональное различие между Gs и Gi заключается в том, что Gs активирует аденилатциклазу, a Gi ее ингибирует.
12. Типы протеинкиназ и факторы их активации (в скобках): РКА (cAMP), PKG (cGMP), РКС (Са2+, ДАГ), Са2+/СаМ-киназа (Са2+, СаМ), циклин-зависимая киназа (циклин), тирозинкиназа (лиганд рецептора, например, инсулин), МАРК (Raf), Raf (Ras), киназа гликогенфосфорилазы (РКА).
13. При связывании негидролизуемого аналога GTP Gs остается в активированной форме; таким образом, аналог продлевает действие адреналина.
14. а) Используйте шарики со связанным α-бунгаро- токсином для очистки ацетилхолинового рецептора (см. рис. 3-17, с. 134). Экстрагируйте белки из электрического органа ската и пропустите смесь через хроматографическую колонку; рецептор ацетилхолина связывается с носителем селективным образом. Смойте белок раствором, ослабляющим взаимодействие с α-бунгаротоксином. б) Используйте связывание [125I]α-бунгаро- токсина для количественного определения ацетилхолинового рецептора при разных методах очистки. На каждой стадии очистки определяйте содержание ацетилхолинового рецептора, измеряя связывание [125I]α-бунгаротоксина с белками в образце. Оптимизируйте очистку, чтобы добиться максимальной удельной активности рецептора (имп./мин связанного [125I]α-бунгаротоксина на мг белка) в конечном образце.
15. а) Нет, не могли. Если бы мембранный потенциал Vm определял проницаемость мембраны по ионам К, то по уравнению Нернста Vm = -90 мВ, а не -95 мВ, так что мембранный потенциал завит от проводимости других ионов, б) Возможно, определяющее влияние на Vm оказывает транспорт ионов хлора; ЕCI = -94 мВ.
16. а) Vm мембраны ооцита изменяется от -60 до -10 мВ, т. е. происходит деполяризация мембраны, б) Влияние КСl зависит от притока ионов Са2+ из внеклеточной среды.
17. Гиперполяризация приводит к закрытию потенциалзависимых Са2+-каналов в пресинаптическом отделе палочек сетчатки. Происходящее в результате этого снижение концентрации Са2+ приводит к ослаблению ингибирующего нейромедиатора, что снижает активность следующего нейрона. Когда в ответ на световой стимул это ингибирование снимается, сигнальный путь активируется, и происходит возбуждение зрительных центров в головном мозге.
18. а) В этой ситуации нарушается приток ионов Na+ и Са2+ в клетки в ответ на световой сигнал; колбочки теряют способность передавать в мозг сигнал о том, что до них дошел свет. Палочки сохраняют свою функцию, поэтому человек с такой мутацией сохраняет зрение, но теряет способность различать цвета, б) В этом случае останавливается отток из клеток ионов К+, что приводит к деполяризации мембраны β-клеток и конститутивному высвобождению инсулина в кровь, в) АТР отвечает за закрытие этого канала, так что канал остается открытым, а это мешает деполяризации мембраны β-клеток и высвобождению инсулина.
19. При болезни Огучи может быть повреждена родопсинкиназа или аррестин.
20. Мембранный потенциал палочек больше не изменяется в ответ на световой сигнал. Такой эксперимент был проделан. Освещение активировало фосфодиэстеразу, но фермент мало снижал уровень 8-Br-cGMP, который был намного выше, чем требуется для открытия ионных каналов. Поэтому свет не вызывал изменения мембранного потенциала.
21. а) При нагревании каналы TRPV1 открываются, что вызывает приток Na+ и Са2+ в чувствительный нейрон. Это приводит к деполяризации мембраны и запускает потенциал действия. Когда потенциал действия достигает окончания аксона, происходит высвобождение нейромедиатора, сигнализирующего нервной системе о восприятии тепла, б) Капсаицин имитирует действие тепла, открывая каналы TRPV1 при низкой температуре, что вызывает ложное ощущение тепла. Чрезвычайно низкое значение ЕС50 говорит о том, что капсаицин оказывает сильнейшее действие даже в очень малом количестве, в) В низкой концентрации ментол должен открывать каналы TRPM8, что вызывает ощущение холода; в более высокой концентрации он открывает каналы и TRPM8, и TRPV3, что вызывает смешанное ощущение холода и тепла, которое знакомо тем, кто ел мятные конфеты с очень концентрированным вкусом.
22. а) Эти мутации могут привести к перманентной активации рецептора PGE2, что нарушает регуляцию клеточного цикла и образованию опухоли, б) Вирусные гены могут кодировать конститутивно активную форму рецептора, заставляя клетку постоянно делиться, что вызывает образование опухоли, в) Белок Е1А может связываться с pRb и препятствовать связыванию E2F, так что E2F остается в активном состоянии, что способствует неконтролируемому делению клетки, г) Обычно клетки легкого не реагируют на PGE2, поскольку они не экспрессируют соответствующих рецепторов; мутации, вызывающие конститутивную активацию рецептора PGE2, не затрагивают легочную ткань.
23. В норме ген опухолевого супрессора кодирует белок, ограничивающий клеточное деление. Мутантная форма белка не подавляет деление клеток, но, если одна из двух аллелей кодирует нормальный белок, сохраняется нормальная функция белка. Онкоген в норме кодирует регуляторный белок, который запускает клеточное деление, но только в присутствии правильного сигнала (фактора роста). Продукт мутантного гена непрерывно заставляет клетку делиться вне зависимости от присутствия фактора роста.
24. У ребенка с множественными опухолями в обоих глазах с самого рождения все клетки сетчатки содержат дефектную копию гена Rb. Когда-то в раннем возрасте в нескольких клетках независимым образом происходят дополнительные мутации, повреждающие нормальную копию гена Rb, что вызывает развитие опухоли. У ребенка с единственной опухолью при рождении обе копии гена Rb нормальные; мутации обеих аллелей Rb в одной и той же клетке (что происходит очень редко) вызывают появление единичной опухоли.
25. Клетки, на поверхности которых экспрессируется один и тот же рецептор, могут иметь разный набор белковых мишеней для фосфорилирования.
26. а) Клеточная модель, предсказывающая существование разных рецепторов на клетках разного типа, б) Эксперимент подтверждает независимость разных вкусовых ощущений. Даже если у животного нет рецепторов сладкого и/или рецепторов умами, другие вкусовые ощущения сохраняются в норме; таким образом, приятные и неприятные ощущения взаимо независимы, в) Да. Потеря субъединицы T1R1 или T1R3 лишает возможности воспринимать вкус умами, г) Обе модели. В соответствии с любой из моделей удаление одного рецептора влечет потерю соответствующего вкусового ощущения, д) Да. Потеря субъединицы T1R2 или T1R3 приводит почти к полному исчезновению ощущения сладости; для полного исчезновения этого ощущения требуется удаление обеих субъединиц, е) При очень высокой концентрации сахарозы сладкий вкус могут детектировать гомодимерные рецепторы T1R2 и в меньшей степени T1R3. ж) Результаты согласуются с обеими моделями. Связывание лиганда может быть отделено от вкусового ощущения. Если рецептор сладкого связывает любую другую молекулу, мышь воспринимает ее как сладкое вещество.
Глава 13
1. В данном случае система представлена развивающимся цыпленком; питательные вещества, оболочка яйца и внешний мир - окружающая среда. С одной стороны, превращение единственной клетки в цыпленка сопровождается чрезвычайно сильным снижением энтропии системы. С другой стороны, в начальный момент времени части яйца вне зародыша (окружающая среда) содержат сложные молекулы (состояние с низким уровнем энтропии). В процессе инкубации некоторые из этих сложных молекул превращаются в простые молекулы СO2 и Н2O (энтропия повышается). Это повышение энтропии в окружающей среде больше, чем снижение энтропии в процессе развития зародыша (в системе).
2. а) -4,8 кДж/моль; б) 7,56 кДж/моль; в) -13,7 кДж/моль.
3. а) 262; б) 608; в) 0,30.
4. К'eq = 21; ∆G°′ = -7,6 кДж/моль.
5. -31 кДж/моль.
6. а) -1,68 кДж/моль; б) -4,4 кДж/моль; в) При заданной температуре ∆G°′ любой реакции имеет фиксированное значение, определенное в стандартных условиях (в данном случае при концентрации фруктозо-6-фосфата и глюкозо-6-фосфата 1 М). Напротив, ∆G - величина вариабельная, которая рассчитывается заново при каждом изменении концентраций реагирующих веществ и продуктов реакции.
7. ∆G'° ~ 0; K'eq ~ 1.
8. Меньше. Суммарный процесс гидролиза АТР можно аппроксимировать следующим уравнением:
ATP4+ + Н2O —> ADP3 + НРO42- + Н+
Надо понимать, что частицы, несущие заряд, доминируют, но могут присутствовать и другие формы. При стандартных условиях ([ATP] = [ADP] = [Рi] = 1 М) концентрация воды составляет 55 М и не изменяется в ходе реакции. Поскольку в этой реакции образуются ионы Н+, при более высокой концентрации [Н+] (pH 5,0) равновесие сдвигается влево и выделяется меньше свободной энергии.
9. 10.
10.
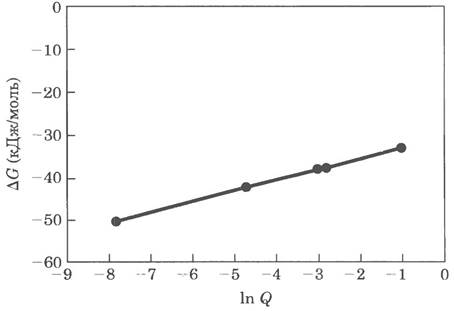
При низком соотношении [ATP]/[ADP] (<<1) ∆G гидролиза АТР уменьшается. При данной концентрации АТР доступное для клетки количество энергии понижается при уменьшении отношения [ATP]/[ADP] и повышается при его увеличении.
11. а)3 ,85 • 10-3 М; концентрация глюкозо-6-фосфата составляет 8,9 • 10-8 М; неприемлема, б) 14М: поскольку максимальная растворимость глюкозы менее 1 М, эта стадия не имеет смысла, в) 837 (∆G° = -16,7 кДж/моль); концентрация глюкозы составляет 1,2 • 10-7 М; да. г) Неразумен. Для этого требуется столь высокая концентрация Рi, при которой фосфаты двухвалентных катионов выпадают в осадок, д) Прямой перенос фосфорильной группы от АТР на глюкозу использует потенциал переноса фосфорильной группы АТР и не сопровождается образованием высокой концентрации промежуточных соединений. Ключевым моментом этого процесса является ферментативный катализ.
12. а) -12,5 кДж/моль: б) -14,6 кДж/моль.
13. а) 3 • 10-4; б) 68,7; в) 7,4 • 104.
14. -13 кДж/моль.
15. 46,7 кДж/моль.
16. В результате изомеризации карбонильная группа перемещается от атома С1 к атому С2, обеспечивая расщепление связи между атомами С3 и С4. Если бы не происходило изомеризации, расщеплялась бы связь между атомами С2 и С3, что приводило бы к образованию одной молекулы из двух атомов углерода и одной молекулы из четырех атомов углерода.
17. Механизм аналогичен механизму реакции, катализируемой алкогольдегидрогеназой (рис. 14-13, т. 2).
18. Первая стадия реакция, обратная альдольной конденсации (рис. 14-5, т. 2), вторая стадия - реакция альдольной конденсации (рис. 13-4, т. 2).
19. а) 46 кДж/моль; б) 46 кг; 68%: в) АТР синтезируется по мере необходимости, а потом распадается на ADP и Рi, так что в организме его концентрация поддерживается на стационарном уровне.
20. Концентрация АТР находится в динамическом стационарном состоянии; она остается постоянной, поскольку скорость потребления АТР равна скорости его синтеза. При гидролизе АТР отщепляется концевая (у) фосфорильная группа; при синтезе АТР из ADP происходит замена этой группы. Таким образом, концевая фосфорильная группа находится в быстром обороте. Напротив, оборот центральной (β) фосфорильной группы довольно медленный.
21. а) 1,7 кДж/моль; б) неорганическая пирофосфатаза катализирует гидролиз пирофосфата и направляет всю реакцию в целом в сторону образования ацетил-СоА.
22. 36 кДж/моль.
23. a) NAD+/NADH; б) пируват/лактат; в) образование лактата; г) -26,1 кДж/моль; д) 3,63 • 104.
24. а) 1,14 В; б) -220 кДж/моль; в) ~4.
25. а) -0,35 В; б) -0,320 В; в) -0,29 В.
26. В порядке усиления тенденции: (а), (г), (б), (в).
27. (в) и (г).
28. а) Состояние с наименьшей энергией и максимальной энтропией достигается при равенстве концентраций краски в двух клетках. Если межклеточный контакт типа «ловушки для рыбы» позволяет осуществлять однонаправленный транспорт, в конечном итоге в олигодендроците окажется больше краски, чем в астроците. Это состояние отличается от исходного состояния более высокой энергией и более низкой энтропией, что противоречит второму началу термодинамики, т. е. модель предполагает самопроизвольное уменьшение энтропии, что невозможно. В энергетических терминах модель предусматривает самопроизвольный переход системы из состояния с низкой энергией в состояние с высокой энергией без поступления энергии извне, что опять-таки невозможно, б) Молекулы, в отличие от рыб, не проявляют поведенческих реакций, а находятся в случайном броуновском движении. Диффузия приводит к суммарному перемещению молекул из области с более высокой концентрацией в область с более низкой концентрацией по той простой причине, что при большей численности молекул (область с высокой концентрацией) вероятность того, что какая-нибудь из них подойдет к соединительному каналу, выше. Рассмотрим процесс с лимитирующей стадией, когда молекулы входят в узкий канал. Узкий конец канала ограничивает скорость молекул, поскольку при любом случайном движении молекул вероятность их попадания туда низкая. Широкий конец канала — это не воронка для молекул (как это может быть для рыб), поскольку молекулы не «сдавливаются» стенками сужающегося канала, как рыбы в ловушке. Узкий конец ограничивает скорость перемещения одинаково в обоих направлениях. При одинаковой концентрации с обеих сторон выравнивается и скорость перемещения в обоих направлениях, и концентрация растворенного вещества остается постоянной, в) Поведение рыб не является случайным - оно зависит от внешних условий. Рыбы, попавшие в широкий раструб канала, продолжают двигаться вперед по той причине, что они вообще предпочитают двигаться вперед, и по мере сужения канала они начинают подвергаться «сдавливанию». Им легко войти в широкий раструб, но выйти из ловушки гораздо труднее, поскольку трудно пройти узкий выход, г) Возможных объяснений может быть несколько, и некоторые из них были предложены критиками данной статьи. Вот два возможных объяснения. (1) В олигодендроците краситель может связываться с другими молекулами. Связывание приводит к тому, что молекулы красителя перестают быть частью «свободного» раствора, но продолжают быть видны в флуоресцентный микроскоп. (2) Краситель может накапливаться в определенном компартменте (органелле) олигодендроцита либо за счет активного транспорта с затратой АТР, либо за счет взаимодействия с другими молекулами в этой органелле.
Глава 14
1. Суммарное уравнение:
Глюкоза + 2АТР —> 2 глицеральдегид-3-фосфат + 2ADP + 2Н+;
∆G'° = 2,1 кДж/моль
2. Суммарное уравнение:
2 Глицеральдегид-3-фосфат + 4ADP + 2Рi —> 2 лактат + 2NAD+;
∆G'° = -114 кДж/моль
3. GLUT2 (и GLUT1) содержится в печени и всегда локализован в плазматической мембране гепатоцитов. GLUT3 всегда присутствует в плазматической мембране некоторых клеток головного мозга. В норме GLUT4 заключен в везикулы клеток мышц и жировой ткани и проникает в плазматическую мембрану только по сигналу инсулина. Таким образом, печень и головной мозг могут потреблять глюкозу из крови вне зависимости от выработки инсулина, тогда как мышцы и жировая ткань потребляют глюкозу только при повышении уровня инсулина, вызванного повышением уровня глюкозы крови.
4. CH3CHO + NADH + Н+ <-> CH3CH2OH + NAD+;
К′eq = 1,45 • 104.
5. -8,6 кДж/моль.
6. а) 14СН3СН2ОН; б) [3-14С] глюкоза или [4-14С] глюкоза.
7. В ходе ферментации выделяется энергия, некоторое количество которой запасается в форме АТР, но значительная часть рассеивается в виде тепла. Если ферментер не охлаждать, микроорганизмы могут погибнуть от перегрева.
8. В соевых бобах и в зернах пшеницы содержится крахмал — полимер глюкозы. Микроорганизмы расщепляют крахмал до глюкозы, превращают глюкозу в пируват и, поскольку процесс идет в бескислородной среде (это ферментация), далее превращают пируват в молочную кислоту и этиловый спирт. В присутствии O2 пируват окислялся бы до ацетил-СоА, а затем до СO2 и Н2O. Однако в присутствии кислорода некоторое количество ацетил- СоА также превращалось бы в уксусную кислоту (уксус).
9. С1. Эксперимент демонстрирует обратимость альдолазной реакции. С1 в глицеральдегид-3-фосфате эквивалентен С4 в фруктозо-1,6-бисфосфате (см. рис. 14-6, т. 2). Исходный глицеральдегид- 3-фосфат содержал меченый атом С1. Атом С3 в дигидроксиацетонфосфате становится меченым в реакции, катализируемой триозофосфатизомеразой, в результате образуется меченный по атому С3 фруктозо-1,6-бисфосфат.
10. Не принесет. Анаэробный синтез АТР не происходил бы, а аэробный синтез АТР ослаб бы незначительно.
11. Нет, не смогли бы. Лактатдегидрогеназа необходима для рецикла NAD+ из NADH, образовавшегося в ходе окисления глицеральдегид-3-фосфата.
12. Превращение глюкозы в лактат происходит в миоцитах при недостатке кислорода и в этих условиях обеспечивает образование ATP. Поскольку лактат может окисляться до пирувата, глюкоза расходуется не напрасно. При достаточном количестве кислорода пируват окисляется в аэробных реакциях. Такая гибкость метаболизма позволяет организму лучше приспосабливаться к изменяющимся условиям внешней среды.
13. Клетка быстро удаляет 1,3-бисфосфоглицерат на следующей благоприятной стадии процесса, катализируемой фосфоглицераткииазой.
14. а) Продукт — 3-фосфоглицерат. б) В присутствии арсената в анаэробных условиях суммарный выход АТР равен нулю.
15. а) При спиртовом брожении расходуется 2 моль Pi на 1 моль глюкозы, б) Этанол — это восстановленный продукт, образующийся в процессе обратного окисления NADH до NAD+, а СO2 — побочный продукт превращения пирувата в этанол. Пируват должен превращаться в этанол, чтобы обеспечивать непрерывный источник NAD+ для окисления глицеральдегид-3-фосфата. Накапливается фруктозо-1,6-бисфосфат, образующийся в качестве промежуточного продукта гликолиза, в) Арсенат вытесняет Pi в реакции глицеральдегид- 3-фосфатдегидрогеназы, в результате чего образуется ациларсенат, подвергающийся далее спонтанному гидролизу. Это препятствует образованию АТР, но метаболизм 3-фосфоглицерата продолжается.
16. Ниацин из пищи используется для синтеза NAD+. Осуществляемые под действием NAD+ окислительные реакции являются частью циклического процесса, в которых NAD+ выступает в роли переносчика электронов (восстановительного агента). Одна молекула NAD+ может окислить несколько тысяч молекул глюкозы, поэтому потребность в витамине-предшественнике (ниацине) сравнительно невысокая.
17. Дигидроксиацетонфосфат + NADH + Н+ —> 3-глицерофосфат + NAD+ (катализатор — дегидрогеназа).
18. Недостаточность галактокиназы: галактоза (менее токсична); недостаточность галактозо-1 -фосфат-уридилилтрансферазы: галактозо-1-фосфат (более токсичен).
19. Белки расщепляются до аминокислот, которые используются в глюконеогенезе.
20. а) В реакции пируваткарбоксилазы к пирувату присоединяется 14СO2, но на следующей стадии ФЕП-карбоксикиназа перемещает тот же СO2. Таким образом, сначала 14С в глюкозу не включается.
б)
21. Четыре эквивалента АТР на молекулу глюкозы.
22. Если бы это было так, глюконеогенез был бы очень высокоэндергоническим процессом и исчезла возможность независимой регуляции гликолиза и глюконеогенеза.
23. Для превращения пирувата в фосфоенолпируват клетка затрачивает 1 молекулу АТР и 1 молекулу GTP.
24. (а), (б) и (г) — глюкогенные, (в) и (д) — нет.
25. Потребление алкоголя усиливает конкуренцию за NAD+ при метаболизме этанола и глюконеогенезе. Ситуация усугубляется активной физической нагрузкой и отсутствием достаточного питания, поскольку они также способствуют понижению уровня глюкозы крови.
26. а) Быстрое усиление гликолиза; повышение уровня пирувата и NADH приводит к повышению уровня лактата, б) Лактат превращается в глюкозу через стадию образования пирувата. Это медленный процесс, поскольку скорость образования пирувата ограничена доступностью NAD+, равновесие ЛДГ-реакции сдвинуто в сторону образования лактата, а превращение пирувата в глюкозу требует энергетических затрат, в) Равновесие реакции, катализируемой ЛДГ, сдвинуто в сторону образования лактата.
27. В печени лактат превращается в глюкозу в результате глюконеогенеза (рис. 14-15 и 14-16, т. 2). Дефект фруктозо-1,6-бисфосфатазы в гепатоцитах препятствует включению лактата в глюконеогенез, в результате чего лактат накапливается в крови.
28. Сукцинат превращается в оксалоацетат, который транспортируется в цитозоль и превращается в фосфоенолпируват под действием ФЕП- карбоксикиназы. В соответствии с реакцией, изображенной на рис. 14-16 (т. 2), для образования 1 моль глюкозы требуется 2 моль ФЕП.
29. Одновременное функционирование анаболических и катаболических путей метаболизма глюкозы приводит к холостому циклу АТР, сопровождающемуся дополнительным потреблением O2.
30. Накопление рибозо-5-фосфата, как минимум, приводило бы к обращению направления реакции в соответствии с законом действующих масс (уравнение 13-4, т. 2). Кроме того, это могло бы повлиять и на другие метаболические реакции с участием рибозо-5-фосфата в качестве субстрата или продукта, например, на реакции синтеза нуклеотидов.
31. а) Устойчивость к этанолу, скорее всего, связана еще со многими другими генами, поэтому такой путь был бы значительно более сложным, б) L-Арабинозоизомераза (ген аraA) превращает альдозу в кетозу путем перемещения карбонильной группы в нефосфорилированном сахаре от атома С1 на атом С2. Подобные ферменты в данной главе не упоминались; все обсуждавшиеся ранее ферменты действуют на фосфорилированные сахара. Фермент, осуществляющий аналогичные превращения фосфорилированного фермента, называется фосфогексозоизомеразой. L-Рибулокиназа (аrаВ) фосфорилирует сахар по атому С5, перенося y-фосфорильную группу от АТР. В данной главе описано несколько подобных реакций, включая реакцию гексокиназы. L-Рибулозо-5-фосфат-эпимераза (araD) перемещает Н- и ОН-группы у хирального атома сахара. В данной главе аналогичные реакции не были описаны, но будут обсуждаться в гл. 20 (см. рис. 20-1, т. 2). в) Продукты трех генов аrа превращали арабинозу в ксилулозо-5-фосфат в соответствии со следующей последовательностью реакций:арабиноза(L-арабинозоизомераза) —> L-рибулоза (L-рибулокиназа) —> L-рибулозо-5-фосфат (эпимераза) —> ксилулозо-5-фосфат. г) Арабиноза превращается в ксилулозо-5-фосфат, как описано в (в), который включается в метаболический путь, изображенный на рис. 14-22; образующийся глюкозо-6-фосфат далее ферментируется до СO2 и этилового спирта, д) 6 молекул арабинозы + 6 молекул АТР превращаются в 6 молекул ксилулозо-5-фосфата, который включается в путь, изображенный на рис. 14-22 (т. 2), и превращается в 5 молекул глюкозо-6-фосфата, каждая из которых подвергается ферментации с образованием 3 молекул АТР — всего 15 молекул АТР. Таким образом, суммарный выход составляет 15 АТР - 6 АТР = 9 АТР из 6 молекул арабинозы. Кроме того, в результате процесса образуются 10 молекул этанола и 10 молекул СO2. е) С учетом более низкого выхода АТР, для такого же роста в пересчете на эквиваленты АТР бактерия Z. mobils должна ферментировать больше арабинозы и, следовательно, производить больше спирта, ж) Один из способов, который заставил бы бактерию утилизировать ксилозу, заключается во введении двух дополнительных генов: аналога гена araD, продукт которого превращает ксилозу в рибозу, переставляя Н- и ОН-группы у атома С3, и аналога гена аrаВ, продукт которого фосфорилирует рибозу по атому С5. Образующийся рибозо-5-фосфат может включаться в существующий метаболический путь.
Глава 15
1. а) 0,0293; б) 308; в) Нет. Q » К'eq, и это означает, что в клетках реакция PFK-1 далека от равновесия. Эта реакция протекает медленнее, чем следующие реакции гликолиза. Поток метаболитов по пути гликолиза в значительной степени определяется активностью PFK-1.
2. а) 1,4 • 10-9 М; б) Физиологическая концентрация (0,023 мМ) в 16 000 раз выше равновесной концентрации. Данная реакция в клетках не достигает равновесия. Многие реакции в клетках далеки от равновесия.
3. Когда нет кислорода, потребности в АТР удовлетворяются путем анаэробного метаболизма глюкозы (ферментации до лактата). Поскольку при аэробном окислении глюкозы образуется намного больше АТР, чем при брожении, для образования того же количества АТР требуется меньше глюкозы.
4. a) Фермент имеет два центра связывания АТР — активный и регуляторный. Связывание АТР в регуляторном центре ингибирует PFK-1, снижая Vmax или повышая Км для связывания АТР в активном центре, б) В условиях избытка АТР ноток метаболитов по пути гликолиза замедляется, в) График показывает, что повышение концентрации ADP подавляет ингибирование под действием АТР. Поскольку пул адениновых нуклеотидов почти постоянен, потребление АТР вызывает повышение концентрации ADP. Данные показывают, что активность PFK-1 может регулироваться соотношением [ATP]/[ADP].
5. При pH 7,0 фосфатная группа глюкозо-6-фосфата полностью ионизирована, в результате чего молекула в целом приобретает отрицательный заряд. Поскольку мембраны обычно непроницаемы для заряженных молекул, глюкозо-6-фосфат не может проходить из крови в клетки и, следовательно, не может включаться в гликолиз и использоваться для синтеза АТР. (По этой же причине фосфорилированная глюкоза не может выйти из клетки.)
6. а) В мышцах: распад гликогена в процессе гликолиза поставляет клеткам энергию (в форме АТР). Гликогенфосфорилаза катализирует превращение запасенного гликогена в глюкозо-1-фосфат, который превращается в промежуточный продукт гликолиза глюкозо-6-фосфат. При активной физической нагрузке скелетным мышцам требуется больше глюкозо-6-фосфата. В печени: распад гликогена поддерживает постоянный уровень глюкозы крови между приемами пищи (глюкозо- 6-фосфат превращается в свободную глюкозу), б) В активно работающих мышцах потребность в АТР очень высока, так что глюкозо-1-фосфат должен образовываться быстро, чем и объясняется большое значение Vmax.
7. a) [Pi]/[глюкозо- 1-фосфат] = 3,3/1; б) и в) Величина этого отношения в клетке (> 100 : 1) указывает, что концентрация глюкозо-1-фосфата намного ниже равновесного значения. Скорость удаления глюкозо-1-фосфата (путем включения в гликолиз) выше скорости его образования (в реакции гликогенфоефорилазы), так что поток метаболитов направлен от гликогена к образованию глюкозо-1- фосфата. Реакция гликогенфосфорилазы, вероятно, является регуляторной стадией в процессе расщепления гликогена.
8. а) Повысится; б) понизится; в) повысится
9. В покое: [АТР] — высокая; [АМР] — низкая; [ацетил-СоА] и [цитрат] — промежуточная. При бегстве: [АТР] — промежуточная; [АМР] — высокая; [ацетил-СоА] и [цитрат] — низкая. Во время спринта при анаэробном гликолизе поток глюкозы усиливается по следующим причинам: (1) ингибирование гликогенфосфорилазы и PFK-1 под действием АТР частично снимается; (2) АМР стимулирует оба фермента; (3) при снижении концентрации цитрата и ацетил-СоА ослабляется их ингибирующее действие по отношению к PFK-1 и пируваткиназе соответственно.
10. Перелетные птицы эффективно используют анаэробное окисление жиров (в отличие от бегущего кролика, использующего анаэробный метаболизм глюкозы). Птицы берегут мышечный гликоген для экстренных случаев, когда внезапно может потребоваться значительный расход энергии.
11. Случай 1: е, 3; случай 2: в, 3; случай 3: 3,4; случай 4: г, 6.
12. а) (1) Жировая ткань: синтез жирных кислот замедляется. (2) Мышцы: гликолиз, синтез жирных кислот и синтез гликогена замедляются. (3) Печень: гликолиз ускоряется, глюконеогенез, синтез гликогена и синтез жирных кислот замедляются; пентозофосфатный цикл происходит без изменений. б) (1) Жировая ткань и (3) печень: синтез жирных кислот замедляется, поскольку недостаток инсулина приводит к инактивации ацетил- СоА-карбоксилазы, первого фермента на пути синтеза жирных кислот. Синтез гликогена ингибируется сАМР-зависимым фосфорилированием гликогенсинтазы. (2) Мышцы: гликолиз замедляется, поскольку GLUT4 неактивен, что делает невозможным захват глюкозы. (3) Печень: гликолиз замедляется, поскольку бифункциональная PFK-2/FBPaза-2 переходит в форму с активной РВРазой-2, в результате чего снижается концентрация фруктозо-2,6-бисфосфата — аллостерического активатора фосфофруктокиназы и ингибитора FBPaзы-l. Это также вносит вклад в стимуляцию глюконеогенеза.
13. а) Повышенный; б) повышенный; в) повышенный.
14. а) РКА не может активироваться в ответ на сигнал глюкагона или адреналина, и гликогенфосфорилаза остается неактивной, б) РР1 остается активной и дефосфорилирует гликогенсинтазу (тем самым активируя ее) и гликогенфосфорилазу (тем самым ингибируя ее), в) Фосфорилаза остается фосфорилировнной (активной), усиливая расщепление гликогена, г) Глюконеогенез не стимулируется при низком уровне глюкозы крови, так что при голодании уровень глюкозы крови падает до опасно низкой величины.
15. Падение концентрации глюкозы в крови вызывает высвобождение глюкагона поджелудочной железой. В печени глюкагон активирует гликогенфос- форилазу через стимуляцию ее сАМР-зависимого фосфорилирования и стимулирует глюконеогенез путем снижения концентрации фруктозо-2,6- бисфосфата, таким образом стимулируя FВРазу-1.
16. а) Снижение способности мобилизовать гликоген; снижение уровня глюкозы крови между приемами пищи, б) Снижение способности организма понижать уровень глюкозы крови после употребления в пищу углеводов; повышение уровня глюкозы крови, в) Снижение концентрации фруктозо-2,6- бисфосфата в печени, стимуляция гликолиза и ингибирование глюконеогенеза. г) Снижение концентрации фруктозо-2,6-бисфосфата, стимуляция глюконеогенеза и ингибирование гликолиза, д) Усиление захвата жирных кислот и глюкозы и усиленное окисление этих веществ, е) Активизация превращения пирувата в ацетил-СоА и ускорение синтеза жирных кислот.
17. а) Учитывая, что каждая частица гликогена содержит около 55 000 остатков глюкозы, эквивалентная концентрация глюкозы составляет
55 000 • 0,01 мкМ = 550 мМ (0,55 М).
При такой концентрации растворенного вещества в клетке было бы очень высокое осмотическое давление (жидкости тела характеризуются намного более низкой осмолярностью). б) Чем меньше разветвлений, тем меньше у полимера свободных концов, доступных для действия гликогенфосфорилазы, и тем ниже скорость высвобождения глюкозы. Если полимер линейный (не имеет разветвлений), фосфорилаза может действовать всего лишь в одном положении, в) На внешней поверхности частицы так много остатков глюкозы, что ферменту трудно подойти к расщепляемой связи, г) В каждом следующем ряду число цепей удваивается: ряд 1 содержит одну цепь (2° = 1), ряд 2 — две (21 = 2), ряд 3 — четыре (22 = 4) и т. д. Таким образом, в случае ряда Ь число цепей СА в самом верхнем ряду 2t-1. д) Общее число цепей 20 + 21 + 22 + ...2t-1 = 2t - 1. Каждая цепь содержит gc звеньев глюкозы, так что общее число Ст звеньев глюкозы gc(2t - 1). е) Из цени длиной gc гликогенфосфорилаза может высвободить все остатки глюкозы, кроме четырех. Таким образом, из каждой цени верхнего ряда фермент может высвободить (gc - 4) остатков глюкозы. Поскольку в верхнем ряду имеется 2t-1 цепей, число молекул глюкозы GРТ, которые может высвободить фермент, (gc- 4)2t-1. ж) Объем сферы равен 4/3ωr3, где r - это толщина одного ряда, умноженная на число рядов, т. е. (0,12gс + 0,35)t нм. Таким образом, Vs = 4/3ωt3(0,12gc + 0,35)3 нм3. з) Алгебраическим путем можно показать, что значение gc, при котором достигается максимальное значение f, не зависит от t. Пусть t = 3:
gc |
CA |
GT |
GTP |
Vs |
f |
5 |
4 |
35 |
4 |
11 |
5,8 |
6 |
4 |
42 |
8 |
19 |
9,7 |
7 |
4 |
49 |
12 |
24 |
12 |
8 |
4 |
56 |
16 |
28 |
14 |
9 |
4 |
63 |
20 |
32 |
15 |
10 |
4 |
70 |
24 |
34 |
16 |
11 |
4 |
77 |
28 |
36 |
16 |
12 |
4 |
84 |
32 |
38 |
17 |
13 |
4 |
91 |
36 |
40 |
17 |
14 |
4 |
98 |
40 |
41 |
17 |
15 |
4 |
100 |
44 |
42 |
16 |
16 |
4 |
110 |
48 |
43 |
16 |
Оптимальное значение gc. (соответствующее максимуму f) равно 13. В природе значение gc варьирует от 12 до 14, что соответствует значениям f которые очень близки к оптимуму. Если выбрать другое значение t, значения будут отличаться, но оптимальным по-прежнему останется gc = 13.
Глава 16
1. а) ① Цитратсинтаза.
ацетил-СоА + оксалоацетат + Н2O —> цитрат + СоА
② Акопитаза.
цитрат —> изоцитрат
③ Изоцитратдегидрогеназа:
изоцитрат + NAD+ —> α-кетоглутарат + СO2 + NADH
④ α-Кетоглутаратдегидрогеназа:
α-кетоглутарат + NAD+ + СоА —> сукцинил-СоА + СO2 + NADH
⑤ Сукцинил-СоА-синтетаза: сукцинил-СоА + Pi + GDP —> сукцинат + СоА + GTP
⑥ Сукцинатдегидрогеназа: сукцинат + FAD —> фумарат + FADH2
⑦ Фумараза: фумарат + Н2O —> малат
⑧ Малатдегидрогеназа: малат + NAD+ —> оксалоацетат + NADH + Н+
б), в) ① СоА, конденсация; ② отсутствует, изомеризация; ③ NAD+, окислительное декарбоксилирование; ④ NAD+, СоА и тиаминпирофосфат, окислительное декарбоксилирование; ⑤ СоА, субстратное фосфорилирование; ⑥ FAD, окисление; ⑦ отсутствует, гидратация; ⑧ NAD+, окисление г) Ацетил-СоА + 3NAD+ + FAD + GDP +Pi + 2H2O —> 2CO2 + СоА + 3NADH + FADH2 + GTP + 2H+
2. Глюкоза + 4ADP + 4Рi + 10NAD4 + 2FAD —> 4АТР + 10NADH + 2FADH2 + 6СO2
3. а) Окисление; метанол —> формальдегид + [Н-Н]
б) Окисление; формальдегид —> формиат + [Н-Н]
в) Восстановление; СO2 + [Н-Н] —> формиат + Н+
г) Восстановление; глицерат + Н4 + [Н-Н] —> глицеральдегид + Н2O
д) Окисление; глицерин —> дигидроксиацетон + [Н-Н]
е) Окисление; 2Н2O + толуол —> бензоат + Н+ + 3[Н-Н]
ж) Окисление; сукцинат —> фумарат + [Н-Н]
з) Окисление; пируват + Н2O —> ацетат + СO2 + [Н-Н]
4. Из структурных формул видно, что соотношение связанного с углеродом водорода к углероду (Н/С) выше для гексановой кислоты (11/6), чем для глюкозы (7/6). Это означает, что гексановая кислота — более восстановленное соединение и ее полное окисление до СO2 и Н2O сопровождается выделением большего количества энергии.
5. а) Окислился; этанол + NAD+ —> ацетальдегид + NADH + Н+
б) Восстановился; 1,3-бисфосфоглицерат + NADH + Н+ —> глицеральдегид-3-фосфат + NAD4 + НРО42-
в) Не изменил степени окисления; пируват + Н+ —> ацетальдегид + СO2
г) Окислился; пируват + NAD+ —> ацетат + СO2 + NADH + Н+
д) Восстановился; оксалоацетат + NADH + Н+ —> малат + NAD+
е) Не изменил степени окисления; ацетоацетат + Н+ —> ацетон + СO2
6. ТРР: тиазольное кольцо присоединяется к α-углероду пирувата и стабилизирует образующийся карбанион, выступая в роли ловушки электронов. Липоевая кислота: окисляет пируват до состояния окисления ацетата (ацетил-СоА) и активирует ацетат (тиоэфир). CoA-SH: активирует ацетат (тиоэфир). FAD: окисляет липоевую кислоту. NAD+: окисляет FAD.
7. Отсутствие ТРР ингибирует пируватдегидрогеназу; накапливается пируват.
8. Окислительное декарбоксилирование; NAD4 или NADP4; α-кетоглутаратдегидрогеназа
9. Потребление кислорода является мерой активности двух первых стадий клеточного дыхания — гликолиза и цикла лимонной кислоты. Добавление оксалоацетата или малата стимулирует цикл лимонной кислоты и, следовательно, способствует дыханию. Оксалоацетат или малат выполняет каталитическую функцию, поскольку регенерируется на последующих стадиях цикла лимонной кислоты.
10. а) 5,6 • 10-6; б) 1,1 • 10-8 М; в) 28 молекул
11. Нужно добавить ADP (или GDP), Рi CoA-SH, ТРР, NAD+, но не липоевую кислоту, которая ковалентно связана с использующими ее ферментами.
12. Не могут синтезироваться флавиновые нуклеотиды FMN и FAD. Поскольку FAD участвует в цикле лимонной кислоты, недостаточность флавинов сильно ингибирует цикл.
13. Оксалоацетат может направляться на синтез аспартата или включаться в глюконеогенез. Запас оксалоацетата пополняется в анаилеротических реакциях, катализируемых ФЕП-карбоксикиназой, ФЕП-карбоксилазой, яблочным ферментом или пируваткарбоксилазой (см. рис. 16-15, т. 2).
14. Концевая фосфорильная группа GTP может быть перенесена на ADP в реакции, катализируемой нуклеозиддифосфаткиназой с константой равновесия 1,0: GTP + ADP —> GDP + АТР
15. а) ООС-СН2-СН2-СОО (сукцинат), б) Малонат — конкурентный ингибитор сукцинатдегидрогеназы. в) Остановка цикла лимонной кислоты приводит к прекращению образования NADH и переноса электронов и далее к остановке дыхания. г) Большой избыток сукцината (субстрата) позволяет преодолеть конкурентное ингибирование.
16. а) Добавить равномерно меченную [14С] глюкозу и следить за выделением 14СO2. б) Равномерно распределится между атомами С2 и С3 оксалоацетата; бесконечное число циклов.
17. Оксалоацетат находится в равновесии с сукцинатом, в котором атомы С1 и С4 эквивалентны. Оксалоацетат, полученный из сукцината, содержит метку в атомах С1 и С4, а полученный из него ФЕП содержит метку в атоме С1, откуда метка попадает в атомы С3 и С4 в молекуле глюкозы.
18. а) С1; б) С3; в) С3; г) С2 (метильная группа); д) С4; е) С4; ж) равномерно распределена между С2 и С3.
19. Тиамин нужен для синтеза ТРР, который выступает в роли простетической группы в пируватдегидрогеназном и α-кетоглутаратдегидрогеназном комплексах. Недостаточность тиамина снижает активность этих ферментных комплексов и вызывает наблюдающееся накопление метаболитов.
20. Нет. Вхождение в цикл каждых двух атомов в виде ацетата сопровождается удалением двух атомов в виде СO2; поэтому суммарного приращения количества оксалоацетата не происходит. Приток оксалоацетата достигается в анаплеротической реакции карбоксилирования пирувата.
21. Да, это приведет к ингибированию цикла лимонной кислоты. Оксалоацетат содержится в митохондриях в достаточно низкой концентрации, поэтому его удаление по пути глюконеогенеза сдвинет равновесие реакции цитратсинтазы в сторону образования оксалоацетата.
22. а) Ингибирование аконитазы; б) фторцитрат; конкурирует с цитратом; большим избытком цитрата, в) Цитрат и фторцитрат ингибируют PFK-1. г) Отключаются все катаболические процессы, необходимые для производства АТР.
23. Гликолиз:
Глюкоза + 2Pi + 2ADP + 2NAD+ —> 2 пируват + 2АТР + 2NADH + 2Н+ + 2Н2O
Реакция пируваткарбоксилазы:
2 Пируват + 2СO2 + 2АТР + 2Н2O —> 2 оксалоацетат + 2ADP + 2Pi +4Н+
Реакция малатдегидрогеназы:
2 Оксалоацетат + 2NADH + 2Н+ —> 2 L-малат + 2NAD+
Так происходит рецикл никотинамидных коферментов в анаэробных условиях. Суммарную реакцию можно записать следующим образом:
Глюкоза + 2СO2 —> 2 L-малат + 4Н+
Итак, превращение каждой молекулы глюкозы сопровождается выделением 4 ионов Н+; в результате повышается кислотность и терпкость вина.
24. Суммарная реакция:
2 пируват + ATP + 2NAD+ + Н2O —> α-кетоглутарат + СO2 + ADP + Рi +2NADH + 3Н+
25. Цикл вовлечен и в катаболические, и в анаболические процессы. Например, в результате окисления субстрата в цикле выделяется АТР, но также образуются предшественники для синтеза аминокислот (см. рис. 16-15, с. 203).
26. а) Снижает; б) повышает; в) снижает.
27. а) Цитрат образуется из оксалоацетата и ацетил- СоА под действием цитратсинтазы. Цитратсинтаза может обеспечивать суммарный прирост цитрата при следующих условиях: (1) при постоянном притоке оксалоацетата и ацетил-СоА и (2) при ограничении синтеза изоцитрата, как в среде с низким содержанием Fe3+. Ионы Fe3+ нужны для проявления активности аконитазы, поэтому в среде с низким содержанием Fe3+ ее активность низкая.
б) Сахароза + Н2O —> глюкоза + фруктоза
Глюкоза + 2Рi + 2ADP + 2NAD+ —> 2 пируват + 2АТР + 2NADH + 2Н+ + 2Н2O
Фруктоза + 2Pi + 2ADP + 2NAD+ —> 2 пируват + 2АТР + 2NADH + 2Н+ + 2Н2O
2 Пируват + 2NAD+ + 2СоА —> 2 ацетил-СоА + 2NADН + 2Н+ + 2СO2
2 Пируват + 2СO2 + 2АТР + 2Н2O —> 2 оксалоацетат + 2АDР + 2Рi +4Н+
2 Ацетил-СоА + 2 оксалоацетат + 2Н2O —> 2 цитрат + 2СоА
Суммарная реакция:
Сахароза + Н2O + 2Pi +2АDР + 6NАD+ —> 2 цитрат + 2АТР + 6NАDН + 10Н+
в) В суммарной реакции расходуется NАD+. Поскольку запасы этого окисленного кофермента в клетке ограничены, необходим его рецикл в электронтранспортной цепи, сопровождающийся потреблением O2. Итак, превращение сахарозы в цитрат — аэробный процесс, требующий участия молекулярного кислорода.
28. Сукцинил-СоА — промежуточное соединение в цикле лимонной кислоты; его накопление свидетельствует о замедлении потока метаболитов в цикле, требующем сокращения поступления в цикл ацетил-СоА. Цитратсинтаза, регулирующая в клетке очень важный окислительный путь, контролирует наличие NАDН и, следовательно, поток электронов от NАDН на O2.
29. Катаболизм жирных кислот сопровождается увеличением концентрации ацетил-СоА, который стимулирует пируваткарбоксилазу. Происходящий в результате рост концентрации оксалоацетата стимулирует расход ацетил-СоА в цикле лимонной кислоты, что приводит к росту концентрации цитрата и ингибированию гликолиза на уровне РFК-1. Кроме того, повышенные концентрации ацетил-СоА ингибируют пируватдегидрогеназный комплекс, замедляя использование пирувата из гликолиза.
30. Кислород нужен для получения NАD+ из NАDН, образовавшегося в реакциях цикла лимонной кислоты. Окисление NАDН происходит в реакциях окислительного фосфорилирования в митохондриях.
31. В соответствии с законом действующих масс при увеличении отношения [NАDН]/[NАD+] цикл лимонной кислоты замедляется на трех стадиях, сопровождающихся восстановлением NАD+. При высокой концентрации NАDН равновесие смещается в сторону образования NАD+.
32. Реакция направлена в сторону образования цитрата; в этих условиях ∆G реакции цитратсинтазы составляет примерно -8 кДж/моль.
33. Стадии ④ и ⑤ необходимы для реокисления липоамидного кофактора.
34. Цикл лимонной кислоты играет настолько важную роль в метаболизме, что серьезные дефекты любого фермента цикла летальны для эмбриона.
35. Первый фермент каждого пути находится под двойным аллостерическим контролем. Ингибирование одного пути направляет изоцитрат по другому пути
36. а) Единственной реакцией в мышечной ткани, происходящей со значительным потреблением кислорода, является клеточное дыхание, поэтому по потреблению O2 хорошо оценивать активность дыхания. б) В свежеприготовленной мышечной ткани присутствует остаточное количество глюкозы; потребление O2 связано с окислением этой глюкозы. в) Да. Поскольку количество потребленного O2 возрастает при добавлении цитрата или 1-глицерофосфата, в данной системе оба могут служить субстратами в клеточном дыхании, г) Эксперимент I: в присутствии цитрата затрачивается намного больше кислорода, чем должно быть использовано на его полное окисление. Единственным объяснением может быть то, что каждая молекула цитрата вступает в реакцию более одного раза, т. е. ведет себя так, как катализатор. Эксперимент II: ответ заключается в расчете дополнительного O2, использованного каждым образцом по сравнению с контролем (образец 1).
Образец |
Дополнительный субстрат |
Потребление О2, мкл |
Избыток потребления О2, мкл |
1 |
нет |
342 |
0 |
2 |
0,3 мл 0,2 М 1 - глицерофосфата |
757 |
415 |
3 |
0,15 мл 0,02 М цитрата |
431 |
89 |
4 |
0,3 мл 0,2 М 1 - глицерофосфата + 0,15 мл 0,02 М цитрата |
1385 |
1043 |
Если бы цитрат и 1-глицерофосфат были просто субстратами, дополнительное количество поглощенного кислорода в образце 4 было бы суммой соответствующих показателей в образцах 2 и 3 (415 + 89 = 504). Однако мы наблюдаем двукратное превышение этой величины. Таким образом, цитрат повышает способность ткани метаболизировать 1-глицерофосфат. Это типичное поведение катализатора. Для подтверждения этого вывода необходимы результаты обоих экспериментов (I и II). Из результатов эксперимента I видно, что цитрат ускоряет реакцию, но невозможно понять, способствует ли он метаболизму субстрата или действует по другому механизму. Из результатов эксперимента II невозможно установить, какое из веществ катализатор — цитрат или 1-глицерофосфат. Два эксперимента вместе позволяют твердо сказать, что цитрат выступает в роли катализатора в процессе окисления 1-глицерофосфата, д) Поскольку в данном процессе происходит расходование цитрата (образец 3), действующего в качестве катализатора, на каком-то этапе он должен регенерировать. Если в последовательности реакций цитрат сначала расходуется, а потом регенерируется, последовательность реакций не линейная, а циклическая, е) Если процесс останавливается на α-кетоглутаратдегидрогеназной реакции, цитрат превращается в α-кетоглутарат, но не претерпевает дальнейших превращений. Кислород расходуется на реокисление NАDН, образовавшегося в реакции изоцитратдегидрогеназы.
ж)
Этот рисунок отличается от рис. 16-7 тем, что здесь отсутствуют цис-аконитат и изоцитрат (между цитратом и α-кетоглутаратом), а также сукцинил- СоА и ацетил-СоА. з) Количественный анализ позволяет исключить разветвленную или другую более сложную схему процесса.
Глава 17
1. В составе жирной кислоты; атомы углерода в жирной кислоте восстановлены сильнее, чем в глицерине.
2. а) 4,0 • 105 кДж (9,6 • 104 ккал); б) 48 сут., в) 0,48 фунтов/сут.
3. Первая стадия цикла окисления жирных кислот аналогична реакции превращения сукцината в фумарат, вторая стадия — реакции превращения фумарата в малат, а третья - реакции превращения малата в α- салоацетат.
4. Семь циклов; в последнем образуются 2 молекулы ацетил-СоА.
5. а) R- СОО + АТР —> ацил-АМР + РPi
ацил-АМР + СоА —> ацил-СоА + АМР
б) Необратимый гидролиз РРi до 2Рi осуществляемый в клетке неорганической пирофосфатазой
6. цис-∆3-Додеканоил-СоА; он конвертируется в цис- ∆2-додеканоил-СоА, а затем в β-гидроксидодеканоил - СоА.
7. 4 ацетил-СоА и 1 пропионил-СоА.
8. Да. Часть трития удаляется из пальмитата в реакциях дегидрирования в процессе β-окисления. Удаленный тритий обнаруживается в тритированной воде.
9. В цитозоле активированные (соединенные с СоА) жирные кислоты сначала переносятся на карнитин, в результате чего высвобождается СоА, а затем транспортируются в митохондрии, где вновь вступают во взаимодействие с СоА. Таким образом, цитозольный и митохондриальный пулы СоА содержатся раздельно, поэтому радиоактивный СоА из цитозоля не проникает в митохондрии.
10. а) У голубей преобладает β-окисление, а у фазанов — анаэробный гликолиз гликогена, б) Мышцы голубя потребляют больше О2. в) Жиры содержат больше энергии в пересчете на 1 г вещества, чем гликоген. Кроме того, анаэробное расщепление гликогена ограничено толерантностью тканей к лактату. Поэтому голубь, использующий при полете окислительный катаболизм жиров, летает на значительно более длинные расстояния. г) Эти ферменты являются регуляторными ферментами в соответствующих метаболических путях и, следовательно, ограничивают скорость образования АТР.
11. Малонил-СоА больше не ингибирует транспорт жирных кислот в митохондрии и β-окисление, поэтому может возникнуть холостой цикл, в котором одновременно происходит синтез жирных кислот в цитозоле и их распад в митохондриях.
12. а) Транспорт жирных кислот в митохондрии, опосредованный карнитином, определяет скорость всего процесса окисления жирных кислот. Недостаточность карнитина приводит к замедлению окисления жирных кислот, а добавление карнитина повышает скорость окисления, б) Все эти факторы усиливают необходимость окисления жирных кислот, в) Недостаточность карнитина может быть следствием недостаточности его предшественника, лизина, или дефектом одного из ферментов, участвующих в биосинтезе карнитина.
13. При окислении жиров выделяется метаболическая вода; 1,4 л воды на 1 кг трипальмитоилглицерина (небольшой вклад глицерина не учитываем).
14. Бактерии можно использовать для полного окисления углеводородов до СО2 и Н2О. Однако трудно обеспечить хороший контакт между углеводородами и бактериальными ферментами. Кроме того, может не хватать таких необходимых бактериям элементов, как азот и фосфор, что может ограничивать их рост.
15. а) Мr 136; фенилуксусная кислота; б) четное
16. Митохондриальный пул СоА не столь большой, поэтому СоА нужно извлекать из ацетил-СоА в процессе образования кетоновых тел. Это позволяет осуществлять β-окисление, необходимое для получения энергии.
17. а) В процессе гликолиза из глюкозы образуется пируват, а пируват является основным источником оксалоацетата. При отсутствии глюкозы в рационе питания концентрация оксалоацетата падает, и цикл трикарбоновых кислот замедляется. б) С нечетным числом атомов; при превращении пропионата в сукцинил-СоА образуются промежуточные продукты цикла лимонной кислоты и четырехуглеродные предшественники для глюконеогенеза.
18. В случае гептановой кислоты, состоящей из нечетного числа атомов углерода, β-окисление приводит к образованию пропионил-СоА, который за несколько стадий может превращаться в оксало- ацетат — исходное соединение для глюконеогенеза. Жирные кислоты с четным числом атомов углерода не могут служить источником исходных соединений для глюконеогенеза, поскольку полностью окисляются до ацетил-СоА.
19. При β-окислении ω-фторолеата образуется фтор- ацетил-СоА, который включается в цикл лимонной кислоты и превращается в фторцитрат, мощный ингибитор аконитазы. Ингибирование аконитазы останавливает цикл. Отсутствие восстанавливающих эквивалентов из цикла лимонной кислоты делает невозможным окислительное фосфорилирование (синтез АТР).
20. Замена Ser на Ala блокирует β-окисление в митохондриях. Замена Ser на Asp блокирует синтез жирных кислот и стимулирует β-окисление.
21. Реакция на глюкагон или адреналин стала бы более длительной, что способствовало бы усилению мобилизации жирных кислот в адипоцитах.
22. Комплекс Enz-FAD, имеющий более положительный стандартный восстановительный потенциал, является лучшим акцептором электронов, чем NAD+, и реакция направлена в сторону окисления ацил-СоА. За это более благоприятное равновесие приходится расплачиваться 1 молекулой АТР: лишь 1,5 молекулы АТР образуется в расчете на молекулу FADH2, окисленную в дыхательной цепи, в отличие от 2,5 молекул АТР на молекулу NADH.
23. Девять циклов; арахидоновая кислота (насыщенная кислота, состоящая из 20 атомов углерода) превращается в 10 молекул ацетил-СоА. из которых две образуются в девятом цикле.
24. См. рис. 17-11. Образуется [3-14С] сукцинил-СоА, из которого затем получается меченный по атомам С2 и С3 оксалоацетат.
25. Фитановая кислота —> пристановая кислота —> пропионил-СоА —>—>—> сукцинил-СоА —> сукцинат —> фумарат —> малат. Все атомы углерода в малате содержат метку, но в атомах С1 и С4 ее в 2 раза меньше, чем в С2 и С3.
26. В клеточных реакциях, требующих расхода энергии, гидролиз АТР происходит с участием воды: АТР + Н2O —> ADP + Рi. В суммарной реакции Н2O нет.
27. Метилмалонил-СоА-мутаза нуждается в кобальтсодержащем кофакторе, образующемся из витамина В12.
28. Потеря массы за сутки составляет около 0,66 кг, или 140 кг за 7 месяцев. Кетоза можно избежать путем деградации неэссенциальных белков в глюконеогенезе.
29. а) Жирные кислоты превращаются в СоА-производные под действием ферментов цитоплазмы, а затем ацил-СоА переносятся в митохондрии для окисления. Поскольку в эксперименте использовались изолированные митохондрии, в нем расходовались производные СоА. б) Стеарил-СоА быстро превращается в 9 молекул ацетил-СоА в процессе β-окисления. Все промежуточные соединения претерпевают быстрые превращения, поэтому детектировать их практически не удается. в) Два цикла. В каждом цикле удаляются два атома углерода, поэтому через два цикла 18-угле- родпая жирная кислота превращается в 14-углеродную и 2 молекулы ацетил-СоА. г) Значение Км больше для трансизомеров, чем для цис- изомеров, так что одинаковая скорость расщепления достигается при более высокой концентрации трансизомеров по сравнению с дис-изомерами. В общем, трансизомеры связываются хуже цис- изомеров, вероятно, по геометрическим причинам, пусть даже и непрямо в участке связывания, д) Накопление каждого конкретного субстрата в реакциях LCAD VLCAD происходит по-разному, что и следует ожидать для лимитирующих стадий пути. е) Кинетические данные показывают, что трансизомер менее пригоден как субстрат для LCAD, чем цис-изомер, но в случае VLCAD различие между субстратами небольшое. Будучи менее пригодным субстратом, трансизомер накапливается в большей степени, чем цис-изомер. ж) Один возможный путь изображен ниже (пометки «внутри» и «снаружи» указывают локализацию веществ по отношению к митохондриям)
з) Справедливо, что транс-жиры расщепляются менее эффективно, чем цис-жиры, и поэтому могут «вытекать» из митохондрий. Но нельзя сказать, что транс-жиры совсем не расщепляются клетками: они расщепляются, но медленнее, чем цис-жиры.
Глава 18
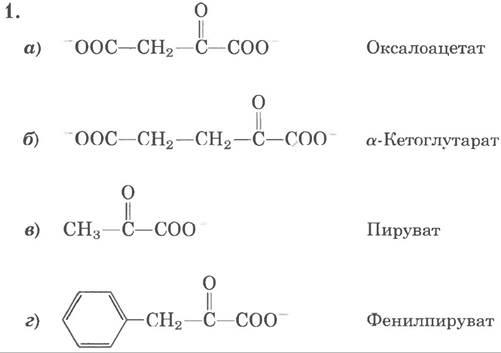
2. Метод основан на анализе параметров сопряженной реакции. Продукт медленной реакции трансаминирования (пируват) быстро расходуется в следующей «индикаторной» реакции, катализируемой лактатдегидрогеназой, которая сопровождается расходом NADH. Таким образом, скорость исчезновения NADH можно использовать при оценке скорости аминотрансферазной реакции. За ходом индикаторной реакции следят с помощью спектрофотометра по уменьшению поглощения NADH при 340 нм.
3. Аланин и глутамин играют особую роль в транспорте аминогрупп из мышц и других внепеченочных тканей (соответственно) в печень.
4. Не будет. В реакции трансаминирования азот из аланина переносится на оксалоацетат, в результате чего образуется аспартат.
5. 15 моль АТР на моль лактата; 13 моль АТР на моль аланина, если учитывать удаление азота.
6. а) Голодание приводит к снижению уровня глюкозы крови; после приема пищи происходит быстрый катаболизм глюкогенных аминокислот, б) Окислительное дезаминирование вызывает повышение уровня NH3, но из-за отсутствия аргинина (промежуточного соединения в цикле мочевины) NH3 не может включаться в мочевину. У кошки аргинин не синтезируется в достаточном количестве, чтобы преодолеть ситуацию, вызванную экспериментальными условиями. Таким образом, для этого животного аргинин — незаменимая аминокислота, в) В цикле мочевины орнитин превращается в аргинин.
7. Н2О + глутамат + NAD+ —> α-кетоглутарат + NH4+ + NADH + Н+ NH4+ + 2АТР + Н2О + СО2 —> карбамоилфосфат + 2ADP + Pi + 3Н +
Карбамоилфосфат + орнитин —> цитруллин + Рi + Н+
Цитруллин + аспартат + АТР —> аргининосукцинат + АМР + РРi + Н+
Аргининосукцинат —> аргинин + фумарат
Фумарат + Н2O —> малат
Малат + NAD+ —> оксалоацетат + NADH + Н+
Оксалоацетат + глутамат —> аспартат + α-кетоглутарат
Аргинин + Н2O —> мочевина + орнитин
Итого:
2 Глутамат + СO2 + 4Н2O + 2NAD+ + 3АТР —> 2 α-кетоглутарат +2NADH + 7Н+ + мочевина + 2ADP + АМР + PPi + 2Рi (1)
Кроме того, следует учесть дополнительные реакции:
АМР + ATP —> 2ADP (2)
O2 + 8Н+ + 2NADH + 6ADP + 6Рi —> 2NAD+ + 6АТР + 8Н2O (3)
Н2O + PPi —> 2Рi + Н+ (4)
Суммируя все приведенные выше реакции, получаем:
2 Глутамат + СO2 + O2 + 2ADP + 2Рi —> 2 α-кетоглутарат + мочевина + 3Н2O + 2АТР
8. Вторая аминогруппа в составе мочевины переносится туда из аспартата, который образуется в реакции трансаминирования между глутаматом и оксалоацетатом, катализируемой аспартатаминотрансферазой. Примерно половина всех аминогрупп, выделяющихся из организма в составе мочевины, проходит через реакцию аспартатаминотрансферазы, что и объясняет очень высокую активность этого фермента по сравнению с другими аминотрансферазами.
9. а) При строгой белковой диете аминокислоты — это единственный источник метаболической энергии. Поскольку катаболизм аминокислот сопряжен с выведением избытка азота в составе мочевины, организм нуждается в дополнительном количестве воды для разбавления избытка мочевины в моче. Кроме того, электролиты в «жидком белке» тоже должны быть разбавлены и выведены из организма. Если суммарная суточная потеря воды не компенсируется обильным питьем, происходит потеря воды организмом. б) При анализе пищевой ценности белка необходимо учитывать общее количество аминокислот, необходимое для синтеза белка в организме, и аминокислотный состав пищевого белка. Например, содержание аминокислот в желатине не сбалансировано. При употреблении в пищу большого количества желатина и расщеплении избыточного количества аминокислот может быть превышена емкость цикла мочевины, что приводит к интоксикации аммиаком. Состояние здоровья человека может усугубляться обезвоживанием, вызванным выведением из организма большого количества мочевины. Сочетание этих двух факторов может стать причиной комы и смерти.
10. Лизин и лейцин
11. а) Фенилаланингидроксилаза; диета с пониженным содержанием фенилаланина, б) Блокирован нормальный путь гидроксилирования фенилаланина с образованием тирозина, и поэтому происходит накопление фенилаланина, в) В результате трансаминирования фенилаланин превращается в фенилпируват, который затем восстанавливается до фениллактата. Для этой реакции трансаминирования К = 1,0, так что при накоплении фенилаланина образуется значительное количество фенил- пирувата. г) Это связано с низким уровнем синтеза тирозина — предшественника пигмента меланина.
12. Нарушается катаболизм углеродного скелета валина, метионина и изолейцина, что связано с отсутствием активности метилмалонил-СоА-мутазы, которой в качестве кофермента необходим витамин В12. Физиологические последствия недостаточности этого фермента описаны в табл. 18-2 и в дополнении 18-2 (т. 2).
13. В диете веганов недостает витамина В12, что через несколько лет приводит к тому, что у этих людей концентрация гомоцистеина и метилмалоната в крови повышается (что отражает недостаточность метионинсинтазы и метилмалонилмутазы соответственно). Лактовегетарианцы получают некоторое количество витамина В12 в составе молочных продуктов.
14. Генетическая форма пернициозной анемии обычно возникает как результат нарушения всасывания пищевого витамина В12 (см. дополнение 17-2, т. 2). Поскольку соответствующие пищевые добавки также не всасываются в кишечнике, для лечения больных применяют внутривенные инъекции препаратов В12
15. Механизм идентичен механизму реакции сериндегидратазы (см. рис. 18-20, а, т. 2) с тем только исключением, что сохраняется дополнительная метальная группа треонина и поэтому образуется не пируват, а α-кетобутират.
17. а) Изолейцин —> II —> IV —> I —> V —> III —> ацетил- СоА + пропионил-СоА; б) Стадии: (1) трансаминирование — аналогичной реакции нет; PLP; (2) окислительное декарбоксилирование — реакция аналогична пируватдегидрогеназной реакции; NAD+. ТРР, липоат и FAD; (3) окисление — реакция аналогична сукцинатдегидрогеназной реакции; FAD: (4) гидратация реакция аналогична реакции фумаразы; кофактора нет; (5) окисление реакция аналогична малатдегидрогеназной реакции; NAD+; (6) тиолиз (реакция, обратная альдольной конденсации) - аналогична реакции тиолазы: СоА.
18. Вероятный механизм реакции:
19. а) Трансаминирование — аналогов нет; PLP. б) Окислительное декарбоксилирование - аналогично окислительному декарбоксилированию пирувата до ацетил-СоА перед вхождением в цикл лимонной кислоты или превращению α-кетоглутарата до сукцинил-СоА в цикле лимонной кислоты; NAD+, FAD, липоат и ТРР. в) Дегидратация (окисление) аналогична дегидратации сукцината с образованием фумарата в цикле лимонной кислоты или ацил-СоА с образованием еноил-СоА при β-окислении; FAD. г) Карбоксилирование — нет аналогов в цикле лимонной кислоты или реакциях Р-окисления; АТР и биотин, д) Гидратация реакция аналогична гидратации фумарата до малата в цикле лимонной кислоты или еноил-СоА до 3-гидроксиацил-СоА при β-окисления; кофакторов нет. е) Реакция, обратная альдольной реакции, - аналогична обратной цитратсинтазной реакции в цикле лимонной кислоты; кофакторов нет.
20. а) Лейцин, валин, изолейцин, б) Цистеин (образующийся из цистина) Если цистеин подвергается декарбоксилированию, как показано на рис. 18-6, это приводит к образованию H3N+- СН2- CH2-SH, который может окисляться до таурина, в) В январе 1957 г. в крови отмечается сильно повышенный уровень изолейцина, лейцина, метионина и валина, а в моче - повышенный уровень изолейцина, лейцина, таурина и валина, г) У всех пациентов высокое содержание изолейцина, лейцина и валина в крови и моче, что указывает на нарушение процесса расщепления этих аминокислот. Учитывая, что в моче, кроме того, содержится много кетоформ этих трех аминокислот, метаболический путь блокирован после стадии дезаминирования, но до дегидрирования (как показано на рис. 18-28). д) Модель не объясняет высокой концентрации метионина в крови и таурина в моче. Высокий уровень таурина может быть связан с отмиранием клеток головного мозга на терминальных стадиях заболевания. Однако причины повышения уровня метионина непонятны. Путь расщепления метионина не связан с путями расщепления разветвленных аминокислот. Возможно, повышение уровня метионина является вторичным эффектом накопления других аминокислот. Важно помнить, что образцы января 1957 г. взяты у умирающего ребенка, так что сравнивать эти показатели с показателями крови здорового человека, по-видимому, не совсем корректно. е) Требуется следующая информация (и она впоследствии была получена другими исследователями): (1) у людей с болезнью кленового сиропа значительно понижена или отсутствует активность дегидрогеназы; (2) болезнь вызвана дефектом одного единственного гена; (3) этот ген кодирует часть белка или весь белок с дегидрогеназной активностью; (4) генетический дефект приводит к синтезу неактивного фермента.
Глава 19
1. Реакция 1: (а), (г) NADH; (б), (д) E-FMN; (в) NAD+/NADH и E-FMN/FMNH2
Реакция 2: (а), (г) E-FMNH2; (б), (д) Fe3+; (в) E-FMN/FMNH2 и Fe3+/Fe2+
Реакция 3: (а), (г) Fe2+; (б), (д) Q; (в) Fe3+/Fe2+ и Q/QH2
2. Боковая цепь позволяет убихинону растворяться в липидах и диффундировать в полужидких мембранах.
3. На основании различия стандартных восстановительных потенциалов (∆Е'°) для каждой пары полуреакций можно найти значение ∆G'°. Окислению сукцината под действием FAD способствует отрицательное стандартное изменение свободной энергии (∆G'° = -3,7 кДж/моль). Окисление NAD+ сопровождалось бы значительным положительным стандартным изменением свободной энергии ∆G'° = 68 кДж/моль).
4. а) Все переносчики восстановлены; CN- блокирует восстановление O2 под действием цитохромоксидазы. б) Все переносчики восстановлены; если нет О2, восстановленные переносчики не могут окисляться, в) Все переносчики окислены, г) Переносчики на ранних стадиях восстановлены, на более поздних стадиях — окислены.
5. а) Ингибирование NADH-дегидрогеназы ротеноном снижает скорость потока электронов в дыхательной цепи, что в свою очередь снижает скорость образования АТР. Если из-за этого, организму перестает хватать АТР, наступает смерть, б) Антимицин А сильно ингибирует окисление Q в дыхательной цепи, снижая скорость переноса электронов и вызывая все те последствия, что перечислены в (а), в) Поскольку антимицин А блокирует передачу на кислород всех электронов, он — более сильный яд, чем ротенон, который блокирует только передачу электронов от NADH, но не от FADH2.
6. а) Для удовлетворения потребности в АТР повышается скорость переноса электронов, следовательно, соотношение P/О понижается, б) При высокой концентрации разобщающего агента отношение Р/О близко к нулю. При снижении этого отношения для производства того же количества АТР следует окислить больше топливных молекул. Избыток тепла, выделяющегося в этих окислительных процессах, повышает температуру тела, в) Повышение активности дыхательной цепи в присутствии разобщающего агента требует расщепления дополнительных топливных молекул. Окисление дополнительных топливных молекул (включая запасные жиры) для выработки того же количества АТР приводит к уменьшению массы тела. При Р/О —> 0 недостаток АТР вызывает смерть.
7. Валиномицин выступает в роли разобщающего агента. Он взаимодействует с ионами К+, образуя комплекс, проникающий через внутреннюю мембрану митохондрий, что нарушает мембранный потенциал. Снижается производство АТР, что вызывает повышение скорости передачи электронов. Это в свою очередь вызывает повышение протонного градиента, усиливает потребление кислорода и выделение тепла.
8. а) Ингибируется образование АТР. б) Образование АТР тесно сопряжено с переносом электронов: 2,4-динитрофенол является разобщающим агентом для окислительного фосфорилирования, в) С олигомицином.
9. Цитозольная малатдегидрогеназа играет ключевую роль в транспорте восстановительных эквивалентов через внутреннюю мембрану митохондрий с помощью малат-аспартатного челночного механизма.
10. a) Гликолиз становится анаэробным, б) Потребление кислорода прекращается, в) Усиливается образование лактата, г) Выход АТР снижается до 2 АТР на молекулу глюкозы.
11. Стационарная концентрация Рi в клетке намного выше концентрации ADP. Рi, образующийся при гидролизе АТР, очень мало влияет на общую концентрацию Рi.
12. Реакция на изменение (а) происходит значительно быстрее, поскольку реакция на изменение (б) связана с синтезом белка.
13. а) Вместо молочнокислого брожения происходит окисление NADH благодаря передаче электронов, б) Окислительное фосфорилирование более эффективно. в) В условиях высокого отношения действующих масс в системе АТР происходит ингибирование фосфофруктокиназы-1.
14. Преимущество в том, что сбраживание древесных опилок до спирта можно проводить в присутствии O2 и нет необходимости строго соблюдать анаэробные условия, что весьма сложно. Эффект Пастера не наблюдается ввиду неактивности цикла лимонной кислоты и электронтранспортной цепи.
15. Возможен более эффективный транспорт электронов между комплексами.
16. а) Внешняя среда: 4,0 • 10-8 М; матрикс: 2,0 • 10-8 М; б) энергетический вклад ∆рН (градиента концентрации Н+) 1,7 кДж/моль; в) 21; г) недостаточно; д) общий трансмембранный потенциал.
17. а) 0 ,91 мкмоль/ (с • г); б) 5,5 с; для поддержания концентрации АТР на постоянном уровне регуляция его синтеза должна быть слаженной и быстрой.
18. 53 мкмоль/ (с • г). При стационарной концентрации АТР 7,0 мкмоль/г это эквивалентно 10 оборотам пула АТР в секунду. Этого запаса хватит на 0,13 с.
19. Реактивные формы кислорода взаимодействуют с макромолекулами, включая ДНК. Если дефект митохондриального гена приводит к активной продукции РФК, могут повреждаться ядерные гены, кодирующие протоонкогены, что приводит к образованию онкогенов, неконтролируемому росту клеток и раку.
20. Различия в степени гетероплазмии по дефектному гену являются причиной разной степени тяжести митохондриальных заболеваний.
21. Внутренняя мембрана митохондрий непроницаема для NADH, но восстанавливающие эквиваленты NADH переносятся через мембрану косвенным путем: они передаются на оксалоацетат в цитозоль, образующийся малат проникает в матрикс и митохондриальный NAD+ восстанавливается до NADH.
22. Цикл лимонной кислоты останавливается из-за отсутствия акцептора электронов, способного принять их от NADH. Образующийся в процессе гликолиза пируват не может войти в цикл в виде ацетил-СоА; накапливающийся пируват в результате трансаминирования превращается в аланин и доставляется в печень.
23. Пируватдегидрогеназа локализована в митохондриях, глицеральдегид-3-фосфатдегидрогеназа — в цитозоле. Пулы клеточного NAD+ разделены внутренней митохондриальной мембраной.
24. Полное отсутствие глюкокиназы (две дефектные аллели) делает невозможным проведение гликолиза с такой скоростью, которая обеспечила бы необходимую для секреции инсулина концентрацию АТР.
25. Дефект комплекса II приводит к усилению синтеза РФК, повреждению ДНК и мутациям, которые вызывают нерегулируемое деление клеток (рак). Пока неизвестно, почему рак возникает именно в среднем отделе тонкого кишечника.
26. Для достижения максимальной скорости фотосинтеза ФСI (которая поглощает свет с длиной волны 700 нм) и ФСII (поглощает свет с длиной волны 680 нм) должны функционировать одновременно.
27. Источником дополнительной массы является вода, потребленная в суммарной реакции.
28. Пурпурные серные бактерии в качестве донора водорода в процессе фотосинтеза используют H2S. Кислород в этих реакциях нс участвует, поскольку единственная фотосистема бактерии не имеет марганецсодержащего расщепляющего воду комплекса.
29. 0,44
30. а) Останавливает; б) замедляет; некоторое количество электронов продолжает циркулировать по циклическому пути.
31. При освещении устанавливается градиент протонов. При добавлении ADP и Рi этот градиент направляет синтез АТР, но в темноте градиент исчезает.
32. Диурон блокирует перенос электронов между ФСII и первым участком синтеза АТР.
33. В присутствии вентурицидина блокирован перенос протонов через комплекс CF0CF1, и поток электронов (выделение кислорода) продолжается лишь до тех пор, пока изменение свободной энергии в процессе перекачки протонов против увеличивающегося протонного градиента не станет равным доступной свободной энергией фотонов. Динитрофенол, разрушающий протонный градиент, восстанавливает поток электронов и выделение кислорода.
34. а) 56 кДж/моль; б) 0,29 В.
35. Из разницы восстановительных потенциалов можно найти, что ∆G′° реакции составляет 15 кДж/моль. Рисунок 19-46 показывает, что энергии фотонов из любой области видимой части спектра более чем достаточно для проведения этой эндергонической реакции.
36. 1,35 • 10-77; реакция крайне неблагоприятна! В хлоропластах этот барьер преодолевается за счет энергии солнечного света.
37. -920 кДж/моль.
38. Не образуется. Электроны от Н2O поступают на искусственный акцептор электронов — Fe3+, а не на NADP+.
39. Примерно 1 раз за 0,1 с; возбуждается 1 молекула из 108.
40. Свет с длиной волны 700 нм возбуждает ФСI, но не ФСII. Электроны передаются от Р700 на NADP+, но от Р680 электроны не поступают. При возбуждении ФСII светом с длиной волны 680 нм электроны начинают перемещаться в направлении к ФСI, но очень скоро переносчики электронов между двумя системами полностью восстанавливаются.
41. Не участвует. Возбужденный электрон от Р700 возвращается для заполнения «дырки», возникшей при облучении. ФСII не должна участвовать в передаче электронов, и O2 из Н2O не выделяется. NADPH не образуется, поскольку возбужденный электрон возвращается к Р700.
42. а) (1) Наличие Mg2+ согласуется с гипотезой о том, что хлорофилл непосредственно участвует в катализе реакции фосфорилирования: ADP + Рi —> АТР. (2) Многие ферменты (и другие белки), содержащие Mg2+, не участвуют в фосфорилировании, так что наличие Mg2+ в хлорофилле не доказывает его участие в фосфорилировании. (3) Наличие Mg2+ важно для фотохимических свойств хлорофилла — поглощения света и переноса электронов.
б) (1) Ферменты катализируют обратимые реакции, так что изолированный фермент, который в определенных экспериментальных условиях катализирует удаление фосфорильной группы, возможно, в других условиях (как в клетке) может катализировать присоединение фосфорильной группы. Поэтому возможно, что хлорофилл участвует в фосфорилировании ADP. (2) Есть два возможных объяснения: хлорофилл обладает только фосфатазной активностью и не катализирует фосфорилирование ADP в клетке, либо грубый препарат содержит примесную фосфатазную активность, не связанную с реакциями фотосинтеза. (3) Возможно, препарат содержит примесную нефотосинтетическую фосфатазную активность.
в) (1) Ингибирования светом следовало бы ожидать, если бы хлорофилловый белок катализировал реакцию: ADP + Рi + свет —> АТР. Отсутствие света благоприятствовало бы протеканию обратной реакции — дефосфорилированию. На свету система получает энергию и равновесие сдвигается вправо, снижая фосфатазную активность. (2) Это ингибирование может быть артефактом выделения или анализа. (3) Вряд ли грубые методы выделения того времени позволили в целостности сохранить мембраны хлоропластов, поэтому ингибирование, скорее всего, является артефактом, г) (1) На свету происходит синтез АТР и потребление других фосфорилированных веществ. (2) На свету происходит образование глюкозы и ее метаболизм в процессе клеточного дыхания для производства АТР, что сопровождается изменением уровня фосфорилированных интермедиатов. (3) На свету образуется АТР и расходуются другие фосфорилированные интермедиаты, д) Световая энергия используется для образования АТР (как в модели Эмерсона) и образования восстанавливающей силы (как в модели Рабиновича), е) Приблизительная стехиометрия процесса фосфорилирования (гл. 19) такова: 8 фотонов приводят к образованию 2 молекул NADPH и около 3 молекул АТР. Для восстановления 1 молекулы СO2 нужны 2 молекулы NADPH и 3 молекулы АТР (гл. 20). Таким образом, для восстановления одной молекулы СO2 требуется как минимум 8 фотонов. Это значение вполне соответствует модели Рабиновича. ж) Поскольку энергия света используется для получения как АТР, так и NADPH, вклад каждого поглощенного фотона заключается больше чем в образовании лишь одной молекулы АТР. Процесс извлечения энергии света более эффективен, чем предполагал Рабинович, и для реакций фотосинтеза годится любой свет, даже красный.
Глава 20
1. В некоторых органеллах концентрация специфических ферментов и метаболитов повышена, и существуют раздельные пулы кофакторов и интермедиатов. Регуляторные механизмы воздействуют лишь на конкретный пул веществ и конкретную группу ферментов.
2. Это наблюдение подтверждает, что АТР и NADPH образуются на свету и необходимы для фиксации СO2. Конверсия прекращается при исчерпании резерва АТР и NADPH. Кроме того, в темноте отключаются некоторые ферменты.
3. X — 3-фосфоглицерат, Y — рибулозо-1,5-бисфосфат.
4. Рибулозо-5-фосфат-киназа, фруктозо-1,6-бисфосфатаза, седогептулозо-1,7-бисфосфатаза и глицеральдегид-3-фосфатдегидрогеназа. Все активируются в результате восстановления критической дисульфидной связи до пары сульфгидрильных групп. Иодоацетат необратимо связывается с этими свободными сульфгидрильными группами.
5. Для осуществления реакций обмена дисульфидных групп, активирующих ферменты цикла Кальвина, тиоредоксину нужны обе сульфгидрильные группы.
6. Восстановительный пентозофосфатный путь приводит к образованию рибулозо- 1,5-бисфосфата из триозофосфатов, появившихся в процессе фотосинтеза. Окислительный пентозофосфатный путь обеспечивает NАDРН для восстановительного биосинтеза и пентозофосфаты для синтеза нуклеотидов.
7. Оба типа «дыхания» происходят в растениях и сопровождаются поглощением O2 и выделением СO2. (У животных также реализуется механизм митохондриального дыхания.) Митохондриальное дыхание осуществляется непрерывно. Электроны от различных топливных молекул проходят через цепь переносчиков во внутренней мембране митохондрий и поступают к O2. Фотодыхание происходит в хлоропластах, пероксисомах и митохондриях. Оно осуществляется в дневное время, когда происходит процесс фотосинтетической фиксации углерода. Митохондриальное дыхание происходит главным образом ночью или в пасмурные дни. Путь электронов в процессе фотодыхания изображен на рис. 20-21, а в процессе митохондриального дыхания — на рис. 19-16.
8. Эта гипотеза подразумевает особую эволюцию, т. е. эволюцию, направленную на реализацию определенной цели. Такие идеи обычно не поддерживаются биологами-эволюционистами. Другие процессы, такие как сжигание ископаемого топлива и уничтожение лесов, сильнее воздействуют на состав атмосферы. С4-растения, фиксирующие СО2 в условиях, когда рубиско предпочитает О2 в качестве субстрата, также участвуют в установлении отношения СО2/О2 в атмосфере.
9. а) Без поступления NАDРН из пентозофосфатного пути клетки не могли бы синтезировать липиды и другие восстановленные соединения, б) Без рибулозо-1,5-бисфосфата блокируется цикл Кальвина.
10. Фиксация СO2 кукурузой происходит по С4-пути, изученному Хетчем и Слеком. В этом процессе ФЕП быстро карбоксилируется, превращаясь в оксалоацетат (некоторое количество последнего подвергается трансаминированию с образованием аспартата), а затем восстанавливается до малата. Только вслед за декарбоксилированием СO2 включается в цикл Кальвина.
11. Измерить скорость фиксации меченого диоксида углерода на свету (днем) и в темноте. Если фиксация сильнее в темноте, это CAM-растение. Кроме того, можно определить титруемую кислотность - так можно определить количество кислот, запасенных в вакуолях за ночь.
12. Реакция изоцитратдегидрогеназы
13. Запасание 1 моля глюкозо-6-фосфата обходится в 1 моль АТР, что составляет 3,3% всего количества АТР, образующегося в метаболизме глюкозо-6- фосфата (т. е. эффективность процесса запасания глюкозы составляет 96,7%).
14. [PPi] в цитозоле высокая, поскольку там нет неорганической пирофосфатазы.
15. а) Низкая концентрация Pi в цитозоле и высокая концентрация триозофосфатов в хлоропластах; б) высокая концентрация триозофосфатов в цитозоле.
16. 3-Фосфоглицсрат - первый продукт фотосинтеза; [Рi] увеличивается при замедлении направляемого светом синтеза АТР из ADP и Рi.
17. а) Сахароза + (глюкоза)n —> (глюкоза)n+1 + фруктоза; б) Образовавшаяся в синтезе декстрана фруктоза быстро захватывается и потребляется бактериями.
18. Вид 1 — С4-растение, вид 2 — С3-растение
19. а) В периферических хлоропластах; (б) и (в) в центре.
20. а) По аналогии с оксигенным фотосинтезом в растениях (Н2O + СO2 —> глюкоза + О2) можно записать реакцию H2S + О2 + СО2 —> глюкоза + Н2О + S. Это сумма процессов восстановления СО2 под действием H2S (H2S + СО2 —> глюкоза + S) и энергетических затрат (H2S + О2 —> S + Н2О). б) Газы H2S и СО2 образуются химическим путем в глубоководных отложениях, но О2 почти повсюду на Земле образуется в фотосинтезе под действием световой энергии, в) В экспериментах Робинсона метка 3Н находится у атома С1 в рибулозо-1,5-бис-фосфате, так что реакция с СО2 приводит к образованию 1 молекулы [3Н]-3-фосфоглицерата и 1 молекулы немеченого 3-фосфоглицерата. В реакции с О2 образуется 1 молекула [3Н]-2-фосфогликолата и 1 молекула немеченого 3-фосфоглицерата. Таким образом, отношение [3Н]-3-фосфоглицерата к [3Н]-2-фосфогликолату соответствует отношению скоростей карбоксилироваиия и оксигенирования. г) При наличии метки 3Н у атома С5 в обоих процессах получался бы [3Н]-3-фосфоглицерат, и нельзя было бы различить, в какой реакции образуется меченый продукт. Эту реакцию нельзя использовать для определения Ω.

Таким образом, скорость оксигенирования примерно в 60 раз выше скорости карбоксилирования! е) Если для наземного растения Ω = 8,6, карбоксилирование происходит с гораздо меньшей скоростью, чем оксигенирование. Это очень невыгодно, так что, по всей вероятности, рубиско наземных растений характеризуется значительно более высоким значением Ω, чем 8,6. В действительности значения Ω для наземных растений варьируют в диапазоне от 10 до 250. И даже при таких значениях теоретическая скорость оксигенирования остается достаточно высокой, ж) В реакции рубиско участвует газообразный СО2. При любой температуре молекулы 13СО2 перемещаются медленнее, чем более легкие молекулы 12СО2, поэтому 13СО2 проникает в активный центр фермента (и включается в субстрат) медленнее, чем 12СО2. з) В истинно симбиотических отношениях трубчатые черви должны получать значительную долю своего углерода от бактерий. Присутствие рубиско в эндосимбионтах просто указывает на их способность осуществлять хемосинтез, но ничего не говорит о том, что они снабжают хозяина значительным количеством собственного углерода. С другой стороны, тот факт, что соотношения 13С/12С у хозяина и эндосимбионта значительно ближе, чем у других морских обитателей, доказывает бактериальное происхождение значительной части углерода в клетках трубчатых червей.
Глава 21
1. а) Шестнадцать атомов пальмитата происходят из 8 ацетильных групп 8 молекул ацетил-СоА. Меченый ацетил-СоА превращается в малонил-СоА, содержащий метку в атомах С1 и С2. б) Метаболический пул малонил-СоА, источник всех атомов углерода в пальмитате, за исключением атомов С16 и С15, не включает метку при введении небольшого количества, меченного 14С ацетил-СоА. Следовательно, образуется только [15,16-14С]пальмитат.
2. В процессе гликолиза в пируват превращается как глюкоза, так и фруктоза. Пируват конвертируется в ацетил-СоА под действием пируватдегидрогеназнорго комплекса. Некоторая часть ацетил-СоА включается в цикл лимонной кислоты, в котором образуются восстановительные эквиваленты (NADH и NADPH). В митохондриях перенос электронов на О2 приводит к образованию АТР.
3. 8 ацетил-СоА + 15АТР + 14NADPH + 9Н2О —> пальмитат + 8СоА + 15ADP + + 15Pi + 14NADP+ + 2Н+
4. а) Три атома дейтерия на молекулу пальмитата, все они локализованы у атома С16; все другие двухуглеродные звенья образованы из немеченого малонил-СоА. б) Семь атомов дейтерия в молекуле пальмитата; они расположены у всех четных атомов углерода за исключением атома С16.
5. При использовании трехуглеродного звена малонил-СоА — активированной формы ацетил- СоА (вспомните, что для синтеза малонил-СоА требуется АТР) — метаболизм направлен в сторону синтеза жирных кислот за счет экзергонического высвобождения СO2.
6. Скорость синтеза жирных кислот лимитируется реакцией карбокислирования ацетил-СоА, которую катализирует ацетил-СоА-карбоксилаза. Высокая концентрация цитрата и изоцитрата свидетельствует о том, что условия благоприятствуют синтезу жирных кислот: активный цикл лимонной кислоты обеспечивает достаточное количество АТР, восстановленных нуклеотидов и ацетил-СоА. Цитрат стимулирует (повышает Vmах) ацетил-СоА-карбоксилазу. а) Поскольку цитрат прочнее связывается с нитчатой формой фермента (активной формой), высокая концентрация цитрата сдвигает уравнение реакции протомер <-> нитчатый полимер в сторону образования активной формы, б) Напротив, пальмитоил-СоА (конечный продукт синтеза жирных кислот) сдвигает равновесие реакции в сторону неактивной (протомерной) формы. Следовательно, при накоплении конечного продукта реакции происходит замедление биосинтеза.
7. а) Ацетил-СоА (мит) + АТР + СоА (цит) —> ацетил-СоА (цит) + ADP + Рi + СоА (мит); б) 1 АТР на ацетогруппу; в) да.
8. Двойная связь в пальмитолеате возникает в результате окислительной реакции, катализируемой ацил-СоА-десатуразой - оксидазой со смешанной функцией, использующей в качестве косубстрата кислород.
9. 3 Пальмитат + глицерин + 7АТР + 4Н2O —> трипальмитин + 7ADP + 7Pi + 7Н+
10. В организме взрослых крыс концентрация триацилглицеринов поддерживается на стационарном уровне путем уравнивания скоростей реакций расщепления и биосинтеза. Поэтому триацилглицерины жировой ткани постоянно находятся в обороте, что объясняет включение метки 14С из поступившей с пищей глюкозы.
11. Суммарная реакция:
Дигидроксиацетонфосфат + NADH + пальмитат + олеат + 3АТР + СТР + холин + 4Н2O —> фосфатидилхолин + NAD+ + 2АМР + + ADP + Н+ + СМР + 5Pi
7 молекул АТР на молекулу фосфатидилхолина
12. Недостаточность метионина снижает уровень adoMet, необходимого для de novo синтеза фосфатидилхолина. Реутилизационный путь не использует adoMet, а использует имеющийся холин. Вот почему фосфатидилхолин может синтезироваться даже при недостатке метионина в пище, пока в организме имеется холин.
13. Метка 14С появляется в активированном изопрене в трех местах:
14. а) АТР; б) UDP-глюкоза; в) CDP-этаноламин; г) UDP-галактоза; д) ацил-СоА жирной кислоты; е) S-аденозилметионин; ж) малонил-СоА; з) ∆3- изопренилпирофосфат
15. Линолеат необходим для синтеза простагландинов. Животные не могут превращать олеат в линолеат, поэтому линолеат — незаменимая жирная кислота. Растения могут осуществлять это превращение, поэтому линолеат содержится в растительной пище (см. рис. 21-12).
16. Лимитирующей стадией в биосинтезе холестерина является синтез мевалоната, катализируемый гидроксиметилглутарил-СоА-редуктазой. Этот фермент подвержен аллостерической регуляции мевалонатом и производными холестерина. Кроме того, при высокой внутриклеточной концентрации холестерина транскрипция гена HMG- СоА снижается.
17. При снижении уровня холестерина в результате приема статинов клетки пытаются компенсировать синтез путем повышения экспрессии гена HMG- СоА-редуктазы. Тем не менее статины — хорошие конкурентные ингибиторы HMG-CoA-редуктазы и снижают общий уровень синтеза холестерина.
18. Примечание: студент, незнакомый с особенностями данного фермента, может предложить несколько возможных альтернатив. Реакция тиолазы начинается с нуклеофильной атаки остатка Суs активного центра на первую молекулу ацетил-СоА, что приводит к вытеснению -S-СоА и образованию ковалентной тиоэфирной связи между остатком Суs и ацетильной группой. Затем основание в молекуле фермента притягивает протон от метильной группы второго ацетил-СоА, в результате чего образуется карбанион, атакующий углерод карбонильной группы тиоэфира, образовавшегося на предыдущей стадии. Сульфгидрильная группа остатка Суs вытесняется, и образуется ацетоацетил-СоА. Реакция НМG-СоА-синтазы начинается таким же образом и приводит к образованию тиоэфирной связи между остатком Суs в молекуле фермента и ацетильной группой ацетил-СоА с вытеснением -S-СоА. Далее -S-СоА отщепляется в виде СоА-SН, а ацетоацетил-СоА связывается с ферментом. От метальной группы связанного с ферментом ацетила отбирается протон, что приводит к образованию карбаниона, который атакует карбонил в кетогруппе ацетоацетил-СоА. В этой реакции карбонил превращается в гидроксильный ион, который протонируется, образуя -ОН. Затем тиоэфирная связь с ферментом подвергается гидролитическому расщеплению с образованием продукта реакции. Реакция НМG-СоА-редуктазы: один гидрид-ион из NАDРН вытесняет -5-СоА, а затем второй восстанавливает альдегидную группу до гидроксильной группы.
19. Статины ингибируют HMG-СоА-редуктазу — фермент на пути синтеза активированных изопренов — предшественников холестерина и многих изопреноидов, включая кофермент Q (убихинон). Следовательно, статины могут снижать количество кофермента Q, доступного для митохондриального дыхания. Убихинон содержится в пищевых продуктах, а также образуется в результате биосинтеза, но пока неизвестно, сколько убихинона требуется организму и насколько полно пищевые источники могут восполнить недостаток биосинтеза. К побочным эффектам действия статинов относится уменьшение синтеза некоторых изопреноидов.
б) «Голова к голове». Это можно объяснить двумя способами. Во-первых, «хвост» геранилгеранилфосфата имеет разветвленную диметильную структуру, как и оба конца фитоена. Во-вторых, в результате отщепления РР1 не образуется свободных гидроксильных групп, следовательно, две -O-(Р)-(Р)-«головки» связываются между со
бой, образуя фитоен. в) В четырех раундах дегидрирования четыре простые связи превращаются в двойные, г) Нет. Подсчет одинарных и двойных связей в реакции подсказывает, что одна двойная связь заменяется двумя одинарными связями, следовательно, суммарного окисления или восстановления в этом процессе не происходит.
д) Стадии ①-③. Фермент может превращать IPP и DMAPP в геранилгеранилфосфат, но не катализирует следующие стадии пути, что подтверждается результатами с другими субстратами, е) Штаммы 1-4 не имеют гена crtE и синтезируют гораздо меньше астаксантина, чем штаммы 5-8, которые характеризуются повышенной экспрессией crtE. Таким образом, повышенная экспрессия crtE приводит к значительному усилению синтеза астаксантина. Дикий штамм Е. coli обладает некоторой активностью, необходимой для реализации стадии ③, но это превращение фарнезилпирофосфата в геранилгера- нилпирофосфат является лимитирующим, ж) IPP- изомераза. Сравнение штаммов 5 и 6 показывает, что добавление ispA, продукт которого катализирует стадии ① и ②, не оказывает большого влияния на продукцию астаксантина, так что это нелимитирующие стадии. Однако из сравнения штаммов 5 и 7 следует, что добавление idi значительно усиливает синтез астаксантина, поэтому реакция IPP- изомеразы — лимитирующая стадия при повышенной экспрессии crtE. з) Уровень экспрессии был бы низким (+), сравнимым с уровнем экспрессии в штаммах 5, 6 и 9. Без повышенной экспрессии idi синтез астаксантина лимитируется низкой активностью IPP-изомеразы и, следовательно, низким уровнем IPP.
Глава 22
1. В условиях симбиоза бактерии поставляют растениям ион аммония NH4+, который получают путем восстановления атмосферного азота. Этот процесс требует значительных затрат АТР.
2. Перенос азота от NH3 на углеродный скелет могут катализировать (1) глугаминсинтетаза и (2) глутаматдегидрогеназа. Последний образует глутамат, донор аминогрупп во всех реакциях трансаминирования при образовании аминокислот и синтезе белка.
3. Сначала образуется связь между связанным с ферментом PLP и фосфогомосерином, а затем в результате перегруппировки у α-углерода субстрата образуется кетиминовая группа. Это приводит к активации β-углерода и передаче протона с последующим вытеснением фосфатной группы и образованием двойной связи между β- и y-атомами углерода. Перегруппировка (начинающаяся с удаления протона у атома углерода, соседнего с азотом аминогруппы субстрата) приводит к перемещению двойной связи между α- и β-атомами углерода, а кетимин превращается в альдимин. Атака воды на β-атом углерода облегчается связанным пиридоксалем, после чего происходит гидролиз иминовой связи между PLP и продуктом с высвобождением треонина.
4. В организме млекопитающих токсичные ионы аммония превращаются в глутамин, что снижает токсическое воздействие на головной мозг.
5. Глюкоза + 2СO2 + 2NH3 —> 2 аспартат + 2Н+ + 2Н2O
6. N-концевой домен глутаминазы примерно такой же, как у всех глутаминамидотрансфераз. Лекарство, которое связывается с этим доменом, может ингибировать многие ферменты и, следовательно, вызывать значительно больше побочных эффектов, чем более специфичный ингибитор, связывающийся с уникальной С-концевой последовательностью.
7. Если фенилаланингидроксилаза теряет активность, блокируется путь биосинтеза тирозина, и организм должен получать тирозин с пищей.
8. В синтезе adoMet происходит выделение трифосфата из АТР. Гидролиз трифосфата делает реакцию термодинамически более выгодной.
9. Если бы ингибирование глутаминсинтазы не было согласованным, при насыщающей концентрации гистидина происходило бы отключение ферментативной активности и прекращение синтеза глутамина, который нужен бактерии для синтеза других продуктов.
10. Фолиевая кислота - предшественник тетрагидрофолата (рис. 18-16, т. 2), необходимого для синтеза глицина (рис. 22-12, т. 2), предшественника порфиринов. Это объясняет, почему недостаточность фолиевой кислоты нарушает синтез гемоглобина.
11. Ауксотрофы по глицину: аденин и гуанин; ауксотрофы по глутамину, аденин, гуанин и цитозин; ауксотрофы по аспартату: аденин, гуанин, цитозин и уридин.
12. а) Механизм рацемизации аминокислот отражен на рис. 18-6 (т. 2), стадия (D. Атом фтора во фтор- аланине — прекрасная уходящая группа. Фтор- аланин вызывает необратимое (ковалентное) ингибирование аланинрацемазы. На схеме представлен возможный механизм реакции (Nuc — любая нуклеофильная группа в боковой цепи аминокислотного остатка в активном центре фермента):
б) Азасерин (см. рис. 22-48) — аналог глутамина. Диазоацетильная группа обладает высокой реакционной способностью и образует ковалентные связи с нуклеофильными группами в активном центре глутаминамидотрансферазы.
13. а) Как показано на рис. 18-16, пара-аминобензоат является компонентом N5,N10-метилентетра- гидрофолата — кофактора, участвующего в переносе одноуглеродных фрагментов, б) В присутствии сульфаниламида, структурного аналога пара-аминобензоата, бактерии не могут синтезировать тетрагидрофолат, который необходим для превращения АIСАR в FАICАR, и в результате происходит накопление АТСАR. в) Конкурентное ингибирование сульфаниламидом фермента, участвующего в биосинтезе тетрагидрофолата, преодолевается в присутствии избытка субстрата (пара-аминобензоата).
14. [14С]Оротат образуется в результате следующей серии реакций (первые три стадии являются частью цикла лимонной кислоты):
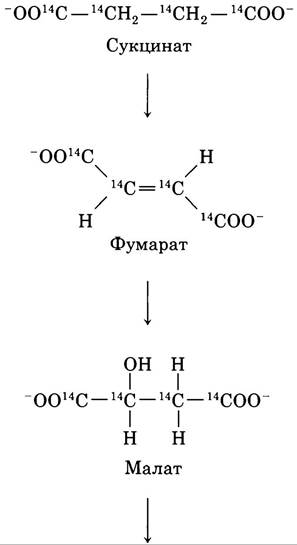
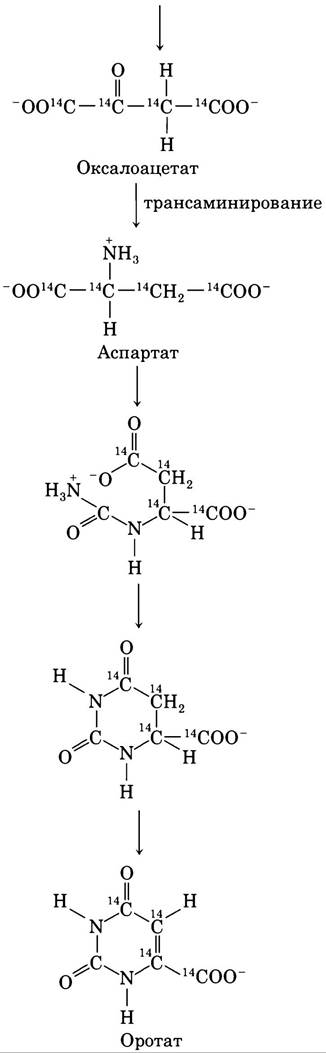
15. Клетки не запасают нуклеотиды, чтобы использовать их в качестве топливных молекул, и не расщепляют их полностью, но только высвобождают основания, которые используются в путях реутилизации. Из-за низкого значения отношения С : N нуклеотиды являются бедным источником энергии.
16. Лечение аллопуринолом приводит к следующим последствиям. (1) Ингибируется превращение гипоксантина в мочевую кислоту, что вызывает накопление гипоксантина, который лучше растворяется в воде и легче выводится из организма. Это смягчает клинические симптомы, связанные с расщеплением АМР. (2) Ингибируется превращение гуанина в мочевую кислоту, что вызывает накопление ксантина, который хуже растворим, чем мочевая кислота. Это и является причиной появления ксантиновых камней. Но поскольку расщепление GMP происходит в меньшем масштабе, чем расщепление АМР, повреждение почек ксантиновыми камнями — меньшее зло, чем подагра.
17. 5-Фосфорибозил-1-пирофосфат; это первый акцептор NH3 на пути биосинтеза пуринов.
18. а) Удаляется α-карбоксильная группа, а к н-атому углерода присоединяется -ОН-группа. б) Последовательность BtrI гомологична последовательности ацилпереносящих белков. Молекулярная масса BtrI увеличивается при инкубации в таких условиях, когда СоА может присоединяться к белкам. Присоединение СоА к остатку Ser приводит к замене -ОН-группы (мол. масса 17) на 4'-фосфопантетеиновую группу (см. рис. 21-5, т. 2) с формулой C11Н21N2O7PS (мол. масса 356). Таким образом, 11 182 - 17 + 356 = 12 151, что очень близко к экспериментально найденному значению Мr = 12 153. в) Тиоэфирная связь может образовываться с α-карбоксильной группой, г) В распространенной реакции удаления α-карбоксила аминокислоты (рис. 18-6, в, т. 2) эта группа свободна. Более того, трудно себе представить реакцию декарбоксилирования, начинающуюся с карбоксильной группы, находящейся в форме тиоэфира. д) 12 240 - 12 281 = 41, что близко к значению Мr для СО2 (44). Поскольку BtrK, скорее всего, является декарбоксилазой, наиболее вероятна следующая структура:
е) 12 370 - 12 240 = 130. При удалении от глутаминовой кислоты (С5Н9NO4, Мr 147) гидроксильной группы (-ОН, 17) в процессе глутамилирования образуется остаток с массой 130. Таким образом, y-глутамилирование изображенной выше молекулы приводит к увеличению ее молекулярной массы на 130. ВtrJ способен осуществлять y-глутамилинование других субстратов, в том числе и представленной выше молекулы. Скорее всего, реакция происходит по свободной аминогруппе и приводит к образованию следующей структуры:
Глава 23
1. Они распознаются двумя типами рецепторов, обычно находящимися в разных типах клеток, и вызывают различные реакции.
2. Стационарная концентрация АТР поддерживается за счет переноса фосфорильной группы от фосфокреатина на ADP. 1-Фтор-2,4-динитробензол ингибирует креатинкиназу.
3. Аммоний чрезвычайно токсичен для нервной ткани, особенно для клеток головного мозга. Избыток NH3 выводится за счет превращения глутамата в глутамин, который переносится в печень и впоследствии превращается в мочевину. Дополнительный глутамин возникает в результате превращения глюкозы в α-кетоглутарат, α-кетоглутарата в глутамат и глутамата в глутамин.
4. Глюкогенные аминокислоты используются в синтезе глюкозы для головного мозга; другие окисляются в митохондриях в цикле лимонной кислоты.
5. Из глюкозы по следующему пути: глюкоза —> дигидроксиацетонфосфат (гликолиз); дигидроксиацетонфосфат + NADH + Н+ —> глицерин-3-фосфат + NAD+ (реакция глицерин-3-фосфатдегидрогеназы).
6. а) Повышенная мышечная активность требует дополнительного АТР, который образуется при усиленном потреблении O2. б) После быстрого бега образовавшийся в анаэробном гликолизе лактат превращается в глюкозу и гликоген, что также требует расхода АТР и, следовательно, O2.
7. Глюкоза — основное топливо мозга. ТРР-зависимое окислительное декарбоксилирование пирувата до ацетил-СоА — обязательная стадия полного метаболизма глюкозы.
8. 190 м
9. а) Инактивация — быстрый способ изменения концентрации гормона, б) Уровень инсулина поддерживается путем выравнивания скоростей его синтеза и расщепления, в) За счет изменения скорости высвобождения из запасных гранул, скорости транспорта и превращения прогормона в активный гормон.
10. Водорастворимые гормоны связываются с рецепторами на внешней поверхности клетки, запуская образование вторичных посредников (таких как сАМР) внутри клетки. Жирорастворимые гормоны проникают через плазматическую мембрану и непосредственно взаимодействуют с молекулами- мишенями или с рецепторами.
11. а) В сердце и скелетных мышцах отсутствует глюкозо-6-фосфатаза. Весь образующийся глюко- зо-6-фосфат направляется по пути гликолиза, а при недостатке кислорода превращается в лактат через пируват. б) При реакции «борьба или бегство» концентрация предшественников гликолиза должна быть высокой, чтобы обеспечить мышечную активность. Фосфорилированные соединения не могут выходить из клетки, поскольку мембрана непроницаема для заряженных молекул, и поэтому глюкозо-6-фосфат не переносится с помощью переносчика глюкозы. Напротив, печень должна высвобождать в кровь глюкозу для ее поддержания на постоянном уровне. Глюкоза образуется из глюкозо-6-фосфата и переносится в кровоток.
12. а) Усиливается захват глюкозы из крови и ее метаболизм в печени, что приводит к гипогликемии; отключается катаболизм аминокислот и жирных кислот, б) Циркулирующих в крови топливных молекул недостаточно для синтеза АТР. Мозг повреждается по той причине, что для него глюкоза — главный источник энергии.
13. Тироксин выступает в роли разобщающего агента в окислительном фосфорилировании. Разобщающие агенты снижают отношение P/О, и для удовлетворения потребностей в АТР ткани усиливают процесс дыхания. Термогенез также может объясняться усиленной утилизацией АТР стимулированной тироксином тканью, поскольку при повышении потребности в АТР усиливается окислительное фосфорилирование и повышается интенсивность дыхания.
14. Поскольку прогормоны неактивны, они могут в необходимом количестве храниться в секреторных гранулах. Быстрая активация прогормонов достигается путем ферментативного расщепления в ответ на соответствующий сигнал.
15. В организме животных глюкоза синтезируется из многих предшественников (см. рис. 1-15). В организме человека основным предшественником глюкозы является глицерин из триацилглицеринов и глюкогенные кислоты из белков.
16. Исходно страдавшая ожирением мышь с генотипом ob/ob начнет худеть, мышь ОВ/ОВ сохранит свой нормальный вес.
17. ИМТ = 39,3. Человектакого роста имеет нормальный показатель ИМТ = 25 при массе тела 75 кг. Следовательно, ему нужно похудеть на 43 кг (95 фунтов).
18. Секреция инсулина понизится. Валиномицин оказывает такое же действие, как открытие К+- каналов, позволяя ионам К+ выходить из клетки, что вызывает гиперполяризацию.
19. Печень не получает сигнал инсулина и, следовательно, продолжает поддерживать высокий уровень глюкозо-6-фосфата и глюконеогенеза, повышая уровень глюкозы крови как при голодании, так и после приема сахаросодержащей пищи. Повышенный уровень глюкозы крови вызывает высвобождение инсулина β-клетками поджелудочной железы, несмотря на высокий уровень инсулина в крови.
20. Следует учесть несколько аспектов. Какова вероятность возникновения сердечных приступов, связанных с приемом препарата. Как эта вероятность соотносится с вероятностью сердечных приступов у людей с хроническими осложнениями диабета 2 типа. Существуют ли столь же эффективные методы лечения, вызывающие меньше нежелательных побочных эффектов.
21. При отсутствии глюкозидазной активности кишечника замедляется всасывание глюкозы из пищевого крахмала и гликогена, что снижает обычный подъем концентрации глюкозы крови после приема пищи. Нерасщепленные олигосахариды ферментируются бактериями в толстой кишке, а выделяющиеся при этом газы вызывают дискомфорт.
22. а) Закрытие АТР-зависимых К+-каналов приводит к деполяризации мембраны и усилению секреции инсулина, б) Диабет 2 типа вязан с понижением чувствительности клеток к инсулину, а не с недостаточным синтезом инсулина. Повышение концентрации циркулирующего инсулина ослабляет симптомы заболевания, в) У больных диабетом 1 типа повреждены (3-клетки поджелудочной железы, поэтому глибурид таким больным не поможет, г) Йод, как и хлор, который иод замещает в меченом глибуриде, — галоген, но его размер больше, и он имеет несколько иные свойства. Поэтому возможно, что иодированный глибурид не связывается с SUR. Если же вместо этого он связывается с другой молекулой, в результате эксперимента будет клонирован ген другого белка, д) Хотя белок очищали, но «очищенный» препарат мог представлять собой смесь нескольких белков, выделяющихся одновременно в одних и тех же экспериментальных условиях. В таком случае аминокислотная последовательность могла бы соответствовать последовательности такого сопутствующего белка. Вероятность этого события исключили с помощью антител, показавших, что данные пептидные последовательности присутствуют в SUR. е) Хотя клонированный ген действительно кодирует 25-аминокислотную последовательность, обнаруженную в SUR, в принципе, возможно, что этот ген кодирует такую же последовательность в другом белке. В таком случае этот другой ген с большой вероятностью должен экспрессироваться в других клетках, чем ген SUR. Эксперименты по гибридизации мРНК доказали, что кДНК предполагаемого гена SUR действительно кодирует SUR. ж) Избыток немеченого глибурида конкурирует с меченым глибуридом за связывание с SUR. В результате наблюдается связывание гораздо меньшего количества меченого глибурида, и поэтому в белке с массой 140 кДа практически не обнаружено радиоактивности, з) В отсутствие избытка немеченого глибурида меченый белок с массой 140 кДа обнаружен только в присутствии предполагаемой кДНК SUR. Избыток немеченого глибурида конкурирует с меченым глибуридом, и меченного 125I 140-кДа белка обнаружено не было. Это показывает, что кДНК кодирует связывающийся с глибуридом белок точно такой же массы, как и SUR — строгое доказательство того, что клонированный ген кодирует белок SUR. и) Возможны дополнительные эксперименты. (1) Осуществить экспрессию кДНК предполагаемого SUR в клетках СНО (клетки яичников китайского хомячка) и показать, что трансформированные клетки обладают активностью ATP-зависимых К+-каналов. (2) Показать, что клетки HIT с мутациями в предполагаемом гене SUR теряют активность АТР-зависимых К+-каналов. (3) Показать, что экспериментальные животные или люди с мутациями в предполагаемом гене SUR не способны секретировать инсулин.
Глава 24
1. 6,1 • 104 нм; в 290 раз длиннее головки фага Т2.
2. Число остатков А не равно числу Т, а число G не равно числу С. Это означает, что эта ДНК не двойная спираль, образованная при спаривании оснований. На самом деле фаг М13 имеет однонитевую ДНК.
3. Мr = 3,8 • 108; длина 200 мкм; Lk0= 55 200; Lk = 51 900.
4. Экзоны содержат 3 п.н./аминокислоту х 192 аминокислоты = 576 п. н. Оставшиеся 864 п. н. составляют последовательности интронов, возможно, лидирующую или сигнальную последовательность, а также другие некодирующие участки ДНК.
5. 5000 п. н. а) Не изменяется; Lk не может изменяться без разрыва одних и образования других ковалентных связей в ДНК. б) Становится неопределенной. По определению кольцевая ДНК с разрывом в одной нити не имеет Lk. в) Снижается. В присутствии АТР гираза раскручивает ДНК. г) Не изменяется, если при нагревании в нитях ДНК не произошло разрывов.
6. Чтобы Lk не изменилось, топоизомераза должна вводить одинаковое число положительных и отрицательных витков.
7. σ = -0,067; вероятность >70%.
8. а) Неопределенное; нити никированной ДНК могут быть разъединены и, следовательно, не имеют Lk. б) 476; в) 476; ДНК уже релаксирована, так что топоизомераза не вызывает никаких изменений, г) 460; каждое действие ДНК-гиразы в присутствии АТР снижает Lk на две единицы, д) 464; эукариотическая топоизомераза I повышает Lk слабо закрученной или имеющей отрицательные супервитки ДНК на одну единицу, е) 460; связывание с нуклео- сомой не приводит к разрыву нитей ДНК и поэтому не влияет на значение Lk.
9. Основная структурная единица хроматина повторяется примерно каждые 200 п. н; ДНК доступна для нуклеазы только через интервалы 200 п. н. Краткой обработки недостаточно для расщепления ДНК во всех доступных точках, поэтому возникает лестница фрагментов ДНК, масса которых кратна 200 п. н. Толщина полос ДНК говорит о некоторой вариабельности расстояний между участками расщепления. Например, не все фрагменты в самой нижней полосе имеют размер точно 200 п. н.
10. Правая спираль характеризуется положительным значением Lk, левая спираль (как в Z-ДНК) - отрицательным значением. Снижение Lk замкнутой кольцевой B-ДНК путем введения отрицательных витков облегчает образование участков Z-ДНК в некоторых последовательностях. (О последовательностях, способствующих образованию Z-ДНК, говорится в гл. 8.)
11. а) Обе нити должны быть замкнуты ковалентными связями в кольцо, либо ограничены на концах каким-либо другим образом, б) Образование крестообразных структур, левозакрученной Z-ДНК, плектонемических или соленоидальных структур, а также раскрученных молекул ДНК. в) Топоизомераза II или ДНК-гираза Е. coli, г) Фермент связывается с ДНК в точках пересечения двунитевой последовательности, расщепляет обе нити одного из пересекающихся сегментов, протягивает другой сегмент через разрыв, а затем зашивает разрыв. В результате значение Lk уменьшается на 2.
12. Центромера, теломеры и автономно реплицирующиеся последовательности или точка начала репликации.
13. Бактериальный нуклеоид организован в виде доменов длиной примерно по 10 000 п. н. Расщепление рестриктазой приводит к релаксации ДНК внутри домена, но не за его пределами. Это повлияет на экспрессию всех генов домена, зависящую от топологии ДНК, но не на гены в других доменах.
14. а) При соединении концов ДНК с образованием замкнутого релаксированного кольца, некоторые типы ДНК полностью релаксированы, тогда как другие все же имеют некоторое количество левых или правых витков. Это и объясняет распределение топоизомеров относительно наиболее расслабленной формы, б) Положительная суперспираль. в) ДНК, находящаяся в релаксированном состоянии даже при добавлении красителя, имеет разрыв в одной или в обеих нитях. В ходе выделения кольцевой ДНК в некоторых молекулах неизбежно появляется некоторое количество разрывов. г) Примерно -0,05. Это значение определяется просто путем сравнения нативной ДНК с образцами с известным значением σ. На обоих гелях нативная ДНК движется ближе всего к образцу с σ = -0,049.
15. а) При нерасхождении хромосом одна дочерняя клетка и все ее потомство имеют две копии синтетической хромосомы и окрашены в белый цвет. Другая дочерняя клетка и ее потомство не имеют копии синтетической хромосомы и окрашены в красный цвет. Поэтому половина колонии белая, а половина красная, б) При потере хромосомы одна дочерняя клетка и ее потомство имеют одну копию синтетической хромосомы и окрашены в розовый цвет. Другая дочерняя клетка и ее потомство не имеют копии синтетической хромосомы и окрашены в красный цвет. В результате получаются красно-розовые колонии, в) Функциональная центромера должна иметь размер менее 0,63 т. п. н., поскольку все фрагменты больше этого размера более стабильны при митозе, г) Теломеры нужны для полной репликации линейных молекул ДНК, кольцевая ДНК может реплицироваться без них. д) Чем крупнее хромосома, тем точнее осуществляется процесс сегрегации. Однако представленные данные не указывают ни на минимальный размер, ниже которого синтетическая хромосома полностью нестабильна, ни на максимальный размер, выше которого стабильность уже не меняется. е) Нормальные хромосомы.
Как показывает график, даже если бы синтетические хромосомы имели такую же длину, как нормальные дрожжевые хромосомы, они не были бы такими же стабильными. Это означает, что на стабильность хромосом влияют еще какие-то другие, пока неизвестные факторы.
Глава 25
1. При случайной, «дисперсионной» репликации во втором поколении вся ДНК должна была бы иметь одинаковую плотность и появляться в виде единой полосы, а не двух полос, которые наблюдали Мезельсон и Сталь.
2. В этом продолжении эксперимента Мезельсона- Сталя после трех клеточных делений соотношение 15N-14N ДНК к 14N-14N ДНК составляет 2/6 = 0,33.
3. а) 4,42 • 105 оборотов; б) 40 минут. В клетках, делящихся каждые 20 минут, цикл репликации начинается каждые 20 минут, так что каждый следующий цикл начинается до того, как завершится предыдущий. в) от 2000 до 5000 фрагментов Оказаки. Эти фрагменты имеют длину от 1000 до 2000 нуклеотидов и прочно связаны с матрицей путем спаривания оснований. Каждый синтезированный фрагмент быстро присоединяется к отстающей нити, что обеспечивает правильный порядок фрагментов.
4. А 28,7%, G 21,3%, С 21,3%, Т 27 = 8,7%. Нить ДНК, синтезированная на матричной нити: А 32,7%, в 18,5%, С 24,1%, Т 24,7%; нить ДНК, синтезированная на основе комплементарной нити: А 24,7%, G 24,1%, С 18,5%, Т 32,7%. Предполагается, что обе матричные нити реплицировались полностью
5. а) Нет. Включение метки 32Р в ДНК происходит в результате синтеза новой ДНК, что возможно только в присутствии всех четырех предшественников, б) Да. Хотя для синтеза ДНК необходимы все четыре нуклеотидных предшественника, чтобы метка включилась в новую ДНК, радиоактивным должен быть лишь один из них. в) Нет. Радиоактивность включается в ДНК лишь в том случае, если метка 32Р содержится в α-фосфатной группе, поскольку ДНК-полимераза отщепляет пирофосфат, т. е. β- и y-фосфатные группы.
6. Механизм 1: 3'-ОН присоединяющегося dNTР атакует α-фосфат трифосфата на 5'-конце растущей нити ДНК, вытесняя пирофосфат. Механизм использует нормальные dNТР, и растущая цепь ДНК всегда имеет трифосфат на 5'-конце.
Механизм 2: Здесь используются предшественники нового типа — нуклеотид-3'-трифосфаты. На растущем конце цепи ДНК имеется 5'-ОН-группа, которая атакует α-фосфат следующего дезоксинуклеотид-3'- фосфата, вытесняя пирофосфат. Обратите внимание, что для этого механизма требуется эволюция новых метаболических путей, обеспечивающих синтез новых дезоксинуклеотид-3'-трифосфатов.
7. Лидирующая нить: предшественники: dATP, aGTP, dCTP, dTTP (а также матрица ДНК и ДНК- праймер); ферменты и другие белки: ДНК-гираза, геликаза, белок, связывающий однонитевую ДНК, ДНК-полимераза III, топоизомеразы и пирофосфатаза. Отстающая нить: предшественники: ATP, GTP, СТР, UTP, dATP, dGTP, dCTP, dTTP (а также РНК-праймер); ферменты и другие белки: ДНК-гираза, геликаза, белок, связывающий однонитевую ДНК, праймаза, ДНК-полимераза III, ДНК-полимераза I, лигаза, топоизомеразы и пирофосфатаза. ДНК-лигаза в качестве кофактора использует NAD+.
8. Мутанты с дефектной ДНК-лигазой образуют ДНК-дуплекс, в котором одна из нитей остается в виде отдельных фрагментов (фрагментов Оказаки). При денатурации такого дуплекса с последующей седиментацией получается одна фракция, содержащая интактную нить ДНК (полоса с большой молекулярной массой), и вторая фракция, содержащая отдельные фрагменты (низкомолекулярная полоса).
9. Уотсон-криковское спаривание оснований между матрицей и лидирующей нитью; проверка и удаление неправильно встроенных нуклеотидов под действием 3'-экзонуклеазной активности ДНК- полимеразы III. Да, это возможно. Поскольку механизмы, обеспечивающие точность репликации, функционируют как для лидирующей, так и для отстающей цепи, отстающая цепь может, в принципе, собираться с такой же точностью. Однако большое число химических реакций при биосинтезе этой цепи может быть дополнительным источником ошибок.
10. -1200 п. н. (600 п. н. в каждом направлении).
11. Небольшая часть (13 из 109 клеток) ауксотрофных по гистидину мутантов переживают спонтанную обратную мутацию и вновь приобретают способность синтезировать гистидин. 2-Аминоантрацен повышает вероятность таких мутаций примерно в 1800 раз и, следовательно, является мутагеном. Большинство канцерогенных веществ являются мутагенами, так что 2-аминоантрацен также может быть канцерогеном.
12. Спонтанное дезаминирование 5-метилцитозина (см. т. 1, с. 395) приводит к образованию тимина и аномальной пары G-Т. Это одна из самых распространенных ошибок в эукариотической ДНК. Специализированная система репарации находит дефект и восстанавливает пары G = C.
13. а) Ультрафиолетовое облучение приводит к образованию пиримидиновых димеров. В нормальных фибробластах они удаляются путем вырезания фрагмента поврежденной нити с помощью специального фермента. Поэтому денатурированная однонитевая ДНК состоит из множества фрагментов, образовавшихся в результате такого расщепления, и средняя молекулярная масса этой ДНК меньше. В ДНК больных пигментной ксеродермой такие фрагменты отсутствуют и средняя молекулярная масса ДНК не изменяется, б) Отсутствие фрагментов однонитевой ДНК в клетках больных после УФ-облучения свидетельствует о дефекте или об отсутствии специфической эксцизионной нуклеазы.
14. При гомологичной генетической рекомбинации между парами гомологичных хромосом практически в любых местах могут образовываться структуры Холлидея, и точка ветвления может мигрировать на достаточно большое расстояние. При сайт-специфической рекомбинации структуры Холлидея образуются между двумя специфическими участками, и миграция ветви обычно ограничена гетерологичными последовательностями по обе стороны от участка рекомбинации.
15. При наступлении момента в ходе репликации, когда один сайт рекомбинации уже реплицировался, а другой еще нет, происходит сайт-специфическая рекомбинация, сопровождающаяся изменением направления движения репликативных вилок. Вилки движутся друг за другом по кольцу ДНК, создавая множество тандемных копий плазмиды. Такое мультимерное кольцо может быть разделено на мономеры в результате дополнительных раундов сайт-специфической рекомбинации.
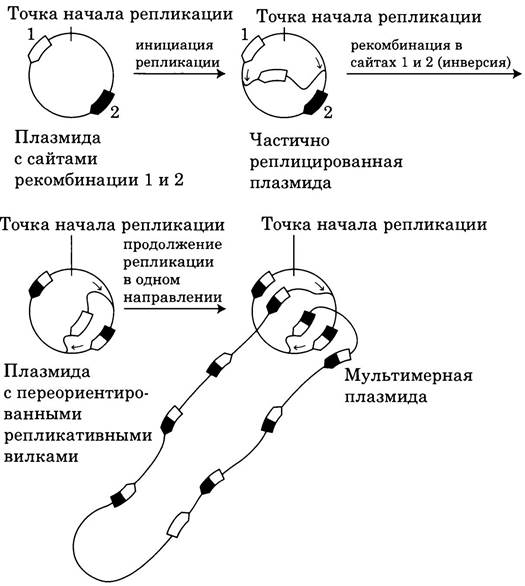
16. а) Фоновые мутации происходят даже без добавления мутагена - под воздействием радиации, химических процессов в клетке и других событий, б) При значительном поражении клеточной ДНК нарушается функция продуктов многих генов, и клетка становится нежизнеспособной, в) Клетки с ослабленной системой репарации ДНК более чувствительны к действию мутагенов. Поскольку клетки uvr- хуже справляются с репарацией повреждений, вызванных воздействием 117000, в них выше частота мутаций, в том числе летальных, г) В штамме uvr+ система эксцизионной репарации удаляет основания ДНК со связанным [3Н] R7000, снижая содержание 3Н в этих клетках. В штамме uvr- репарация не происходит, и уровень 3Н постепенно повышается по мере взаимодействия [3Н] К.7000 с ДНК. д) Все перечисленные в таблице мутации, за исключением замены А = Т на G = С, значительно учащаются по сравнению с фоном. Мутация каждого типа вызвана особым взаимодействием между 117000 и ДНК. Поскольку не все эти взаимодействия равновероятны (из-за различий в реакционной способности, стерических ограничений и др.), мутации возникают с разной частотой, е) Нет, только те, что начинаются с пары G = С. Таким образом, замены А = Т на С = G и А = Т на Т = А вызваны связыванием 117000 с А или с Т. ж) R7000-G образует пару с А. Сначала R7000 связывается с G = С с образованием R7000-G = 0. (Сравните с тем, что происходит с СН3-G на рис. 25-28, б, т. з). Если не происходит репарации, одна нить реплицируется как R7000-G = А, что в результате репарации превращается в Т = А. Другая нить сохраняется неизменной. Если в результате репликации образуется R7000-G = Т, то тот же самый путь приводит к паре А = Т. з) Нет. Сравните данные двух таблиц, не забывая о том, что разные мутации происходят с разной частотой.
А = Т на С = G: умеренная в обоих случаях, но в штамме uvr+ репарация эффективнее
G = С на А = Т: умеренная в обоих случаях, без заметной разницы
G = С на С = G: выше в штамме uvr+, безусловно, репарация менее эффективна!
G = С на Т = А: высокая в обоих случаях, без заметной разницы
А = Т на Т = А: высокая в обоих случаях, без заметной разницы
А = Т на G = С: низкая в обоих случаях, без заметной разницы
Некоторые аддукты эффективнее распознаются системой репарации, чем другие, и поэтому удаляются быстрее и приводят к меньшему числу мутаций.
Глава 26
1. а) от 60 до 100 с; б) от 500 до 900 нуклеотидов
2. Ошибка в единственном основании при репликации ДНК приведет к тому, что одна из дочерних клеток и все ее потомство будут иметь мутированную хромосому. Ошибка в единственном основании при транскрипции РНК не влияет на хромосомы, но может привести к синтезу дефектной копии белка. Но поскольку оборот мPHК осуществляется достаточно быстро, большинство копий белка этого дефекта иметь не будут, и потомство этой клетки будет нормальным.
3. Блокируется или ингибируется посттранскрипционный процессинг 3'-конца (расщепление и полиаденилирование).
4. Поскольку матричная РНК не кодирует ферменты, необходимые для инициации вирусной инфекции, она, скорее всего, окажется инертной или просто расщепится клеточными рибонуклеазами. Репликация этой РНК и распространение вируса возможно лишь в том случае, если в клетки вместе с матричной РНК ввести интактную РНК- репликазу (РНК-зависимую РНК-полимеразу).
5. (1) В качестве матрицы используют последовательность нуклеиновой кислоты; (2) синтез происходит в направлении 5' —> 3'; (3) в качестве субстратов используют нуклеозидтрифосфаты и образуют фосфодиэфирные связи с вытеснением РРi. Полинуклеотидфосфатаза образует фосфодиэфирные связи, но отличается от остальных ферментов по всем остальным пунктам.
6. Обычно две: одна для расщепления фосфодиэфирной связи на одном стыке интрона и экзона, а вторая — для связывания освободившегося конца экзона с экзоном с другой стороны от интрона. Если в качестве нуклеофила в первой реакции выступает молекула воды — это стадия гидролиза, и тогда для осуществления сплайсинга требуется лишь одна реакция трансэтерификации.
7. В интронах закодированы многие мякРНК, необходимые для модификаций рРНК. Если не происходит сплайсинга, мякРНК не образуются.
8. Эти ферменты не имеют корректирующей 3' —> 5'-экзонуклеазной активности и поэтому допускают значительное количество ошибок. При этом вероятность ошибок при репликации, приводящих к инактивации вируса, в маленьком геноме намного ниже, чем в большом.
9. а) 432 = 1,8 • 1019; б) 0,006%; в) Для осуществления «неестественного отбора» используйте хроматографическую смолу со связанными молекулами, которые представляют собой аналоги переходного состояния в реакции гидролиза сложного эфира (например, подходящий фосфонат; см. Дополнение 6-3).
10. α-Аманитин останавливает синтез РНК, и когда через несколько дней все существующие молекулы мРНК и белков в печени расщепляются, возникает дисфункция печени и наступает смерть.
11. а) После лизиса клеток и частичной очистки белковый экстракт следует подвергнуть изоэлектрическому фокусированию. Для идентификации β-субъединицы можно использовать антитела. Различие в аминокислотных последовательностях нормальной β-субъединицы и мутантной формы (а именно разные заряды аминокислотных остатков) отразится на электрофоретической подвижности белков в геле, б) Прямое секвенирование ДНК (по Сенгеру).
12. а) 384 п. н.; б) 1620 п. н.; в) Большинство нуклеотидов расположено в нетранслируемых участках на 3'- и 5'-концах мРНК. Кроме того, значительная часть мРНК кодирует сигнальную последовательность (гл. 27) белков, которая в конечном итоге отщепляется при формировании зрелого функционального белка.
13. а) кДНК синтезируется в процессе обратной транскрипции мРНК; таким образом, мРНК, по- видимому, имела последовательность CGG. Поскольку геномная ДНК, на основе которой синтезирована мРНК, имела последовательность CAG, первичный транскрипт, вероятно, имел последовательность CAG, а в процессе посттранскрипционной модификации превратился в CGG. б) Нередактированная последовательность мРНК совпадает с последовательностью ДНК (за исключением замены Т на U). Нередактированная последовательность мРНК имела следующий вид (* указывает место редактирования):
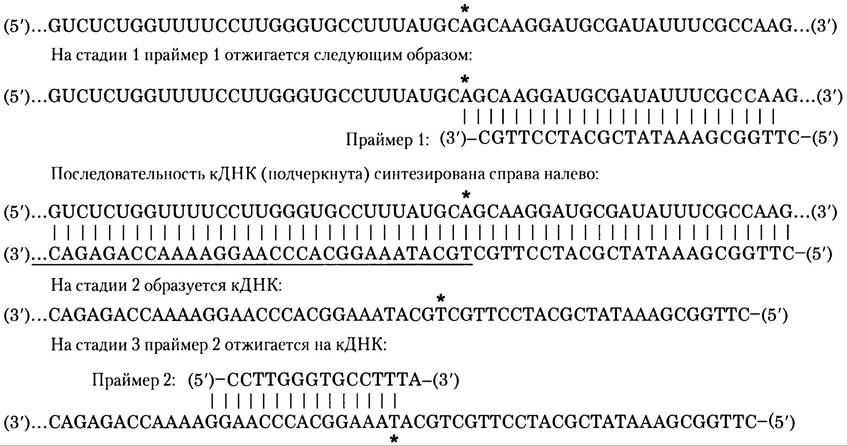

В результате образуется продукт, состоящий из 22 нуклеотидов. в) Факторы, нарушающие функцию белка (протеазы, тепло), ингибируют редакционный процесс, а те, что не влияют на функцию белков (нуклеазы), практически никакого действия не оказывают. Основной недочет этого аргумента заключается в том, что факторы, нарушающие функцию белка, не вызвали полной остановки редактирования. Возможно, некоторое редактирование или расщепление мРНК происходит даже без фермента или какая-то часть фермента сохранила свою активность, г) В полинуклеотиды включается только α-фосфат NTP. Если бы исследователи использовали другие типы [32P]NTP, не было бы меченых продуктов, д) Поскольку модификация затрагивает только основание А, нас интересует только судьба всех А в последовательности, е) Поскольку метка содержалась только в АТР, при удалении целого нуклеотида из мРНК исчезла бы вся радиоактивность, и на хроматографической пластинке был бы обнаружен лишь немодифицированный [32Р]АМР. ж) Если бы основание было удалено или заменено на другое, исследователи обнаружили бы только [3Н]АМР. Наличие [3Н] IМР указывает, что произошла замена А на I без удаления Н в положениях 2 и 8. Наиболее вероятным механизмом модификации при замене А на I является гидролитическое дезаминирование (см. рис. 22-34). з) CAG меняется на CIG. Этот кодон читается как CGG.
Глава 27
1. a) Gly-Gln-Ser-Leu-Leu-Ile; б) Leu-Asp-Ala-Pro; в) His-Asp-Ala-Cys-Cys-Tyr; г) Met-Asp-Glu у эукариот; fMet-Asp-Glu у бактерий.
2. UUAAUGUAU, UUGAUGUAU, CUUAUGUAU, CUCAUGUAU, CUAAUGUAU, CUGAUGUAU, UUAAUGUAC, UUGAUGUAC, CUUAUGUAC, CUCAUGUAC, CUAAUGUAC, CUGAUGUAC
3. Нельзя. Почти все аминокислоты кодируются несколькими кодонами (например, существует шесть вариантов кодонов для лейцина), и поэтому каждый полипептид может быть закодирован несколькими способами. И все же для некоторых аминокислот существует лишь один кодон. Кроме того, несколько кодонов, кодирующих одну аминокислоту, часто имеют одни и те же нуклеотиды в двух из трех позиций. Таким образом, некоторые участки последовательности мРНК, кодирующие белки с известной аминокислотной последовательностью, можно определить с достаточно высокой точностью.
4. a) (5') CGACGGCGCGAAGUСAGGGGUGUUAAG (3'); б) Arg-Arg-Arg-Glu-Val-Arg-Gly-Val-Lys; в) Нет. Комплементарные антипараллельные нити в двойной спирали ДНК не идентичны в направлении 5' —> 3'. Из дуплекса РНК считывается лишь с одной конкретной нити. РНК-полимераза узнает только «правильную» нить и связывается с ней.
5. Для переноса метионина существует два типа молекул тРНК: тРНКfМet инициирующая синтез, и TpHKMet, которая может встраивать остаток Met внутри полипептидной цепи. Только fMet-TPHKtMet распознается инициаторным фактором IF-2 и подходит к инициаторному кодону AUG, находящемуся в P-сайте рибосомы в инициаторном комплексе. Кодоны AUG внутри последовательности мРНК могут связывать только Met-TPHKMet.
6. Взять смесь UDP и UDC, скажем, в соотношении 5 : 1 и подействовать на нее полинуклеотидфосфорилазой. В результате должен получиться полимер, содержащий много триплетов UUU (Phe), меньше UUC (Phe), UCU (Ser) и CUU (Leu), значительно меньше UCC (Ser), CUC (Leu) и CCU (Pro) и совсем мало ССС (Pro).
7. Минимум 583 эквивалента АТР (по 4 на каждую присоединенную аминокислоту, но с учетом того, что происходит лишь 145 транслокаций). Для исправления каждой ошибки нужно 2 эквивалента АТР. Для синтеза гликогена нужно 292 эквивалента АТР. Дополнительная энергия, затрачиваемая на синтез β-глобина, отражает стоимость информационного содержания белка. Для синтеза белка из аминокислот клетке потребуется как минимум 20 активирующих ферментов, 70 рибосомных белков, 4 рРНК, 32 или более тРНК, одна молекула мРНК и 10 или более вспомогательных ферментов. В синтезе цепи (α1 —> 4)-гликогена из глюкозы участвуют лишь 4 или 5 ферментов (гл. 15).
8.
Кодоны глицина |
Антикодоны |
(5') GGU |
(5') ACC, GCC, ICC |
(5') GGC |
(5') GCC, ICC |
(5') GGA |
(5') UCC, ICC |
(5') GGG |
(5') CCC, UCC |
а) 3'-концевой и средний; б) спаривание с антикодонами (5’) GCC, ICC и UCC; в) в парах с антикодонами (5’) АСС и ССС.
9. Только (а), (в), (д) и (ж); (б), (г) и (е) не могут быть результатом однонуклеотидной замены: для (б) и (е) требуется замена двух нуклеотидов, а для (г) — замена всех трех нуклеотидов.
10. Для Glu существует два кодона (GAA и GAG), а для Val - четыре кодона (GTT, GTC, СТА и GTG). Однонуклеотидная замена GAA на GTA или GAG на GTG могла бы привести к замене Glu на Val в серповидном гемоглобине. Гораздо менее вероятны замены двух нуклеотидов: превращение GAA в GTG, GTT и GTC или превращение GAG в GTA, GTT и GTC.
11. Изолейцин по структуре напоминает некоторые другие аминокислоты, особенно валин. Чтобы отличить изолейцин он валина в процессе аминоацилирования, нужен второй этап проверки. Гистидин не похож ни на какую другую аминокислоту, и его структура обеспечивает достаточную специфичность аминоацилирования и связывания тРНК.
12. а) Аlа-тРНК-синтетаза распознает пару G3-U70 в аминокислотном плече тРНКАlа. б) Мутантная тРНКА|а будет вставлять остаток Ala при встрече с кодонами для Pro. в) Аналогичные последствия могла бы вызвать мутация тРНКРrо, в результате которой она стала бы распознаваться и аминоацилироваться Ala-тРНК-синтетазой. г) Такие мутации вызвали бы инактивацию множества клеточных белков и привели бы к летальным последствиям для клетки. Этот пример отражает мощь естественного отбора, препятствующего изменениям генетического кода.
13. Лишь последняя присоединенная к полипептидной цепи аминокислота сохраняет ковалентную связь с тРНК, и, следовательно, она является единственным связующим звеном между полипептидом и кодирующей его мРНК. Исправление ошибки потребовало бы разрыва этой связи и привело бы к отрыву пептида от мРНК и преждевременной остановке синтеза.
14. Белок был бы доставлен в ЭР, а его дальнейший путь зависел бы от дополнительных сигналов. SRP связывается с N-концевой сигнальной последовательностью на ранних стадиях синтеза полипептида и направляет его вместе с рибосомой к рецепторам на ЭР. После синтеза белок переносится в просвет ЭР, так что NLS недоступна для белков, ответственных за транспортировку в ядро.
15. Триггерный фактор — это молекулярный шаперон, стабилизирующий несформированную и готовую к транслокации форму РrоОmрА.
16. ДНК должна содержать не менее 5784 нуклеотидов; некоторые кодирующие последовательности вложены друг в друга или перекрываются.
17. а) Спирали удерживаются вместе за счет гидрофобных и ван-дер-ваальсовых взаимодействий, б) R-группы 3, 6, 7 и 10 выступают слева, группы 1, 2, 4, 5, 8 и 9 — справа, в) Одна из возможных последовательностей следующая:
![]()
г) Возможная последовательность ДНК-дуплекса для этой аминокислотной последовательности:

д) Phe, Leu, Ile, Met и Val. Все они гидрофобные, но это не все гидрофобные аминокислоты - здесь не хватает Trp, Pro, Ala и Gly. е) Туг, His, Gin, Asn, Lys, Asp и Glu; все они гидрофильные, но Туг меньше остальных. Однако это не все гидрофильные аминокислоты — здесь не хватает Ser, Thr и Arg. ж) Отсутствие в смеси Т позволяет исключить кодоны, начинающиеся или заканчивающиеся на Т, т. е. исключить Туr, который обладает слабой гидрофильностью, и, что более важно, исключить два стоп-кодона — ТАА и TAG. Никакие другие аминокислоты при этом из набора NAN не исключаются. з) Неправильно свернутые белки обычно уничтожаются. Поэтому, если на основе синтетического гена синтезируется белок, который при электрофорезе формирует полосу с определенной молекулярной массой, скорее всего, этот белок правильно свернут, е) Сворачивание белка определяется не только водородными связями и ван-дер-ваальсовыми взаимодействиями. Есть множество причин, почему синтезированный на основе случайной нуклеотидной последовательности белок мог бы не сформировать четырехспиральную структуру. Например, структура изменилась бы при наличии водородных связей между гидрофильными боковыми цепями. Кроме того, не все последовательности имеют тенденцию образовывать α-спирали.
Глава 28
1. а) Уровень триптофансинтазы остается высоким, несмотря на присутствие триптофана, б) Уровень высокий, в) Уровень быстро снижается, предотвращая синтез дополнительного триптофана.
2. а) Конститутивная, слабая экспрессия оперона; большинство мутаций в операторе с большой вероятностью предотвращает связывание репрессора, б) Либо конститутивная экспрессия, как в (а), либо постоянная репрессия, если в результате мутации нарушена способность связывать лактозу и родственные вещества и, следовательно, отвечать на присутствие индуктора, г) Повышение или снижение экспрессии оперона (в условиях индукции) в зависимости от того, стал ли промотор в результате мутации больше или меньше похож на консенсусный промотор Е. coli.
3. 7000 копий.
4. 8 • 10-9 М, более чем в 103 выше константы диссоциации. При наличии в клетке 10 копий активного репрессора сайт связывания репрессора на операторе всегда занят.
5. (а)-(д): При всех условиях экспрессия генов lac- оперона снижается.
6. а) Ослабление аттенюации транскрипции. Рибосома, заканчивающая транскрипцию последовательности 1, больше не экранирует последовательность 2 и не блокирует ее транскрипцию. Последовательность 2 всегда доступна для спаривания с последовательностью 3, что предотвращает образование аттенюатора, б) Усиление аттенюации транскрипции. Последовательность 2 менее эффективно связывается с последовательностью 3; аттенюаторы образуются чаще, даже если последовательность 2 не блокирована рибосомой, в) Аттенюация отсутствует; единственный механизм регуляции обеспечивается репрессором Тrр. г) Аттенюация перестает зависеть от тРНК триптофана и может стать зависимой от тРНК гистидина, д) Аттенюация происходит редко или не происходит вовсе. Последовательности 2 и 3 постоянно блокируют образование аттенюатора, е) Постоянная аттенюация транскрипции. Аттенюатор образуется всегда, независимо от наличия триптофана.
7. SOS-ответ не индуцируется, что делает клетку более чувствительной к повреждениям ДНК.
8. Каждая клетка бактерии имела бы жгутики, состоящие из флагеллина обоих типов, и была бы чувствительна к антителам, которые вырабатываются в ответ на оба типа белка.
9. Возможно, в процессе очистки полимеразы были потеряны необходимые для активности фермента диссоциируемые факторы (например, фактор специфичности, аналогичный σ-субъединице фермента Е. coli).
10.
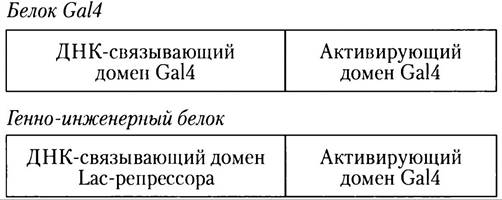
Генно-инженерный белок не может связываться с участком связывания Gal4 в гене GAL (UASG), поскольку он не имеет ДНК-связывающего домена Gal4. Нужно таким образом модифицировать последовательность ДНК, с которой связывается Gal4p, чтобы она приобрела нуклеотидную последовательность, с которой обычно связывается Lac-peпpeccop (используя методы, описанные в гл. 9).
11. Метиламин; реакция включает атаку воды на углерод гуанидиновой группы в модифицированном аргинине.
12. Необходимая для развития яйца bcd-мРНК обеспечивается матерью. Яйцо нормально развивается даже в том случае, если оно имеет генотип bcd-/bcd-, при условии, что мать имеет один нормальный ген bcd, а аллель bcd- является рецессивной. Однако взрослая женская особь с генотипом bcd- /bcd- стерильна, поскольку у нее нет нормальной копии bcd для передачи собственному потомству.
13. а) Водородные связи образуются между белком и скелетом ДНК в позициях ДНК А106, А110, А118, Т119 и Т122, а также между белком и основаниями в позициях А106, Т107, А118 и Т119. Четыре последних нуклеотида непосредственно участвуют в распознавании последовательности ДНК. б) Скелет ДНК: А106-Arg290, A110-Ser212, A119-Arg199, T119-Arg204, A122-Ser303. Основания ДНК: А106- Asn253, T107-Asn253, A118-Asn163, T119-Asn163. Asn, Glu, Gin, Lys и Arg очень часто образуют водородные связи с ДНК. В образовании водородных связей ТАТА-связывающим белком в основном задействованы остатки Arg и Asn.
в) ТАТАТАТА (остатки 103-110)
АТАТАТАТ (остатки 122-115)
ТАТА-связывающий белок узнает А106, Т107/Т119 и А118.
г) Гидрофобные взаимодействия очень многочисленны, многие из них происходят с участием гидрофобных поверхностей.
14. а) Для экспрессии 10% (репрессии 90%) 10% репрессора должно связаться с индуктором, а 90% находится в свободном виде и может связываться с оператором. Воспользуемся уравнением 5-8 при
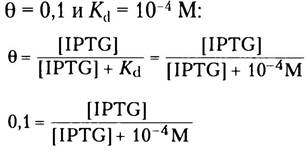
так что
0,9[IРТG] = 10-5 или [IРТG] = 1,1 • 10-5М
Для экспрессии 90% с индуктором должно быть связано 90% репрессора, так что θ = 0,9. Подставляя в уравнение 5-8 значения θ и Кd, получаем [IРТG] = 9 • 10-4 М. Таким образом, при изменении [IРТG] примерно в 10 раз уровень экспрессии также изменяется примерно в 10 раз. б) Уровень белков до индукции низкий, он повышается в процессе индукции и уменьшается при прекращении синтеза и расщеплении белков, в) Как следует из пункта (а), экспрессия laс-оперона не просто включается или выключается, следовательно, оперон не удовлетворяет характеристике А. Как следует из пункта (б), экспрессия laс-оперона ослабевает при удалении индуктора; следовательно, оперон не удовлетворяет характеристике Б. г) GFP включен: уровень экспрессии repts и GFP высокий; repts подавляет ОРλ, так что LacI не синтезируется. GFP выключек, уровень экспрессии LacI высокий; LacI подавляет ОРlac, так что repts и GFP не синтезируются. д) Добавление IPTG переключает систему из состояния «GFP выключен» в состояние «GFP включен». IPTG действует только в присутствии LacI, поэтому он влияет только на состояние «GFP выключен». Добавление IPTG отменяет репрессию ОРlас и приводит к повышению уровня экспрессии repts, что выключает экспрессию LacI и повышает экспрессию GFP. е) Повышение температуры переводит систему из состояния «GFP включен» в состояние «GFP выключен». Тепло оказывает влияние только в присутствии repts, т. е. только в состоянии «GFP включен». Тепло инактивирует repls и отменяет репрессию ОР, что приводит к высокому уровню экспрессии LacI. Затем LacI действует на ОРlас, подавляя синтез repts и GFP. ж) Характеристика А: система нестабильна в промежуточном состоянии. В какой-то момент один репрессор оказывает более сильное влияние, чем другой, просто при случайных флуктуациях экспрессии. Это отключает экспрессию второго репрессора и фиксирует систему в одном из состояний. Характеристика Б: экспрессия одного репрессора подавляет синтез другого, поэтому система остается в одном и том же состоянии даже после удаления переключающих стимулов. з) Ни в какой момент времени ни одна клетка не демонстрировала промежуточного уровня экспрессии GFP, что подтверждает характеристику А. При промежуточной концентрации индуктора (X) некоторые клетки перешли в состояние «GFP включен», а другие еще нет и находятся в состоянии «GFP выключен». Никакого промежуточного состояния не существует. Бимодальный характер экспрессии при [IPTG] = X вызван одновременным присутствием в смеси клеток в состоянии «GFP включен» и клеток в состоянии «GFP выключен».