ОСНОВЫ БИОХИМИИ ЛЕНИНДЖЕРА - ТОМ 3. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ - 2017
ЧАСТЬ III. ПУТИ ПЕРЕДАЧИ ИНФОРМАЦИИ
25. МЕТАБОЛИЗМ ДНК
25.2. Репарация ДНК
Большинство клеток содержит только одинарный или двойной набор геномной ДНК. Поврежденные белки и молекулы РНК могут быстро заменяться новыми благодаря информации, закодированной в ДНК. но сами молекулы ДНК заменяться не могут. Поддержание целостности информации в ДНК — важнейшая задача клетки, осуществляемая с помощью сложного набора систем репарации ДНК. ДНК может разрушиться в результате разных процессов; некоторые из них спонтанны, другие катализируются факторами внешней среды (см. гл. 8 в т. 1). Даже сам процесс репликации может иногда искажать содержащуюся в ДНК информацию, если в результате ошибки образуются неправильные пары оснований (например, пара G-T).
Химия повреждений ДНК разнообразна и сложна. Клеточный ответ на конкретное повреждение связан с активностью широкого круга ферментных систем, катализирующих одни из наиболее интересных химических трансформаций в метаболизме ДНК. Сначала мы рассмотрим последствия изменений в последовательности ДНК, а затем специфические системы репарации.
Онкологические заболевания связаны с мутациями
Лучший способ проиллюстрировать значение репарации ДНК — рассмотреть последствия неисправленных повреждений. Наиболее опасны такие изменения ДНК, которые в результате репликации и передачи новым поколениям клеток становятся постоянными. Стабильное изменение нуклеотидной последовательности ДНК называется мутацией. Мутации могут выражаться в замене одной пары оснований на другую (однонуклеотидные замены) или же происходит вставка и выпадение одной или нескольких пар оснований (инсерции и делеции). Если мутация затрагивает несущественный участок ДНК или не имеет принципиального значения для работы гена, ее называют молчащей мутацией. Изредка мутации обеспечивают своему хозяину биологическое преимущество. Однако в большинстве случаев проявляющиеся мутации являются нейтральными или вредоносными.
У млекопитающих наблюдается четкая корреляция между накоплением мутаций и раком. В ходе простого теста, разработанного Брюсом Эймсом, можно выявить способность химического соединения вызывать определенные легко выявляемые мутации в специальных бактериальных штаммах (рис. 25-21). Согласно этому тесту, совсем немногие вещества, которые мы используем повседневно, являются мутагенами. Однако более 90% соединений, в экспериментальных условиях, оказывающих канцерогенное действие на животных, в тесте Эймса проявляют мутагенную активность. Учитывая четкую корреляцию между мутагенезом и канцерогенезом, тест Эймса для бактериальных мутагенов широко применяется в качестве быстрого и дешевого метода выявления канцерогенов человека.
Рис. 25-21 Тест Эймса для выявления канцерогенов, основанный на мутагенности. Штамм Salmonella typhimurium, несущий мутацию, инактивирующую фермент метаболического пути биосинтеза гистидина, высевают на среду без гистидина. Растут только единичные клетки. а — несколько мелких колоний S. typhimurium, которые, тем не менее, вырастают на не содержащей гистидин среде. несут спонтанные обратные мутации, восстанавливающие биосинтез гистидина. Три чашки б, в и г с такой средой засевают равным числом клеток. Затем в центр каждой чашки помешают диски фильтровальной бумаги с разной концентрацией мутагена. Мутаген значительно увеличивает вероятность возникновения обратной мутации и, соответственно, число выросших клеток в колонии. Чистая зона вокруг фильтровальной бумаги показывает, что концентрация мутагена здесь настолько высокая, что оказывается летальной для клеток. По мере того как мутаген диффундирует, удаляясь от диска фильтровальной бумаги, его концентрация понижается до сублетальных концентраций, которые индуцируют обратные мутации. Мутагены можно сравнивать на основании их влияния на частоту возникновения мутаций. Поскольку после проникновения в клетку многие соединения претерпевают разнообразные химические превращения, соединения иногда тестируют на мутагенность после их предварительной инкубации с экстрактом печени. Мутагенность некоторых веществ проявляется только после такой обработки.
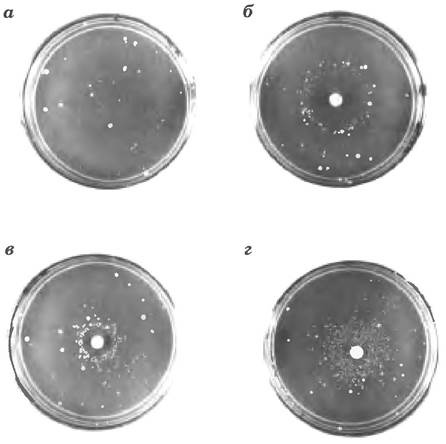
В геноме типичной клетки млекопитающего за 24 ч аккумулируется много тысяч повреждений. Однако в результате репарации ДНК менее одного повреждения из 1000 становится мутацией. Молекула ДНК относительно стабильна, но при отсутствии систем репарации кумулятивный эффект многих нечастых, но разрушительных реакций может привести к гибели организма. ■
Все клетки имеют несколько систем репарации ДНК
Количество и разнообразие систем репарации отражает важность репарации ДНК для выживания клетки, а также многообразие способов повреждения ДНК (табл. 25-5). Некоторые распространенные типы повреждений, например, пиримидиновые димеры (см. рис. 8-31), могут устраняться с помощью нескольких систем репарации. Многие процессы репарации ДНК очень неэффективны энергетически в отличие от большинства метаболических путей, в которых обычно каждая молекула АТР на счету и используется оптимальным образом. Но когда на карту поставлена целостность генетической информации, энергетические затраты не имеют значения.
Репарация ДНК возможна в значительной степени благодаря тому, что молекула ДНК состоит из двух комплементарных цепей. Повреждение ДНК в одной цепи может быть удалено и аккуратно исправлено благодаря использованию неповрежденной комплементарной цепи в качестве матрицы. Далее мы рассмотрим основные типы систем репарации, начиная с репарации редких неправильно спаренных нуклеотидов, остающихся после репликации.
Репарация ошибочно спаренных оснований.
Коррекция редких ошибочно спаренных оснований, остающихся после репликации в Е. coli, увеличивает общую точность репликации еще на 2-3 порядка. Неправильно спаренные основания почти всегда корректируются в соответствии с информацией в старой (матричной) цепи, поэтому система репарации должна каким-то образом различать исходную и заново синтезированную цепи. Для этого клетка метит матричную ДНК метальными группами. Система репарации ошибочно спаренных оснований Е. coli включает по меньшей мере 12 белковых компонентов (табл. 25-5), которые либо дискриминируют цепи, либо участвуют в самом процессе репарации.
Таблица 25-5. Типы систем репарации ДНК у E. coli

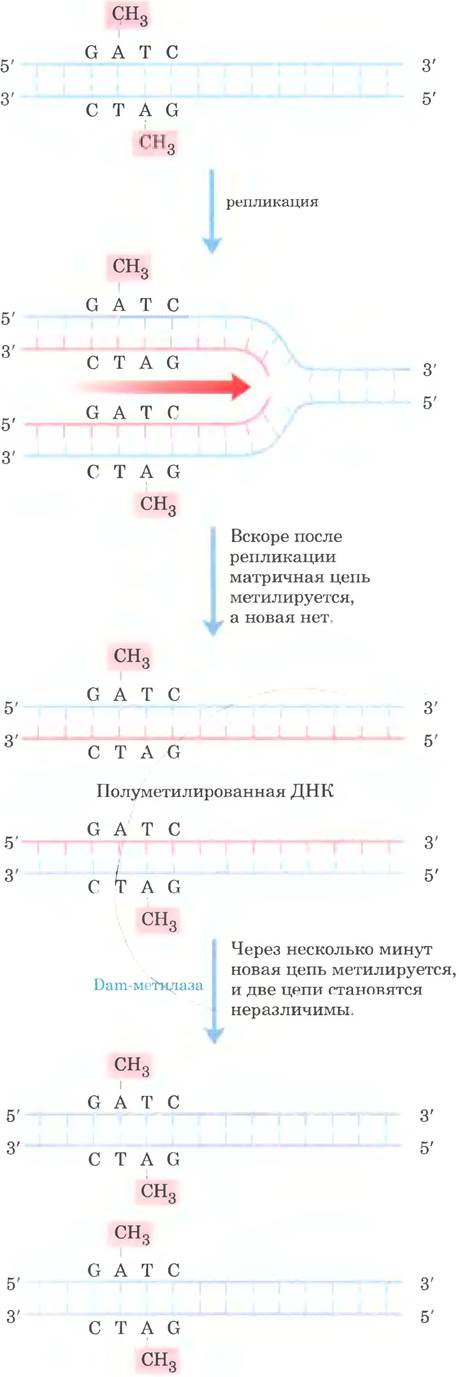
Механизм дискриминации цепей не установлен для большинства бактерий и эукариот, но хорошо изучен у Е. coli и некоторых родственных бактерий. У этих прокариот дискриминация цепей основана на действии Dam-метилазы, которая, как вы помните, метилирует ДНК в положении N6 остатка аденина в составе последовательностей (5’) GATC. Сразу после прохождения репликативной вилки наступает короткий период (несколько секунд или минут), когда матричная цепь метилируется, а вновь синтезированная цепь нет (рис. 25-22). Временно неметилированные последовательности GATC во вновь синтезированной цепи позволяют отличить новую цепь от матричной. Ошибочно встроенные основания вблизи наполовину метилированной последовательности GATC устраняются исходя из информации, содержащейся в метилированной родительской (матричной) цепи. Исследования in vitro показали, что, если последовательности GATC метилированы в обеих цепях, исправляется небольшое число ошибок; если ни одна из цепей не метилирована, репарация происходит, но ни одна из цепей не имеет преимуществ. Клеточные системы репарации, основанные на метилировании, аффективно устраняют однонуклеотидные замены на расстоянии до 1000 п. н. от наполовину метилированной последовательности GATC.
Рис. 25-22. Метилирование и репарация ошибочно спаренных оснований. Метилирование цепей ДНК у Е. coli может служить для дискриминации родительских (матричных) цепей и вновь синтезированных цепей, что имеет решающее значение для репарации однонуклеотидных замен; см. рис. 25-23. Метилирование происходит по положению N6 остатков аденина в последовательностях 5’(GATC). Эта последовательность представляет собой палиндром (см. рис. 8-18 в т. 1), расположенный на двух цепях в противоположных ориентациях.
Как такие относительно удаленные последовательности GATC направляют коррекцию ошибочно спаренных оснований? Механизм показан на рис. 25-23. Белок MutL образует комплекс с белком MutS, и этот комплекс связывается со всеми аномальными парами оснований (кроме С-С). Белок MutH связывается с MutL и последовательностями GATC, с которыми встретился комплекс MutL-MutS. ДНК с обеих сторон от аномальной пары протягивается через комплекс MutL-MutS, создавая петлю. Одновременное продвижение обоих концов петли через комплекс равнозначно движению комплекса вдоль ДНК одновременно в двух направлениях. Белок MutH обладает сайт-специфической эндонуклеазной активностью, которая не проявляется ло тех пор. пока комплекс не встречает наполовину метилированную последовательность GATC. В этом месте MutH катализирует расщепление неметилированной цепи на 5’-конце остатка G в составе последовательности GATC, что помечает цепь для последующей репарации. Дальнейшие стадии метаболического пути зависят от того, где именно располагается ошибочно спаренное основание относительно места расщепления (рис. 25-24).
Рис. 25-23. Модель ранних стадий репарации, основанной на метилировании ДНК. Участвующие в данном процессе белки Е. coli (см. табл. 25-5) были выделены и очищены. Узнавание последовательности 5'(GATC) и распознавание ошибочно спаренного основания — специфические функции белков MutL и MutS соответственно. Белок MutH образует комплекс с MutS в точке аномального спаривания. ДНК проходит через этот комплекс таким образом, что комплекс движется одновременно в двух направлениях вдоль ДНК до тех пор, пока не придет в соприкосновение с белком MutH, связанным с полумети- лированной последовательностью GATC. Белок MutH расщепляет неметилированную цепь по остатку гуанина в этой последовательности со стороны 5′-конца. Затем комплекс, включающий ДНК-хеликазу II и одну из экзонуклеаз, расщепляет неметилированную цепь от этой точки до ошибочно спаренного основания (см. рис. 25-24).
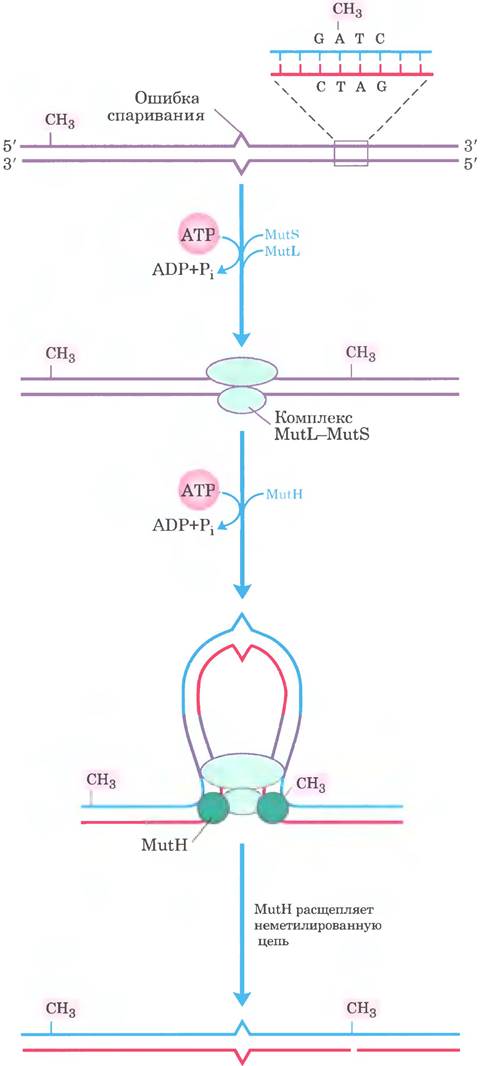
Рис. 25-24. Завершение репарации, основанной на метилировании ДНК. Действуя совместно, ДНК-хеликаза II, SSB и одна из четырех экзонуклеаз удаляют участок новой цепи между местом расщепления белком MutH и точкой, расположенной сразу за ошибочно спаренным основанием. Выбор экзонуклеазы зависит от расположения места расщепления относительно аномальной пары оснований. На схеме показаны альтернативные варианты. Образующуюся брешь заполняет ДНК-полимераза III (пунктирная линия), а ник ликвидирует ДНК-лигаза (не показано).
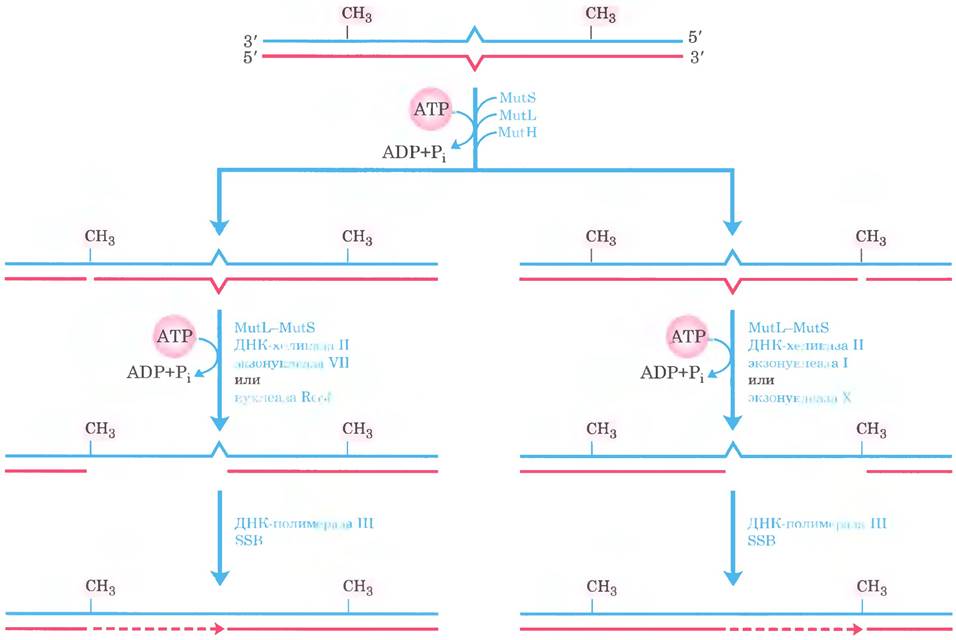
Если ошибочно спаренное основание находится со стороны 5'-конца от места расщепления (рис. 25-24, справа), неметилированная цепь раскручивается и разрушается в направлении 3' —> 5' от места расщепления, захватывая ошибочно спаренное основание, и этот участок замещается новой ДНК. Данный процесс требует совместного действия ДНК-хеликазы II, SSB, экзонуклеазы I или экзонуклеазы X (обе разрушают цепи ДНК в направлении 3' —> 5'), ДНК-полимеразы III и ДНК-лигазы. Метаболический путь репарации ошибочно спаренных оснований, находящихся со стороны 3'-конца от точки расщепления, отличается лишь тем, что в нем участвует экзонуклеаза VII (которая расщепляет одноцепочечную ДНК в направлении 5' —> 3' или 3' —> 5') или RecJ-нуклеаза (которая расщепляет одноцепочечную ДНК в направлении 5' —> 3').
При оценке энергетической стоимости репарации однонуклеотидных замен у Е. coli выясняется, что это очень затратный процесс. Аномальная пара оснований может находиться на расстоянии 1000 и. н. и более от GATC. Расщепление и восстановление сегмента такой длины требует огромного количества активированных предшественников дезоксинуклеотидов для репарации одной нуклеотидной замены. Это еще раз подчеркивает значение целостности генома для клетки.
Все эукариотические клетки содержат несколько белков, структурно и функционально аналогичных бактериальным белкам MutS и MutL (но не MutH). У человека изменения в генах, кодирующих белки этого типа, вызывают некоторые наиболее распространенные наследуемые синдромы, связанные с предрасположенностью к онкологическим заболеваниям (доп. 25-1), что еще раз демонстрирует значение систем репарации для организма. У большинства эукариот, от дрожжей до человека.
основные гомологи MutS - белки MSH2 (от MutS homolog 2), MSH3 и MSH6. Гетеродимеры MSH2 и MSH6 обычно связываются с одиночными аномальными парами оснований, но хуже связываются с чуть более длинными неправильно спаренными петлями. У многих организмов более длинные участки аномального спаривания (от 2 до 6 п. н.) связываются с гетеродимерами MSH2/MSH3 или с гетеродимерами двух типов в тандеме. Гомологи MutL, особенно гетеродимер MLH1 и PMS1 (от. postmeiotic segregation), соединяются с комплексами MSH и стабилизируют их. Детальные исследования процесса репарации ошибочно спаренных оснований у эукариот активно продолжаются. В частности, пока неизвестен механизм, с помощью которого идентифицируются вновь синтезированные цепи ДНК, хотя было установлено, что последовательности GATC в этомучастия не принимают.
Эксцизионная репарация оснований.
Каждая клетка содержит класс ферментов, называемых ДНК -гликозилазами; они распознают наиболее распространенные повреждения ДНК (например, продукты дезаминирования цитозина и аденина; см. рис. 8-30. а) и удаляют поврежденные основания посредством расщепления N-гликозидной связи. Такое вырезание основания приводит к возникновению апуринового или апиримидинового сайта в ДНК, который называют АР-сайтом или сайтом, лишенным основания. Обычно каждая ДНК-гликозилаза специфична к одному типу нарушений.
Так, урацил-ДНК-гликозилаза, обнаруженная в большинстве клеток, специфически удаляет из ДНК урацил, который образуется при спонтанном дезаминировании цитозина. В мутантных клетках, утративших этот фермент, повышается доля мутаций в парах G = C по сравнению с мутациями в парах А = Т. Эта гликозилаза не удаляет
остатки урацила из РНК или остатки тимина из ДНК. Необходимость дискриминации тимина и урацила (продукта дезаминирования цитозина) для селективной репарации цитозина может быть одной из причин, по которой в состав ДНК входит тимин, а не урацил (см. с. 416 в т. 1).
У большинства бактерий есть только один тип урацил-ДНК-гликозилазы, а у человека существует по меньшей мере четыре типа с различной специфичностью — это показатель важности удаления урацила из ДНК. Наиболее распространенная урацил-гликозилаза человека, UNG, связывается с реплисомой и вырезает остатки урацила, случайно встроенные вместо тимина в ходе репликации. Дезаминирование остатков цитозина происходит в 100 раз быстрее в одноцепочечной ДНК, чем в двухцепочечной, и у человека есть специальный фермент hSMUG1, который удаляет любые остатки урацила в одноцепочечной ДНК в ходе репликации или транскрипции. Две другие ДНК- гликозилазы человека, TDG и MBD4, удаляют спаренные с гуанином остатки урацила и тимина, образованные дезаминированием цитозина или 5-метилцитозина соответственно.
Другие ДНК-гликозилазы распознают и удаляют различные поврежденные основания, включая формамидопиримидин и 8-гидроксигуанин (оба образуются при окислении пурина), гипоксантин (образуется при дезаминировании аденина) и алкилированные основания, такие как 3-метиладенин и 7-метилгуанин. В некоторых классах организмов также были идентифицированы гликозилазы, которые распознают другие дефекты, включая пиримидиновые димеры. Вспомните, что АР-сайты образуются также в результате медленного спонтанного гидролиза N-гликозидных связей в ДНК (см. рис. 8-30, б в т. 1).
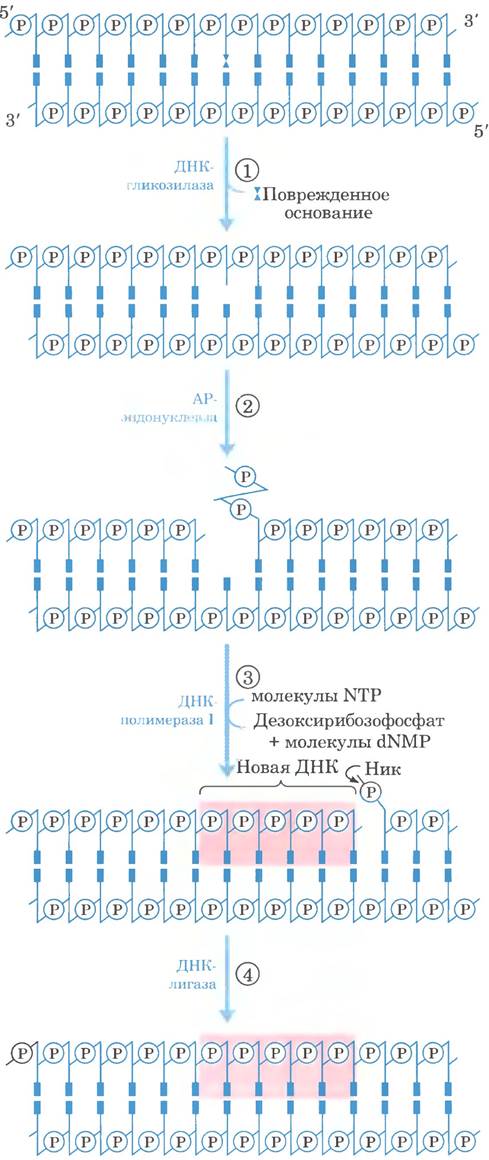
Образованный ДНК-гликозилазой АР-сайт устраняют другие ферменты. Репарация происходит не просто путем присоединения нового основания и восстановления N-гликозидной связи. Вместо этого удаляется оставшийся дезокси- рибозо-5'-фосфат и встраивается новый нуклеотид. Этот процесс начинает одна из АР-эндонуклеаз, расщепляющих цепь ДНК, в которой содержится АР-сайт. Положение разреза относительно АР-сайта (со стороны 3'- или 5'-конца) зависит от типа АР-эндонуклеазы. Затем участок ДНК. включающий АР-сайт, удаляется, ДНК-полимераза 1 достраивает ДНК, а ДНК-лигаза ликвидирует оставшийся ник (рис. 25-25). У эукариот замену нуклеотидов выполняют специализированные полимеразы, как описано ниже.
Рис. 25-25. Эксцизионная репарация оснований. ① ДНК-гликозилаза распознает поврежденное основание и отщепляет его от дезоксирибозы в цепи ДНК. ② АР- эндонуклеаза расщепляет фосфодиэфирную связь около АР-сайта. ③ ДНК-полимераза I инициирует репарационный синтез, начиная от свободной 3'-гидроксильной группы в нике, при этом удаляется (с помощью 5' —> 3'-экзонуклазной активности) часть поврежденной цепи и происходит замена ее на новую ДНК. ④ Ник, оставшийся после диссоциации ДНК-полимеразы I, ликвидирует ДНК-лигаза.
Эксцизионная репарация нуклеотидов.
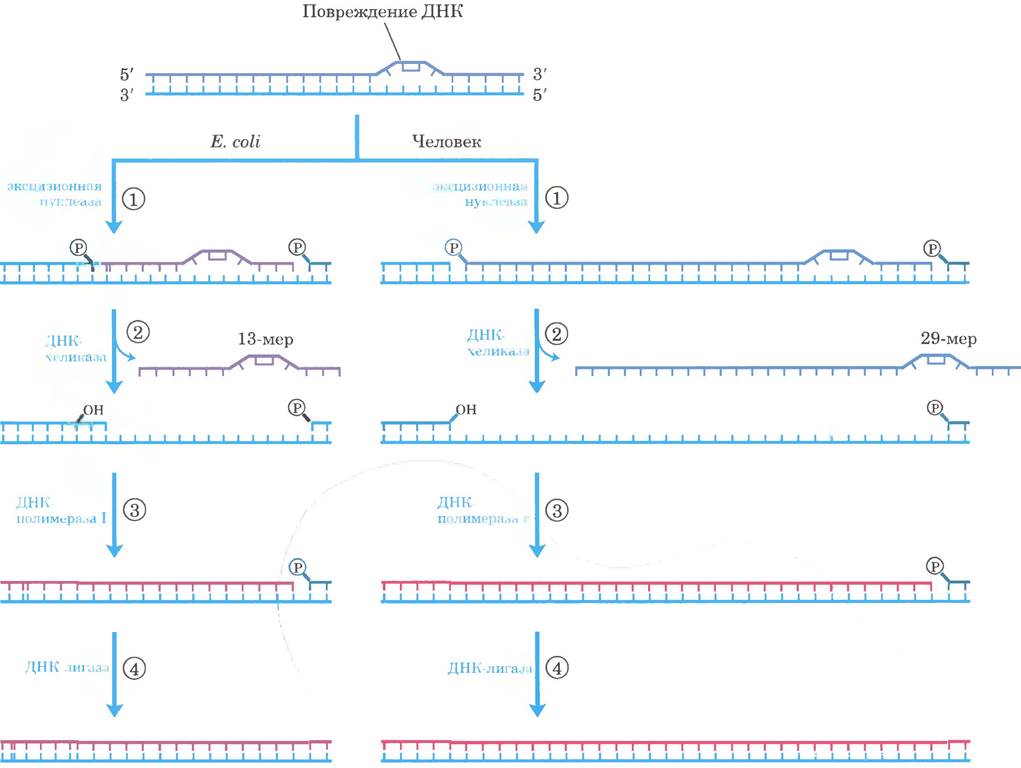
Повреждения ДНК, которые вызывают значительные искажения спиральной структуры, обычно восстанавливаются системой эксцизионной репарации нуклеотидов. Этот путь репарации принципиально важен для выживания всех свободноживущих организмов. В этой системе репарации (рис. 25-26) мультисубъединичный фермент гидролизует две фосфодиэфирные связи по одной с каждой стороны от дефекта. У Е. coli и других бактерий ферментная система гидролизует 5-фосфодиэфирную связь с 3'-конца и 8-фосфодиэфирную связь с 5'-конца, создавая фрагмент из 12-13 нуклеотидов (в зависимости от того, одно или два основания повреждено). У человека и других эукариот ферментная система гидролизует 6-ю фосфодиэфирную связь с 3'-конца и 22-ю фосфодиэфирную связь с 5'-конца, образуя фрагмент из 27-29 нуклеотидов. В результате двустороннего разреза из дуплекса высвобождается нуклеотид с поврежденным участком, а образующаяся брешь заполняется у Е. coli ДНК-полимеразой I, а у человека — ДНК-полимеразой ε. Ник запечатывает ДНК-лигаза.
Рис. 25-26. Эксцизионная репарация нуклеотидов у Е. coli и человека. Основной путь репарации путем вырезания нуклеотидов почти одинаковый у всех организмов. ① Эксцизионная нуклеаза связывается с ДНК в месте крупного повреждения и расщепляет поврежденную цепь ДНК с обеих сторон от повреждения. ② Фрагмент ДНК длиной 13 нуклеотидов (13-мер) или 29 нуклеотидов (29-мер) удаляется с помощью хеликазы. ③ Брешь заполняется ДНК-полимеразой, а ④ оставшийся ник ликвидируется ДНК-лигазой.
У Е. coli ключевую роль в этом процессе исполняет эксцизионная нуклеаза АВС, состоящая из трех субъединиц: UvrA (Мr = 104 000), UvrB (Мr = 78 000) и UvrC (Мr = 68 000). Определение «эксцизионная нуклеаза» описывает уникальную способность этого ферментного комплекса катализировать двойное специфическое расщепление, что отличает его от обычных эндонуклеаз. Комплекс белков UvrA и UvrB (А2В) сканирует ДНК и связывается в месте повреждения. Затем димер UvrA диссоциирует, оставляя прочный комплекс UvrB - ДНК. После этого с UvrB связывается белок UvrC, и UvrB производит расщепление 5-й фосфодиэфирной связи со стороны 3’-конца от повреждения. Далее следует UvrC-опосредованное расщепление 8-й фосфодиэфирной связи со стороны 5'-конца. Образующийся фрагмент из 12-13 нуклеотидов удаляется ДНК-хеликазой. Получившаяся небольшая брешь устраняется ДНК-полимеразой I и ДНК-лигазой. Это основной путь репарации для многих типов повреждений (см. рис. 25-26. слева), включая циклобутановые пиримидиновые димеры, 6,4-фотоиродукты (см. рис. 8-31 в т. 1) и некоторые другие аддукты, включая бензо[а]пиренгуанин, который образуется в ДНК под воздействием табачного дыма. Нуклеолитическая активность эксцизионной нуклеазы АВС отличается от активности других эндонуклеаз тем, что она одновременно производит два разреза в ДНК.
Механизм работы эукариотических эксцизи- онных нуклеаз чрезвычайно схож с аналогичным механизмом бактериального фермента, хотя для двойной эксцизии в клетках эукариот необходимы 16 полипептидов, не имеющих сходства с субъединицами эксцизионной нуклеазы Е. coli. Как описано в гл. 26, эксцизионная репарация нуклеотидов и оснований у эукариот тесно связана с транскрипцией. Генетические дефекты системы эксцизионной репарации нуклеотидов — причина различных серьезных заболеваний человека (см. доп. 25-1).
Прямая репарация.
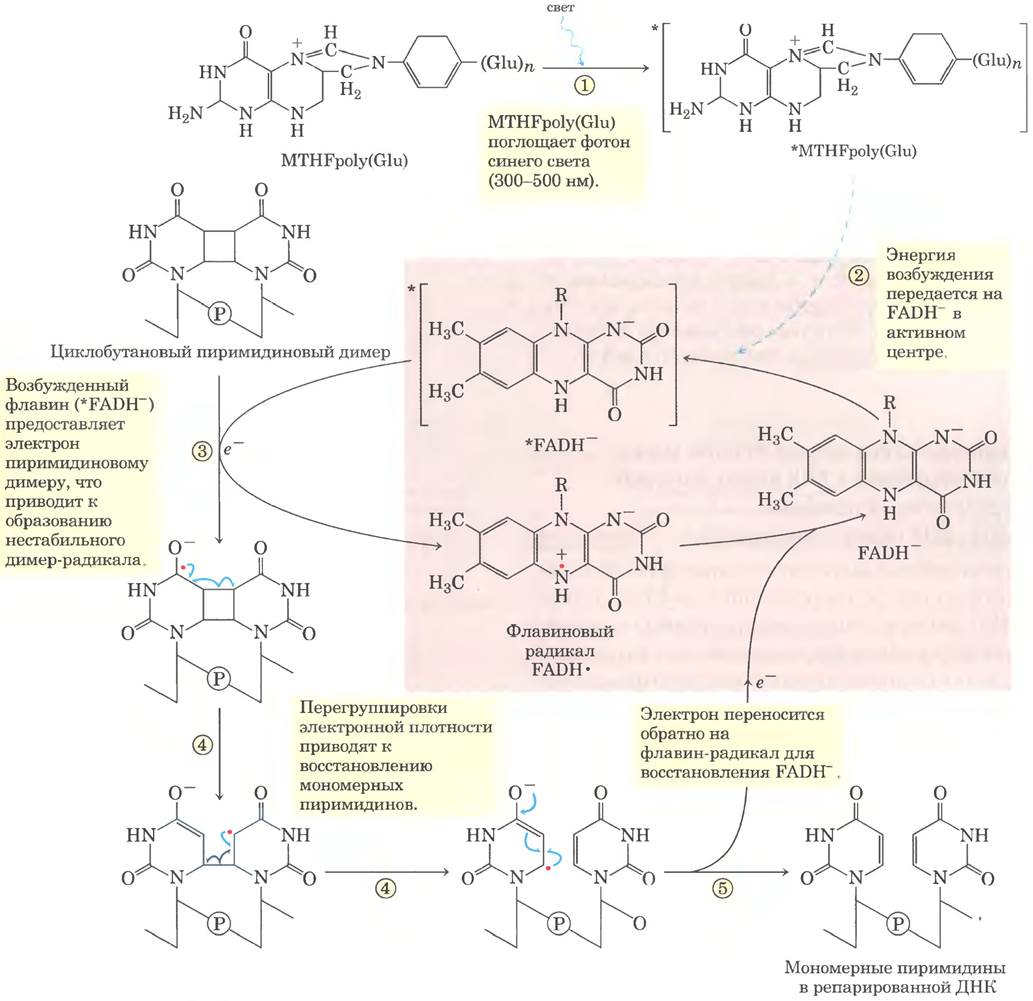
Некоторые типы повреждений устраняются без удаления нуклеотида или основания. Наиболее характерный пример прямая фотореактивация циклобутановых пиримидиновых димеров, которая осуществляется ДНК-фотолиазами. Пиримидиновые димеры образуются в индуцируемой УФ-облучением реакции, и фотолиазы используют энергию поглощенного света для устранения повреждения (рис. 25-27). Фотолиазы обычно содержат два кофактора, которые действуют как светопоглощающие агенты (хромофоры). Одним из хромофоров всегда является FADH. У Е. coli и дрожжей другой хромофор — фолат. В ходе реакции образуются свободные радикалы. В клетках плацентарных млекопитающих (в т. ч. у человека) ДНК-фотолиазы отсутствуют.
Рис. 25-27. Механизм реакции. Устранение пиримидиновых димеров фотолиазой. Энергия поглощенного света используется для ликвидации последствий фотореакции, вызвавшей повреждение. У Е. coli совместно работают два хромофора фотолиазы (Mr = 54 000): N5, N10-метенилтетрагидрофолилполиглутамат (MTHFpolyGlu) и FADH-. MTHFpolyGlu выполняет функцию антенны, поглощая фотоны синего света (300-500 нм). Энергия возбуждения передается на FADH-, и возбужденный флавин (*FADH-) отдает электрон пиримидиновому димеру, устраняя повреждение.
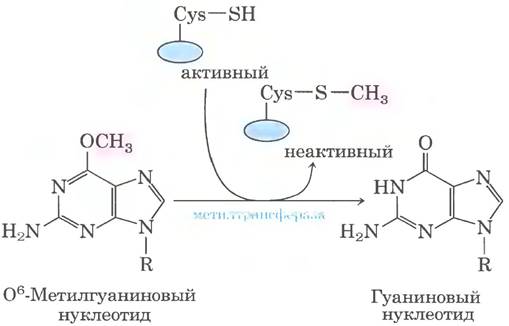
Другим примером может служить репарация нуклеотидов, дефект в которых вызван алкилированием. Модифицированный нуклеотид О6-метилгуанин образуется в присутствии алкилирующих агентов — это широко распространенное и сильно мутагенное повреждение (см. с. 419 в т. 1). В ходе репликации он легче образует пару с тимином, чем с цитозином, и в результате происходят замена пары G = C на А = Т (рис. 25-28). Прямую репарацию О6- метилгуанина производит О6-метилгуанин- ДНК-метилтрансфераза, которая катализирует перенос метальной группы на один из своих остатков Cys. Эта метилтрансфераза не истинный фермент, поскольку в результате однократного переноса метальной группы она остается метилированной и выбывает из процесса. Расход целой белковой молекулы для исправления одного поврежденного основания — очередная яркая иллюстрация приоритета целостности клеточной ДНК.
Поиному, но тоже прямому механизму идет репарация 1 -метиладенина и 3-метилцитозина. Аминогруппы остатков А и С иногда метилируются (обычно в одноцепочечной ДНК), и это влияет на правильность спаривания оснований. У Е. coli окислительное деметилирование подобных алкилированных нуклеотидов опосредует белок AlkB — представитель суперсемейства α-кетоглутарат- Fе2+ - зависимых диоксигеназ (рис. 25-29). (Описание другого фермента из этой группы см. в доп. 4-3 в т. 1.)
Рис. 25-28. Пример образования мутаций в результате повреждения ДНК. а — продукт метилирования O6- метилгуанин легче образует пару с тимином, чем с цитозином. б — при отсутствии репарации это приводит к мутации: после репликации G = C заменяется на А = Т.
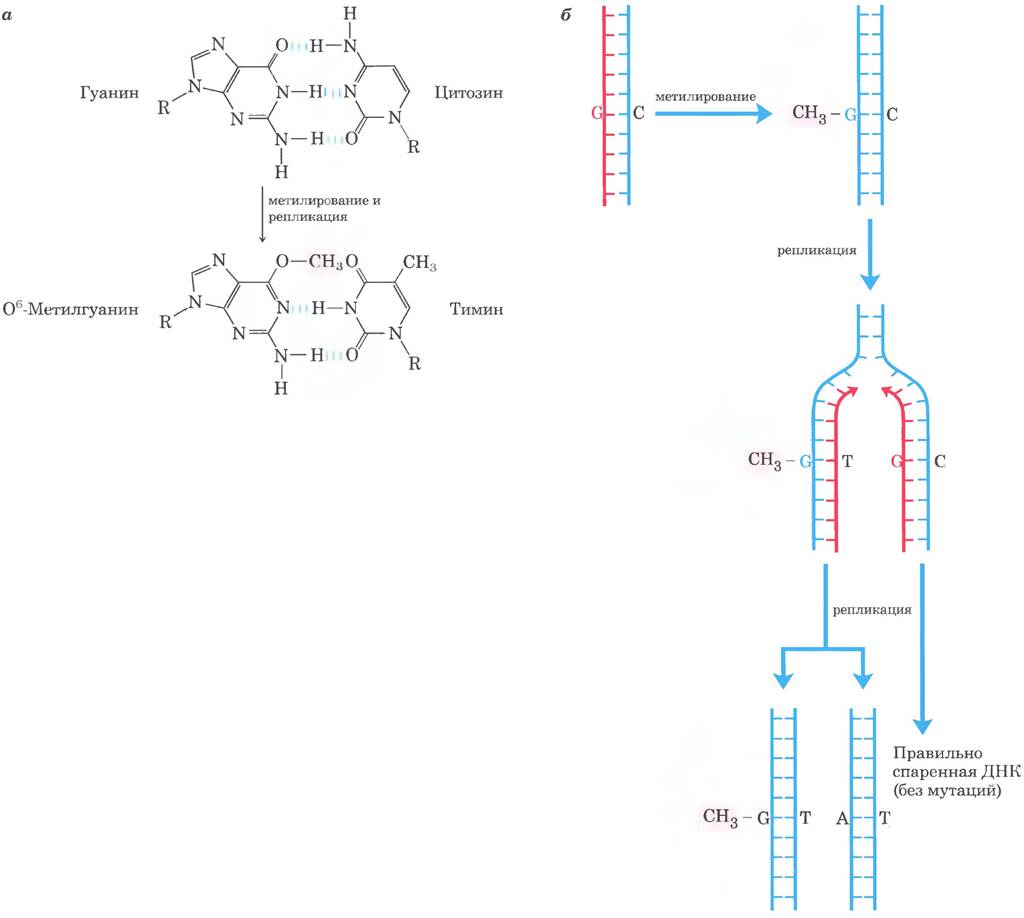
Рис. 25-29. Прямая репарация алкилированных оснований белком AlkB. Белок AlkB — α-кетоглутарат-Fе2+-зависимая диоксигеназа; катализирует окислительное деметилирование остатков 1-метиладенина и 3-метил- цитозина.
Взаимодействие репликативных вилок с повреждением в ДНК может запустить подверженный ошибкам синтез ДНК через повреждение
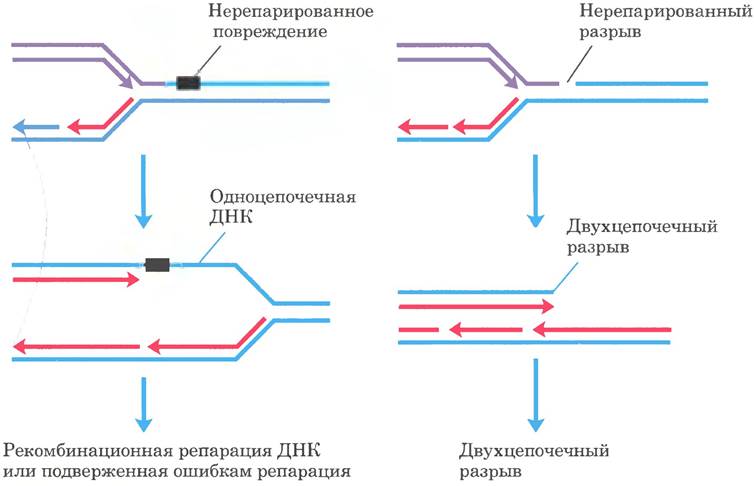
Рассмотренные выше пути репарации обычно действуют в случае повреждений в двухцепочечной ДНК, при этом точность восстановления генетической информации поврежденной цепи до первоначального состояния обеспечивает неповрежденная цепь. Однако при некоторых типах повреждений, например, при двунитевых разрывах, поперечных сшивках или повреждениях в одноцепочечной ДНК, комплементарная цепь также оказывается разрушенной или отсутствует. Двунитевые разрывы и повреждения в одноцепочечной ДНК чаще всего возникают в тех случаях, когда репликативная вилка наталкивается на нерепарированное повреждение ДНК (рис. 25-30). Такие повреждения и поперечные сшивки ДНК, кроме того, могут быть результатом воздействия ионизирующей радиации и окислительных реакций.
Рис. 25-30. Повреждения ДНК и их влияние на репликацию. Если репликативная вилка наталкивается на неисправленное повреждение или разорванную цепь, репликация обычно останавливается. Слева: повреждение, оставшееся в нереплицированном одноцепочечном сегменте ДНК; справа: двухцепочечный разрыв цепи. В любом случае повреждение в одной цепи не может быть устранено ранее описанными механизмами, поскольку комплементарная цепь, необходимая для точной репарации, повреждена или отсутствует. В таких случаях есть два возможных пути репарации: рекомбинационная репарация ДНК (см. рис. 25-37) или при слишком обширных повреждениях подверженная ошибкам репарация через повреждение. В последнем механизме задействована другая ДНК-полимераза (ДНК-полимераза V, кодируемая генами umuС и umuD), которая может реплицировать, хотя и с ошибками, участки ДНК с различными типами повреждений. Такой механизм называется репарацией, «подверженной ошибкам», из-за частого возникновения мутаций.
При застопоривании бактериальной репликативной вилки возможны два пути репарации. В отсутствие второй цепи информация, необходимая для точной репарации, должна поступить от гомологичной хромосомы. Таким образом, система репарации использует гомологичную генетическую рекомбинацию. Рекомбинационная репарация ДНК подробно рассматривается в разд. 25.3. При некоторых обстоятельствах реализуется второй путь репарации — подверженный ошибкам синтез ДНК через повреждение(TLS — от англ. translesion synthesis). При активации этого пути репарация ДНК становится существенно менее точной и связана с высокой частотой мутаций. У бактерий подверженный ошибкам синтез ДНК через повреждение — часть стрессового ответа клетки на сильное повреждение ДНК, который называют SOS-ответом. Некоторые SOS-белки, например, уже описанные UvrA и UvrB (табл. 25-6), всегда присутствуют в клетке, но при запуске SOS-ответа их уровень значительно повышается. В подверженной ошибкам репарации участвуют и другие SOS-белки, в том числе UmuC и UmuD («Umu» - от англ. immutable — нему тируемый; без функционального гена ити подверженная ошибкам репарация отсутствует). В SOS-регулируемом процессе белок UmuD превращается в более короткий фрагмент UmuD’, который в комплексе с UmuC образует специализированную ДНК-полимеразу (ДНК-полимеразу V), способную восстанавливать многие повреждения ДНК, блокирующие репликацию. В дефектном участке правильное спаривание оснований часто оказывается невозможным, поэтому такая репликация через повреждение сопровождается ошибками.
Таблица 25-6. Гены, индуцируемые как часть SOS-ответа у E. Coli
Название гена Гены с известной функцией polB (dinA) |
Кодируемый белок и/или его роль в репарации ДНК Кодирует субъединицу ДНК-полимеразы III с полимеразной активностью, необходимую для возобновления рекомбинационной репарации |
uvrA uvrB |
Кодируют субъединицы UvrA и UvrB АВС-экзонуклеазы |
umuС umuD |
Кодируют ДНК-полимеразу V |
sulA |
Кодирует белок, ингибирующий клеточное деление, возможно, высвобождая время для репарации ДНК |
recA |
Кодирует RecA белок, необходимый для подверженной ошибка» репарации и рекомбинационной репарации |
dinB |
Кодирует ДНК-полимеразу IV |
himA |
Кодирует субъединицу клеточного фактора интеграции (IHF), участвующего в сайт-специфической рекомбинации, репликации, транспозиции фагов, регуляции экспрессии генов |
Гены метаболизма ДНК с неизвестной функцией в репарации |
|
ssb |
Кодирует белок, связывающийся с одноцепочечной ДНК (SSB) |
uvrD |
Кодирует ДНК-хеликазу II (раскручивает ДНК) |
recN |
Необходим для рекомбинационной репарации |
Гены, функция которых не установлена |
|
dinD |
|
dinF |
Некоторые из этих генов и их функции обсуждаются в гл. 28.
В этой главе мы многократно подчеркивали особое значение сохранности генома, и поэтому существование системы, повышающей вероятность возникновения мутаций, может показаться странным. Использование этой системы можно воспринимать, как некий шаг отчаянья. Гены umuС и umuD полностью индуцируются только на поздней стадии SOS-ответа, они не активируются для синтеза, инициируемого расщеплением UmuD, до тех пор, пока уровень повреждений ДНК не становится слишком высоким, и блокируются все репликативные вилки. Мутации, возникающие в результате такой репликации, приводят к гибели одних клеток и опасны для других, но эту биологическую цену организм платит за то, чтобы не допустить прекращения репликации, поскольку это позволяет выжить хотя бы нескольким мутантным дочерним клеткам.
Наряду с ДНК-полимеразы V для репликации через поврежденный участок необходим белок RecA. Филаменты RecA, связанные с одноцепочечной ДНК в одном участке хромосомы, могут активировать комплексы ДНК-полимеразы V, связанные в отдаленных участках хромосомы. Реализации этого так называемого транс-механизма способствует образование петель, сближающих в пространстве удаленные друг от друга последовательности хромосом. В ходе SOS-ответа индуцируется еще одна ДНК-полимераза — ДНК-полимераза IV (продукт гена dinB). Репликация под действием ДНК-полимеразы IV также происходит с большим количеством ошибок. Бактериальные ДНК-полимеразы IV и V относятся к семейству TLS-полимераз, найденному у всех организмов. Эти ферменты не имеют корректирующей экзонуклеазной активности, а точность в выборе оснований при репликации в 102 раз ниже, что уменьшает точность репликации в целом примерно до одной ошибки на 1000 нуклеотидов.
У млекопитающих есть много ДНК-полимераз из семейства TLS-полимераз, отличающихся низкой точностью синтеза. Однако присутствие этих ферментов не является причиной повышенной частоты мутаций, поскольку большинство из них выполняют особые функции при репарации. ДНК-полимераза г), например, относится к TLS-полимеразам и обнаружена у всех эукариот. Она осуществляет синтез через поврежденные участки, главным образом, через циклобутановые Т-Т-димеры. В этом случае образуется немного мутаций, поскольку фермент предпочтительно вставляет два остатка А напротив связанных остатков Т. У эукариот несколько полимераз, включая ДНК-полимеразы β, յ и λ, выполняют специальные функции с низкой точностью при эксцизионной репарации оснований. Каждый из этих ферментов наряду с полимеразной активностью имеет активность 5'-дезоксирибозофосфат-лиазы. После удаления основания гликозилазой и расщепления остова молекулы АР-эндонуклеазой эти ферменты удаляют АР-сайт (5'-дезоксирибозофосфат) и заполняют очень короткую брешь. Количество мутаций, возникающих при действии ДНК-полимеразы n, невелико по той причине, что она синтезирует очень короткие участки ДНК (часто в один нуклеотид).
В результате исследования систем репарации клеточной ДНК стало понятно, что метаболизм ДНК поддерживает целостность генома с помощью многочисленных и часто избыточных систем. В геноме человека более 130 генов кодируют белки, связанные с репарацией ДНК. Во многих случаях потеря функции одного гена приводит к нестабильности генома и повышению вероятности опухолевых заболеваний (доп. 25-1). Эти системы репарации часто работают в комплексе с системами репликации ДНК и дополняются системами рекомбинации, которые будут рассмотрены ниже.
Дополнение 25-1. МЕДИЦИНА. Репарация ДНК и рак
Рак у человека возникает, когда определенные гены, регулирующие нормальное клеточное деление (онкогены и опухолевые супрессоры; см. гл. 12 в т. 1), перестают нормально функционировать, изменяются или активируются не вовремя. В результате рост клеток может выйти из-под контроля — возникает опухоль. Гены, контролирующие клеточное деление, могут быть повреждены спонтанной мутацией или перекрываться инвазией опухолевого вируса (гл. 26). Неудивительно, что изменения в генах репарации ДНК, приводящие к усилению мутагенеза, могут значительно повысить индивидуальную чувствительность к раку. Все дефекты генов белков, участвующих в эксцизионной репарации оснований, репарации ошибочно спаренных оснований, рекомбинационной репарации и SOS-репарации, связаны с онкологическими заболеваниями. Итак, от репарации ДНК может зависеть жизнь и смерть.
Эксцизионная репарация оснований у человека, в отличие от бактерий, нуждается в большем числе белков, хотя в целом механизмы очень похожи. Генетические дефекты, сопровождающиеся инактивацией экс- цизионной репарации оснований, связаны с несколькими генетическими заболеваниями, среди которых лучше других исследована пигментная ксеродерма, или ХР (от лат. xeroderma pigmentosum). Поскольку у человека эксцизионная репарация оснований — единственный способ репарации пиримидиновых димеров, люди с ХР очень чувствительны к свету и часто заболевают раком кожи, который индуцируется солнечным светом. У большинства больных ХР также выражены неврологические расстройства, предположительно из-за отсутствия у них репарации определенных повреждений, вызванных высокой активностью окислительного метаболизма в нейронах. Дефекты в генах, кодирующих один из семи (как минимум) разных белковых компонентов системы эксцизионной репарации оснований, могут привести к семи генетическим вариантам ХР (от ХРА до XPG). Некоторые из этих белков (особенно те, которые повреждены при ХРВ, XPD и XPG) также участвуют в сопряженной с транскрипцией репарации окислительных повреждений, как описано в гл. 26.
У большинства микроорганизмов есть дополнительные пути репарации циклобутановых пиримидиновых димеров — они могут использовать ДНК- фотолиазную активность, а иногда и эксцизионную репарацию оснований в качестве альтернативного механизма эксцизионной репарации нуклеотидов, но у человека и других плацентарных млекопитающих такой возможности нет. Отсутствие альтернатив эксцизионной репарации нуклеотидов для удаления пиримидиновых димеров вызвало предположение, что на ранней стадии эволюции млекопитающие были мелкими животными, были покрыты мехом и вели ночной образ жизни, не очень нуждаясь в репарации повреждений, вызванных УФ-облучением. Однако у млекопитающих есть путь синтеза, позволяющий обойти циклобутановые пиримидиновые димеры, и в нем участвует ДНК-полимераза n. Этот фермент предпочтительно вставляет два остатка А напротив пиримидинового димера Т-Т, минимизируя вероятность мутации. Люди, у которых в силу генетических нарушений не работает ДНК-полимераза n, страдают заболеванием, похожим на пигментную ксеродерму (ХР-вариант V, или XPV). Клинические проявления XPV напоминают симптомы классической формы ХР, хотя уровень мутаций при XPV бывает выше, когда клетки подвергаются воздействию УФ-облучения. По-видимому, в нормальных клетках система эксцизионной репарации нуклеотидов работает совместно с ДНК-полимеразой n, восстанавливая и или обходя пиримидиновые димеры, что необходимо для нормального клеточного роста и репликации ДНК. УФ-облучение приводит к появлению множества пиримидиновых димеров, и для поддержания репликации хотя бы часть из них приходится обходить путем синтеза через повреждение. Если одна из систем отсутствует, ее частично компенсирует другая система. Отсутствие активности полимеразы n приводит к остановке репликативных вилок и исправлению повреждений от УФ-света TLS-полимеразами, которые допускают гораздо больше ошибок. И если отсутствуют другие системы репарации ДНК, увеличение числа мутаций часто приводит к раку.
Один из распространенных наследуемых синдромов предрасположенности к возникновению злокачественных опухолей - наследственный неполипозный рак толстой кишки (ННРТК). Этот синдром связан с нарушением репарации ошибочно спаренных оснований. В клетках человека и других эукариот есть несколько белковых аналогов бактериальных белков MutL и MutS (см. рис. 25-23). Вероятность развития ННРТК могут повысить дефекты по крайней мерс в пяти разных генах репарации ошибочно спаренных оснований. Особенно распространены дефекты в hMLH1 (человеческий гомолог 1 MutL) и hMSH2 (человеческий гомолог 2 MutS). У человека с ННРТК рак обычно развивается в раннем возрасте, и чаще всего это бывает рак толстой кишки.
Большинство случаев рака молочной железы у женщин возникает без известной генетической предрасположенности. Однако в 10% случаев это заболевание связано с наследственным дефектом двух генов — BRCA1 и BRCA2. У человека белки BRCA1 и BRCA2 - это очень большие молекулы (1834 и 3418 аминокислотных остатков соответственно), которые взаимодействуют с многими другими белками, участвующими в транскрипции, поддержании хромосом, репарации ДНК и контроле клеточного цикла. Кроме того, белок BRCA2 связан с рекомбинационной репарацией двухцепочечных разрывов. Однако точная молекулярная функция BRCA1 и BRCA2 в этих клеточных процессах до сих пор не установлена. Вероятность заболевания раком груди у женщин с дефектами в гене BRCA1 или BRCA2 превышает 80%.
Краткое содержание раздела 25.2 Репарация ДНК
■ Клетки имеют несколько систем репарации ДНК. У Е. coli репарация ошибочно спаренных оснований осуществляется при временном отсутствии метилирования последовательностей (5') GATС во вновь синтезированной цепи.
■ Системы эксцизионной репарации распознают и устраняют повреждения, вызванные факторами внешней среды (такими, как радиация и алкилирующие агенты) и спонтанными реакциями нуклеотидов. Некоторые системы репарации распознают и вырезают только поврежденные или неправильные основания, оставляя АР-сайт (лишенный основания сайт) в ДНК, который вырезается и заполняется новой ДНК под действием других ферментов.
■ Системы эксцизионной репарации нуклеотидов распознают и удаляют различные крупные повреждения и пиримидиновые димеры. Они вырезают участок цепи ДНК, содержащий повреждение, и оставляют брешь, которую заделывают ДНК-полимераза и лигаза.
■ Некоторые повреждения ДНК ликвидируются в реакциях, обратных тем, которые вызывали дефект: пиримидиновые димеры превращаются в мономерные пиримидины с помощью фотолиазы, а метальная группа О6- метилгуанина удаляется метилтрансферазой.
■ При очень сильных повреждениях бактериальной ДНК происходит синтез новой последовательности через повреждение с участием TLS-полимеразы, допускающей достаточно много ошибок. Эукариоты имеют похожие полимеразы, выполняющие специализированные функции в репарации ДНК, что минимизирует количество мутаций.