Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Аминокислоты
Аминокислоты
Аминокислоты содержат в качестве функциональных групп аминогруппу и карбоксильную группу. В a-аминокислотах обе они связаны с одним и тем же (а) углеродным атомом (рис. 3.1).
В природе существует около 300 аминокислот, однако в белках обнаружены только 20 из них. В результате полного гидролиза1 белков высвобождается 20 L-a-аминокислот (табл. 3.2). Одни и те же 20 аминокислот присутствуют в белковых молекулах всех форм жизни — растений, животных и микроорганизмов. Почему это так — мы поймем позже, когда будем обсуждать универсальную природу генетического кода (гл. 30). Однако в ряде белков встречаются производные некоторых аминокислот, образующиеся уже после включения обычных аминокислот в молекулу белка (табл. 3.4).
За исключением глицина, у которого R — это атом водорода, у всех аминокислот четыре группы, связанные с a-углеродным атомом, различны. Благодаря тетраэдрическому расположению четырех разных групп относительно а-углеродного атома аминокислота обладает оптической активностью (способностью поворачивать плоскость поляризации плоскополяризованного света). Одни аминокислоты, входящие в состав белков, являются (при pH 7,0) правовращающими, а другие — левовращающими, однако все они имеют абсолютную конфигурацию L-глицеральдегида и поэтому являются L-a-аминокислотами.
1 Гидролиз — это разрыв ковалентной связи с присоединением атомов молекулы воды.
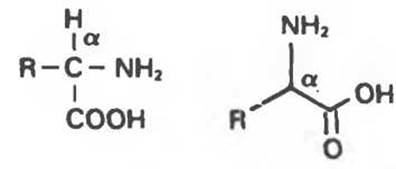
Рис. 3.1. Два способа изображения а-аминокислоты.