Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Аминокислоты
Ионные формы аминокислот
Аминокислоты несут по крайней мере две слабоионизируемые кислые группы, —СООН и —NH+3. В растворе эти группы находятся в двух формах, заряженной и незаряженной, между которыми поддерживается протонное равновесие:
![]()
R—СООН и R—NH+3 здесь являются протонированными партнерами, т. е. кислотами, а R—СОО- и R — NH2—сопряженными основаниями (т.е. акцепторами протонов) соответствующих кислот. И R—СООН, и R—NH43 — это слабые кислоты, и все же R—СООН является в несколько тысяч раз более сильной кислотой, чем R—NH+3. При значениях pH, характерных для плазмы крови и межклеточной жидкости (7,4 и 7,1 соответственно), карбоксильные группы находятся исключительно в форме карбоксилатных ионов, R—СОО. При этих значениях pH большая часть аминогрупп находится преимущественно в ассоциированной (протонированной) форме, R—NH+3. Преобладающая ионная форма аминокислот, присутствующих в крови и в большинстве тканей, представлена на рис. 3.2,А. Структура, изображенная на рис. 3.2.2.Б, не может существовать ни при каких pH. При значениях pH, достаточно низких для протонирования карбоксильной группы, аминогруппа, намного более слабая кислота, также будет протонирована. Примерные значения рКа a-карбоксильной и a-аминогрупп а-аминокислоты равны 2 и 10 соответственно (табл. 3.1). Кислота при pH ниже своего рКа будет преимущественно протонирована, причем если pH будет сдвинуто на 2 единицы ниже рКа, она будет протонирована на 99%. По мере увеличения pH карбоксильная группа теряет свой протон намного раньше, чем R—NH+3. При высоких значениях pH, достаточных для перехода аминогруппы преимущественно в форму незаряженного сопряженного основания, карбоксильная группа будет находиться в виде карбоксилатного иона (R—СОО-). Однако для удобства во многих уравнениях, когда речь не идет о протонных равновесиях, часто используется структура, изображенная на рис. 3.2,Б.
Относительную кислотность слабых кислот можно охарактеризовать с помощью константы диссоциации кислоты Ка или соответствующего ей рКа — отрицательного логарифма константы диссоциации:
рКа = -log Ка.
В табл. 3.1 представлены кислотные группы и значения рК для функциональных групп 20 аминокислот, входящих в состав белков.
Полный (суммарный) заряд (алгебраическая сумма всех положительных и отрицательных зарядов) аминокислоты зависит от pH, т.е. от концентрации протонов в окружающем растворе. Заряд аминокислоты или ее производного можно изменить, варьируя pH; это облегчает физическое разделение аминокислот, пептидов и белков.
Значение pH, при котором суммарный заряд аминокислоты равен нулю и поэтому она не перемещается в постоянном электрическом поле, называется ее изоэлектрической точкой (pI). Для алифатических аминокислот, таких как аланин, изоэлектрическая форма имеет вид, представленный на рис. 3.3.
Изоэлектрическая точка находится посредине между ближайшими значениями рК диссоциирующих групп по разные стороны от pI. Для аминокислоты, имеющей только две диссоциирующие группы, никакой неоднозначности при подсчете pI не возникает. Найдем, например, pI для аланина. Поскольку рK1 (R—СООН) = 2,35 и рК2 (R—NH+3) = 9,69, изоэлектрическая точка (рI) аланина равна случае можно ошибиться. Чему, например, будет равна изоэлектрическая точка для аспарагиновой кислоты, если исходить из данных, приведенных на рис. 3.4? Чтобы однозначно ответить на этот вопрос, нужно выписать все ионные структуры, возможные для данного соединения, в том порядке, в котором они образуются при переходе от сильнокислого к щелочному раствору (как это было сделано для аспарагиновой кислоты на рис. 3.4). Затем следует найти область pH изоионной (цвиттерионной), т.е. нейтральной, формы (как на рис. 3.4,Б), pІ — это значение pH посредине между ближайшими значениями рК по разные стороны от изоионной формы. Для данного примера
![]()
![]()
Рассчитать pІ для соединения, содержащего более двух диссоциирующих групп, труднее, и в этом
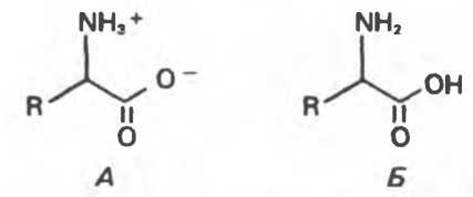
Рис. 3.2. А. Правильная ионная структура аминокислоты при значениях pH, близких к физиологическим. Б. Незаряженная форма, которая не может существовать ни при каких значениях pH; впрочем, такого типа формулу удобно использовать при обсуждении химии аминокислот.
Таблица 3.1. Слабокислые группы аминокислот, входящих в состав белков
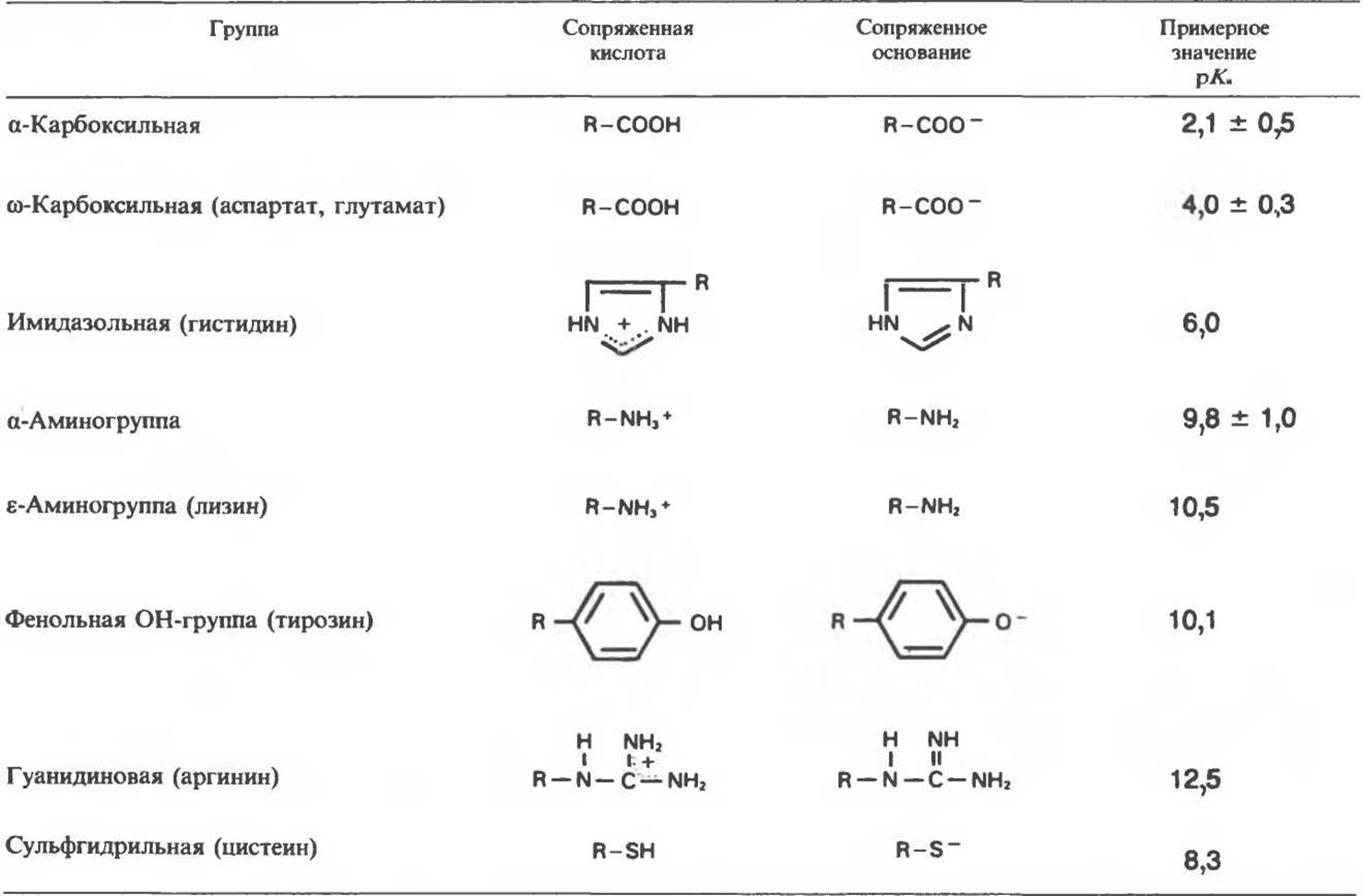
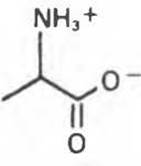
Рис. 3.3. Изоэлектрическая форма аланина («цвиттерион»). Хотя цвиттерион содержит заряженные группы, его заряд равен нулю, поэтому в постоянном электрическом поле он не перемещается.
Этот подход в равной мере применим для других аминокислот с диссоциирующими группами в боковой цепи, например для лизина или гистидина. Выписав формулы для всех возможных заряженных форм основных аминокислот, лизина и аргинина, получаем
![]()
Для лизина pІ = 9,7, для аргинина pІ = 10,8. Предлагаем вам найти pІ гистидина.
Описанный выше подход — оценка заряда структур, рК которых находится по разные стороны от pІ цвиттериона, — пригоден не только для аминокислот. Его можно применять для оценки заряда молекулы с любым числом диссоциирующих групп. Умение выполнять такие расчеты оказывается очень ценным для работы в клинической лаборатории, поскольку позволяет предсказать подвижность соединений в электрическом поле и подобрать соответствующий буфер для их разделения. Например, для разделения двух соединений со значениями pІ 6 и 8 пригоден буфер с pH 7,0, поскольку при этом pH молекулы с pІ = 6 будут нести суммарный отрицательный заряд, а молекулы с pІ = 8—положительный.
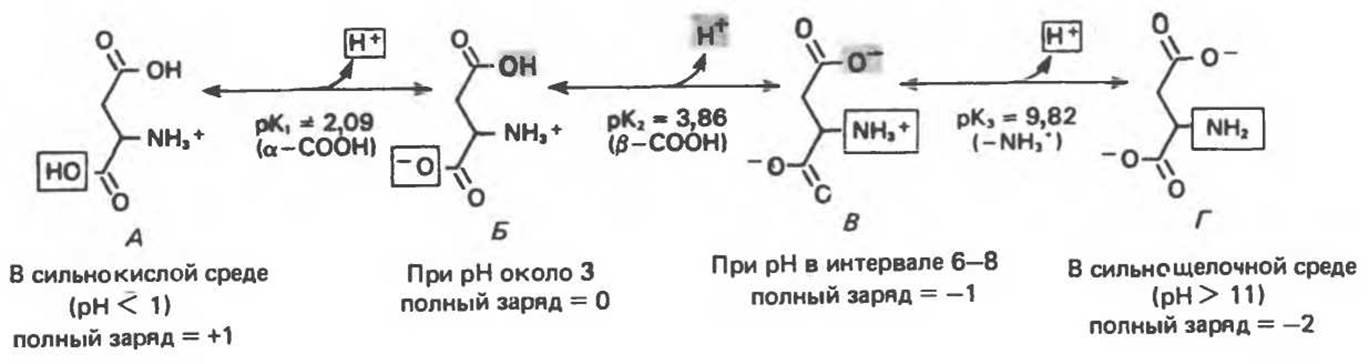
Рис. 3.4. Протонное равновесие для аспарагиновой кислоты.