Биохимия человека Том 1 - Марри Р. 1993
Метаболизм белков и аминокислот
Катаболизм азота аминокислот
Переаминирование
Переаминирование, катализируемое ферментами трансаминазами (аминотрансферазами), представляет собой взаимопревращение пары аминокислот и пары кетокислот. Обычно это а-аминокислоты и а-кетокислоты (рис. 30.3).
Пиридоксальфосфат является обязательным компонентом активного центра трансаминаз и многих других ферментов, для которых субстратами служат аминокислоты. Во всех пиридоксальфосфат-зависимых реакциях аминокислот начальной стадией является образование связанного с ферментом интермедиата — шиффова основания. Интермедиат стабилизируется путем взаимодействия с катионной областью активного центра; далее он перестраивается с освобождением кетокислоты и образованием связанного с ферментом пиридоксаминфосфата. Связанная аминоформа кофермента может затем взаимодействовать с кетокислотой, образуя аналогичное шиффово основание. Таким образом, в процессе переаминирования кофермент выполняет роль переносчика аминогруппы. Поскольку константа равновесия для большинства реакций переаминирования близка к единице, переаминирование является легко обратимым процессом. Это позволяет трансаминазам функционировать и в процессах катаболизма, и в процессах биосинтеза аминокислот.
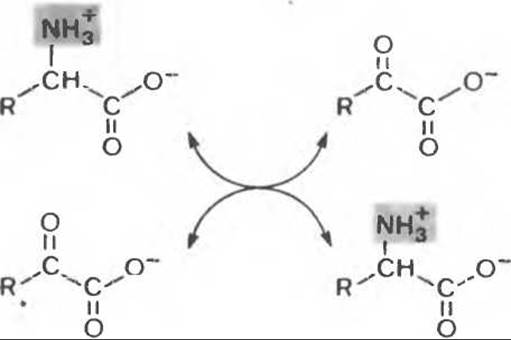
Рис. 30.3. Переаминирование. В реакции участвуют две а-аминокислоты и две а-кетокислоты. В переаминировании могут участвовать не только a-амино или а-карбонильные группы, но такие случаи относительно редки. Реакция легко обратима, константа равновесия близка к единице.
В большинстве тканей млекопитающих имеются две трансаминазы: аланин-пируват—трансаминаза (аланнновая трансаминаза) и глутамат-а-кетоглутарат—трансаминаза (глутамат-трансаминаза). Они катализируют перенос аминогрупп от большинства аминокислот с образованием аланина (из пирувата) или глутамата (из а-кетоглутарата) (рис. 30.4).
Каждая трансаминаза специфична к определенным парам амино- и кетокислот. Поскольку аланин может служить также субстратом глутаматтрансаминазы, аминный азот всех аминокислот, участвующих в переаминировании, может переходить в состав глутамата. Это очень важно, так как L-глутамат является единственной аминокислотой в тканях млекопитающих, которая может с существенной скоростью подвергаться окислительному дезаминированию. Таким образом, при образовании свободного аммиака из а-аминогрупп аминокислот он переходит главным образом в состав а-аминогруппы L- глутамата.
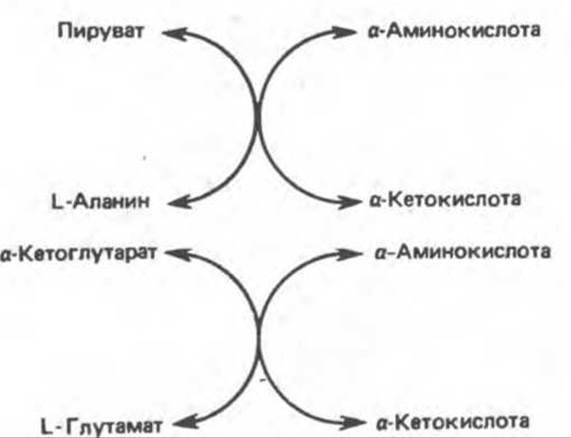
Рис. 30.4. Действие аланин-трансаминазы (вверху) и глутамат-трансаминазы (внизу).
Большинство аминокислот (но не все) являются субстратами трансаминаз. Исключение составляют лизин, треонин и циклические иминокислоты пролин и гидроксипролин. Переаминирование не ограничено только а-аминогруппами. Легко вступает в реакцию также 8-аминогруппа орнитина (но не ε-аминогруппа лизина), при этом образуется глутамат-у-полуальдегид (см. рис. 31.3). При некоторых заболеваниях наблюдается повышение концентрации трансаминаз в сыворотке (см. Приложение).