Биохимия человека Том 1 - Марри Р. 1993
Метаболизм белков и аминокислот
Катаболизм азота аминокислот
Окислительное дезаминирование
В печени и почках млекопитающих происходит окислительное превращение многих аминокислот в соответствующие кетокислоты. Большая часть активности в отношении L-a-аминокислот обусловлена сопряженным действием трансаминаз и L-глутаматдегидрогеназы, однако в печени и почках млекопитающих имеются также оксидазы L- и D- аминокислот; эти оксидазы имеются и у многих других животных и микроорганизмов. Однако не вполне ясно, какую физиологическую функцию выполняют оксидазы L- и D-аминокислот в тканях млекопитающих.
Оксидазы аминокислот являются автоокисляемыми флавопротеинами, т.е. восстановленные FMN или FAD окисляются непосредственно молекулярным кислородом (без участия цитохромов и других переносчиков электронов) с образованием перекиси водорода (Н2О2) (рис. 30.5). Токсичный продукт Н2О2 далее расщепляется на О2 и Н2О каталазой, широко распространенной в тканях (особенно много ее в печени). В отсутствие каталазы образующаяся а-кетокислота может декарбоксилироваться неферментативным путем перекисью водорода (Н2О2) с образованием карбоновой кислоты, имеющей на один атом углерода меньше. Впрочем, представляется маловероятным, чтобы такое декарбоксилирование играло какую-то роль в интактных тканях человека.
В реакциях, катализируемых оксидазами аминокислот (рис. 30.5), сначала происходит дегидрогенирование при участии флавопротеиновой оксидазы, приводящее к образованию a-иминокислоты. Последняя неферментативно присоединяет молекулу воды и превращается в соответствующую а-кетокислоту с потерей а-аминного азота в виде иона аммония.
Оксидаза L-аминокислот, являющаяся FMN- содержащим флавопротеином, у большинства млекопитающих находится только в почках и печени. Ее активность весьма низка, а на глицин, L-изомеры дикарбоновых аминокислот и ß-гидрокси-а-аминокислот она вообще не действует. Едва ли этот фермент играет существенную роль в катаболизме аминокислот у млекопитающих.
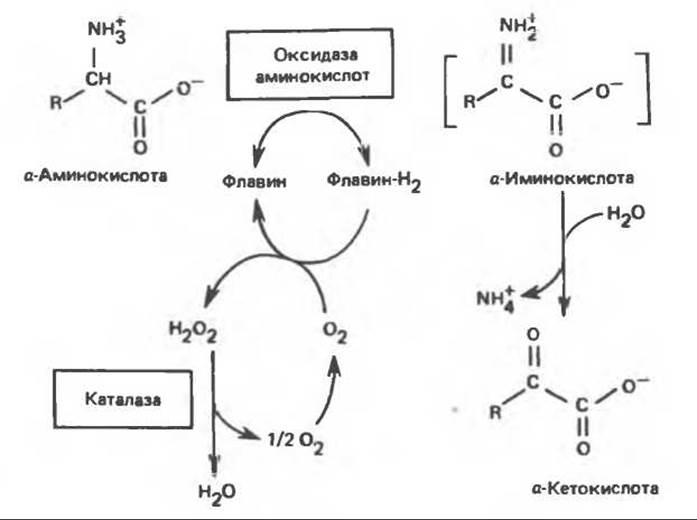
Рис. 30.5. Окислительное дезаминирование, катализируемое оксидазой L-аминокислот (L-a-аминокислота: кислород-оксидоредуктаза). Заключенная в скобки а-иминокислота является нестабильным интермедиатом
Оксидаза D-аминокислот у млекопитающих представляет собой FAD-coдержащий флавопротеин, обладающий широкой субстратной специфичностью, фермент обнаружен в печени и почках большинства млекопитающих. D-аспарагин и D-глутамин не окисляются этим ферментом, а глицин и D-изомеры кислых и основных аминокислот являются плохими субстратами. Физиологическое значение этого фермента у млекопитающих неизвестно.
L-Глутаматдегидрогеназа
Аминогруппы большинства аминокислот в конечном итоге путем переаминирования переносятся на a-кетоглутарат с образованием глутамата (рис. 30.2). Освобождение азота аминогруппы глутамата в виде аммиака катализируется L-глутаматдегидрогеназой — ферментом с высокой активностью, широко распространенным в тканях млекопитающих (рис. 30.6). Глутаматдегидрогеназа печени является регуляторным ферментом; ее активность ингибируется аллостерическими эффектами, такими, как ATP, GTP и NADH, и стимулируется ADP. На активность глутаматдегидрогеназы влияют некоторые гормоны.
Глутаматдегидрогеназа может использовать в качестве косубстрата как NAD+, так и NADP+. Реакция обратима и функционирует в процессах как катаболизма, так и биосинтеза аминокислот. Поэтому ее функция заключается не только в том, чтобы направлять азот из глутамата для синтеза мочевины (катаболизм), но также и в том, чтобы катализировать аминирование a-кетоглутарата свободным аммиаком (см. гл. 29).
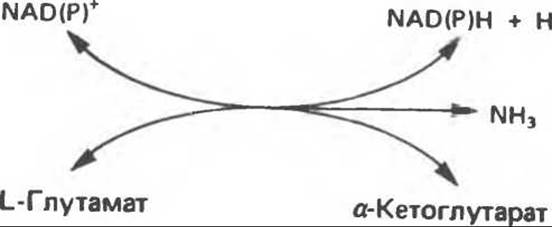
Рис. 30.6. Реакция, катализируемая L-глутаматдегидрогеназой. NAD(P)+ означает либо NAD+, либо NADP+, т. е. что оба кофермента могут быть использованы в качестве косубстратов. Реакция обратима, но константа равновесия ее благоприятна для образования глутамата.