Биохимия человека Том 1 - Марри Р. 1993
Метаболизм белков и аминокислот
Катаболизм азота аминокислот
Биосинтез мочевины
Общая картина
Умеренно активный человек, потребляющий в день около 300 г углеводов, 100 г жира и 100 г пищевого белка, должен за сутки выделять около 16,5 г азота. 95% азота удаляется через почки и остальные 5% — в составе фекалий. Главный путь экскреции азота у человека — в составе мочевины, которая синтезируется в печени, затем поступает в кровь и экскретируется почками. У людей с режимом питания, характерным для западных стран, на долю мочевины приходится 80—90% экскретируемого азота.
Реакции цикла мочевины
Реакции биосинтеза мочевины и соответствующие интермедиаты представлены на рис. 30.13; в образовании 1 моля мочевины участвуют 1 моль ионов аммония. 1 моль двуокиси углерода (активируемой Mg2+ и АТР) и 1 моль а-аминного азота аспартата. В ходе синтеза потребляются 3 моля АТР (2 из них превращаются в ADP и Pi, а третий — в АМР и РРі), в нем последовательно участвуют пять ферментов, катализирующих реакции 1—5 на рис. 30.13. Из 6 аминокислот, вовлекаемых в синтез мочевины, одна (N-ацетилглутамат) служит активатором одного из ферментов и в химических превращениях не участвует. Остальные пять — аспартат, аргинин, орнитин, цитруллин и аргининосукцинат — служат переносчиками атомов, которые в итоге образуют молекулу мочевины. Первые две из этих аминокислот входят в состав белков, тогда как три другие (орнитин, цитруллин и аргининосукцинат) в состав белков не входят. Главной метаболической ролью этих трех последних аминокислот у млекопитающих является участие в синтезе мочевины. Обратите внимание, что образование мочевины является частично циклическим процессом. Орнитин, участвующий в реакции 2, регенерируется в ходе реакции 5. Таким образом, ни потерь, ни накопления орнитина, цитруллина, аргининосукцината и аргинина в ходе синтеза мочевины не происходит; потребляются только ион аммония, СO2, АТР и аспартат.
Реакция 1: синтез карбамоилфосфата. Конденсация иона аммония, двуокиси углерода и фосфата (поступаюшего от АТР), которая приводит к образованию карбамоилфосфата, катализируется карбамоилфосфатсинтазой — ферментом, находящимся в митохондриях печени всех уреотелических организмов, включая человека. Осуществляемый в ходе этой реакции гидролиз двух молекул АТР обеспечивает энергией образование двух ковалентных связей: амидной связи и ангидридной связи при образовании карбамоилфосфата из карбоновой и фосфорной кислот. Для данной реакции требуются ионы Mg2+, а также дикарбоновая кислота, предпочтительно N-ацетилглутамат. В присутствии этих соединений происходят значительные конформационные изменения структуры карбамоилфосфатсинтазы, в результате которых одни сульфгидрильные группы экспонируются, другие экранируются и увеличивается сродство фермента к АТР.
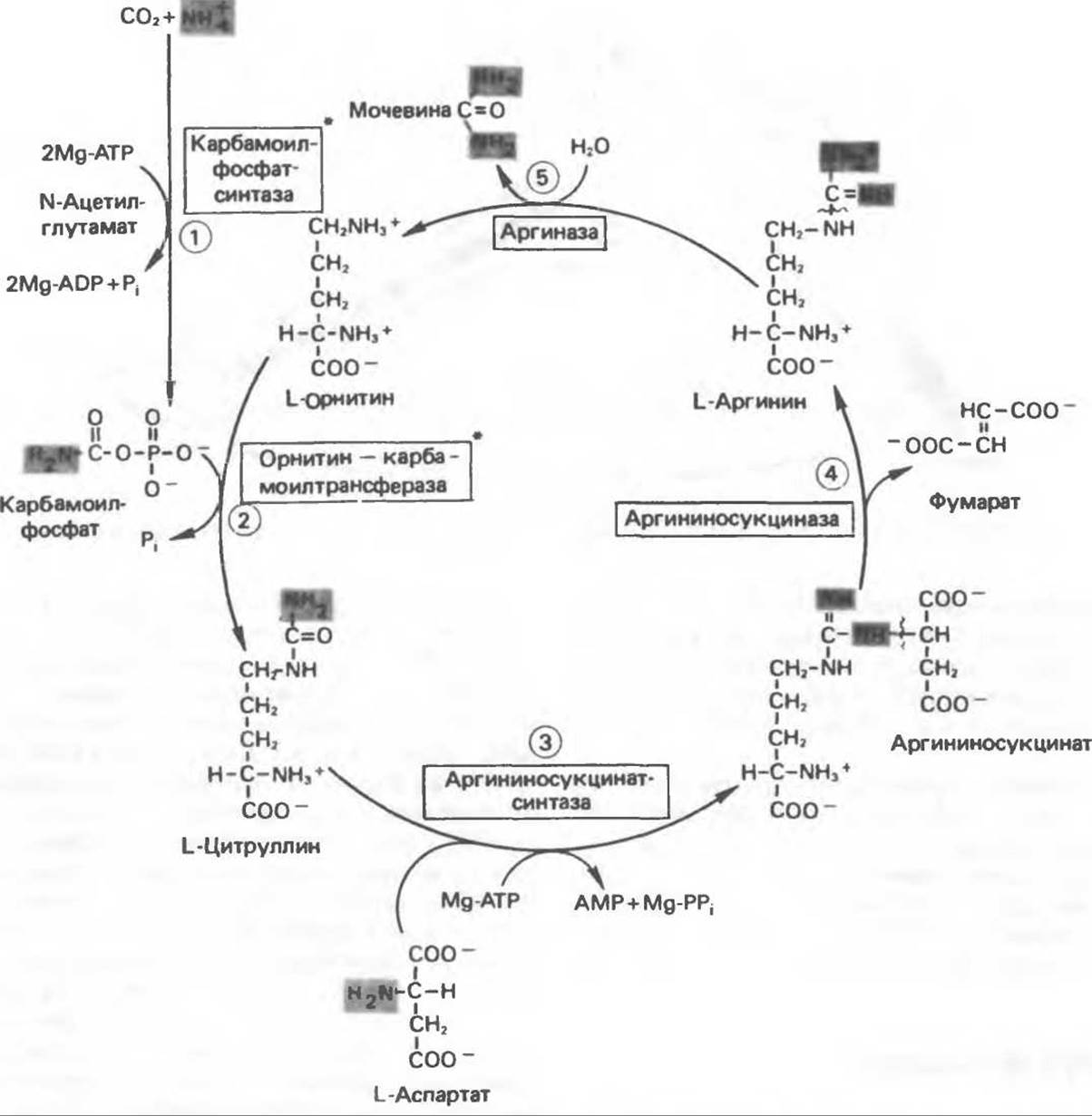
Рис. 30.13. Реакции и интермедиаты при биосинтезе мочевины. Вылечены амины, непосредственно участвующие в образовании мочевины. Звездочкой отмечены митохондриальные ферменты.
Реакция 2: синтез цитруллина. Перенос карбамоильной группы с карбамонлфосфата на орнитин с образованием цитруллина и Pі катализируется L-орнитин-карбамоилтрансферазой митохондрий печени. Реакция высокоспецифична к орнитину, равновесие ее сильно сдвинуто в направлении синтеза цитруллина.
Реакция 3: синтез аргининосукцината. В реакции, катализируемой аргининосукцинат-синтазой, к цитруллину присоединяется аминогруппа аспартата. Для реакции требуется АТР, равновесие сильно сдвинуто в направлении синтеза аргининосукцината.
Реакция 4: расщепление аргининосукцината на аргинин и фумарат. Обратимое расщепление аргининосукцината на аргинин и фумарат катализируется аргининосукциназой — ферментом, находящимся в печени и почках млекопитающих. Реакция протекает по механизму транс-элиминирования. Образовавшийся фумарат может превратиться в оксалоацетат в ходе реакций, катализируемых фумаразой и малатдегидрогеназой; оксалоацетат при переаминировании превращается в аспартат.
Реакция 5: расщепление аргинина на орнитин и мочевину. Эта реакция завершает цикл мочевины и регенерирует орнитин, субстрат реакции 2. Гидролитическое отщепление гуанидиновой группы аргинина катализируется аргиназой, присутствующей в печени всех уреотелических организмов. В небольших количествах аргиназа обнаружена также в почках, мозгу, молочных железах, семенниках и в коже. Аргиназа из печени млекопитающих активируется ионами Са2+ или Мn2+. Сильными ингибиторами фермента являются орнитин и лизин, конкурирующие с аргинином.