Биохимия человека Том 1 - Марри Р. 1993
Метаболизм белков и аминокислот
Порфирины и желчные пигменты
Порфирины
Порфирины представляют собой циклические соединения, образованные четырьмя пиррольными кольцами, связанными между собой метенильными мостиками (рис. 33.1). Характерным свойством порфиринов является их способность образовывать комплексы с ионами металлов, связывающимися с атомами азота пиррольных колец. Примерами служат железопорфирины, в частности гем, входящий в состав гемоглобина, и магний-coдержащий порфирин хлорофилл — пигмент растений, участвующий в фотосинтезе.
В природе металлопорфирины связываются с белками, в результате образуются соединения, играющие важную роль в биологических процессах. К ним относятся:
A. Гемоглобин — железопорфирины, связанные с белком глобином. Гемоглобины обладают способностью обратимо связывать кислород, они транспортируют этот газ в системе кровообращения (см. гл. 6). Структура гема показана на рис. 6.2.
Б. Эритрокруорнны — железопорфиринопротеины, находящиеся в крови и тканевых жидкостях некоторых беспозвоночных; выполняют такую же функцию, как и гемоглобин.
B. Миоглобины — дыхательные пигменты, находящиеся в мышечных клетках позвоночных и беспозвоночных. Примером служит миоглобин из сердечной мышцы лошади, закристаллизованный Теореллом в 1934 г. Молекула миоглобина сходна по структуре с субъединицей гемоглобина.
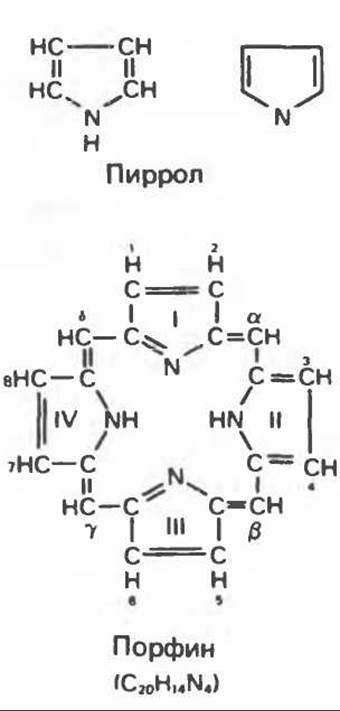
Рис. 33.1. Молекула порфина. Кольца обозначены цифрами I, II, III и IV. Места присоединения замещающих групп обозначены номерами 1, 2, 3, 4, 5, 6, 7, 8. Метенильные мостики обозначены буквами а, ß, у и δ.
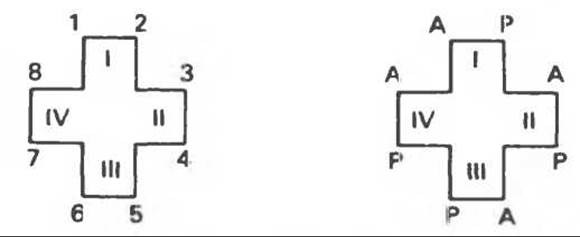
Рис. 33.2. Уропорфирин III.
Г. Цитохромы — соединения, функционирующие как переносчики электронов в окислительновосстановительных реакциях. Важным примером служит цитохром с, молекулярная масса которого составляет около 13000, содержащий 1 грамм-атом железа на моль белка.
Д. Каталазы — железопорфириновые ферменты; несколько каталаз получено в кристаллическом виде. В растениях каталазная активность незначительна, сходные функции у них выполняет другой железопорфириновый фермент — пероксидаза.
Е. Триптофаипирролаза. Этот фермент катализирует окисление триптофана в формилкинуренин. Он также является железопорфириновым белком.
Структура порфиринов
Встречающиеся в природе порфирины являются соединениями, у которых 8 атомов водорода порфиринового ядра замещены различными боковыми группами, как показано на рис. 33.1. Упрощенный способ изображения положения заместителей предложен Фишером: пиррольные кольца (без метенильных мостиков) изображаются как выступы крестообразной структуры, пронумерованные вершины которой являются местами присоединения заместителей (рис. 33.2). Различные порфирины показаны на рис. 33.2, 33.3 и 33.4; использованы следующие сокращения:
А (ацетат) = —СН2СООН; Р (пропионат) = —СН2СН2СООН; М(метил) = —CH3; V (винил) = —СН = СН2.
Расположение замещающих группы А и Р в уроорфирине асимметрично (в кольце IV по сравнению с другими кольцами порядок присоединения ацетатных и пропионатных групп изменен на обратный). Порфирин с такого типа асимметричным замещением классифицируется как порфирин типа III. Порфирин с полностью симметричным расположением замещающих групп классифицируется как порфирин типа I. В природе встречаются только порфирины типа I и III, причем тип III встречается значительно чаще (рис. 33.3).
Оба соединения, приведенные на рис. 33.4, относятся к порфиринам типа III (метальные группы расположены асимметрично, как в копропорфирине типа III). Однако иногда их классифицируют как принадлежащие к типу IX, поскольку они оказались на девятом месте в серии изомеров, постулированных Гансом Фишером, автором пионерских исследований в области химии порфиринов.
Биосинтез порфиринов
Хлорофилл — растительный пигмент фотосинтезирующей системы и гем — железопротопорфирин гемоглобина животных синтезируются в живых клетках по общему метаболическому пути. Исходным материалом являются «активный сукцинат» — сукцинил-СоА, образующийся в митохондриях в реакциях цикла лимонной кислоты, и аминокислота глицин. Необходима также «активация» глицина пиридоксальфосфатом. Вероятно, глицин образует с пиридоксалем шиффово основание; далее а-углерод глицина присоединяется к карбонильному углероду сукцината. Продуктом реакции конденсации глицина с сукцинил-СоА является а-амино-β-кетоадипиновая кислота, она быстро декарбоксилируется с образованием δ-аминолевулината (АЛК) (рис. 33.5). Эта стадия катализируется ферментом АЛК-синтазой. Вероятно, именно этот фермент является скорость- контролирующим при биосинтезе порфиринов в печени млекопитающих. Синтез аминолевулиновой кислоты происходит в митохондриях. В цитозоле фермент АЛК-дегидратаза катализирует конденсацию двух молекул АЛК с образованием двух молекул воды и одной молекулы порфобилиногена (рис. 33.5). АЛК-дегидратаза является Zn-содержащим ферментом и ингибируется ионами свинца.
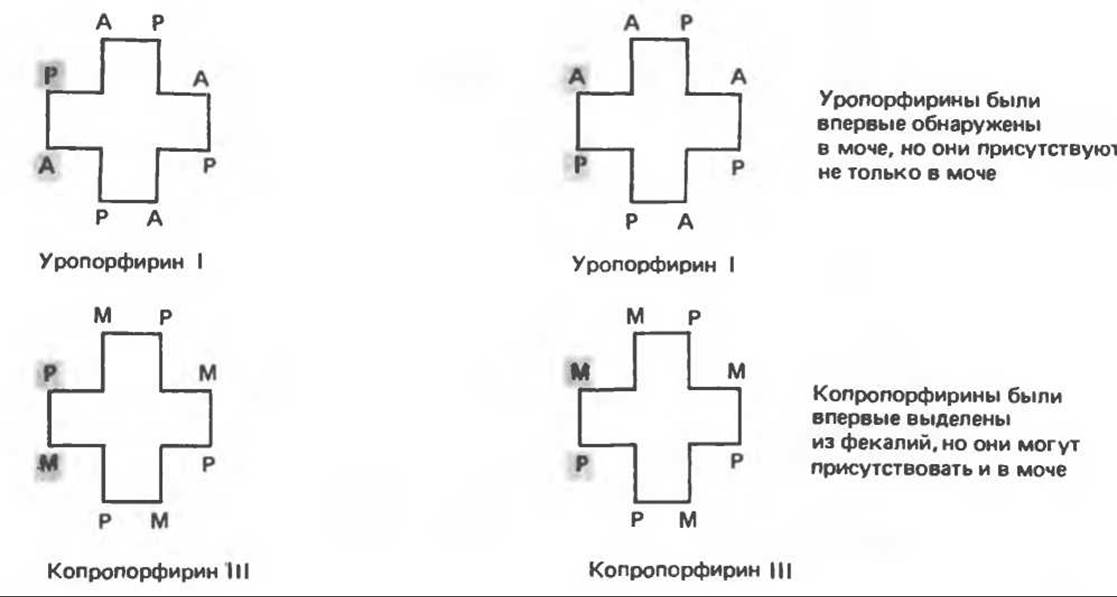
Рис. 33.3. Уропорфирины и копропорфирины.
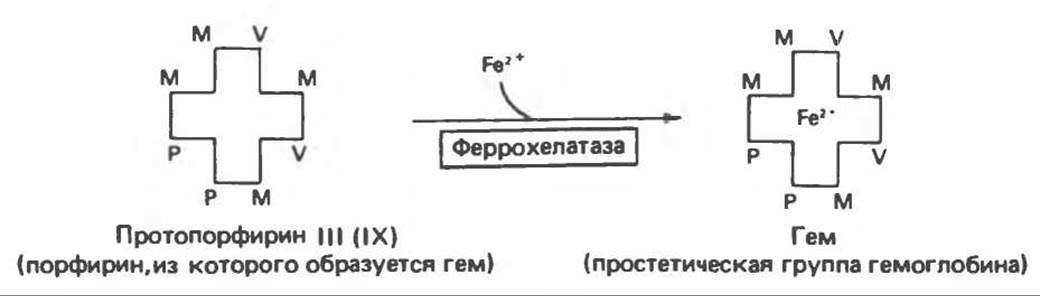
Рис. 33.4. Присоединение железа к протопорфирину приводит к образованию гема.
Образование тетрапиррола (т. е. порфирина) осуществляется путем конденсации четырех монопирролов, образующихся из порфобилиногена (рис. 33.6). Несущий аминогруппу углерод молекулы порфобилиногена («бывший» а-углерод глицина) становится углеродом метиленовой группы (а, ß, у, δ), соединяющей соседние пиррольные кольца в тетрапиррольную структуру. Хотя превращение порфибилиногена в порфирин может происходить просто при нагревании в кислой среде (например, в кислой моче), в тканях это превращение катализируется специфическими ферментами.
Как уже было отмечено выше, в природе встречаются только порфирины типов I и III; то обстоятельство, что более широко представлены изомеры типа III, можно объяснить тем, что биологически важные порфирины (гем и цитохромы) являются изомерами типа III.
В настоящее время детали образования уропорфириногенов путем конденсации порфобилиногенов не ясны. Образование из порфобилиногена уропорфириногена III, интермедиата при биосинтезе гема, катализируется комплексом двух ферментов. Уропорфириноген-І-синтаза, называемая также порфобилиноген-дезаминазой, катализирует in vitro конденсацию порфобилиногена в уропорфириноген I (рис. 33.6). Однако в присутствии второго фермента — уропорфнриноген-III-косинтазы в результате взаимодействия двух ферментов происходит образование уропорфириногена III, а не его симметричного изомера (уропорфириногена I) (рис. 33.6). При нормальных условиях образуется почти исключительно изомер типа III, но при некоторых видах порфирии (рассматриваемых ниже) синтезируются в значительном количестве изомеры типа I.
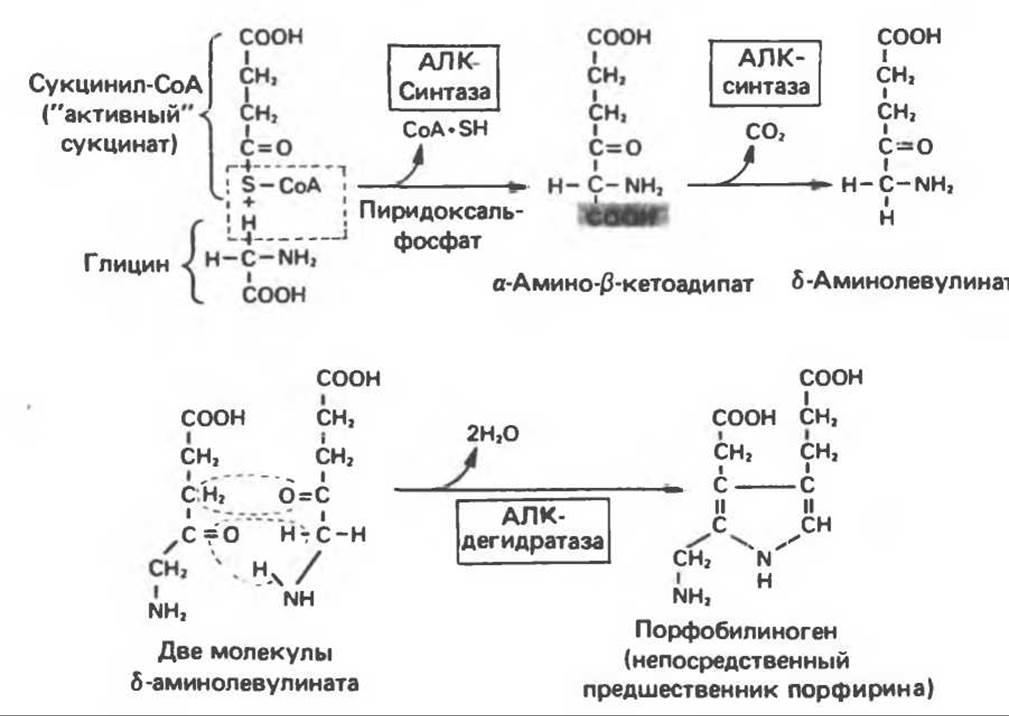
Рис. 33.5. Биосинтез порфобилиногена. АЛК-синтаза находится в митохондриях, тогда как АЛК-дегидратаза находится в цитозоле.
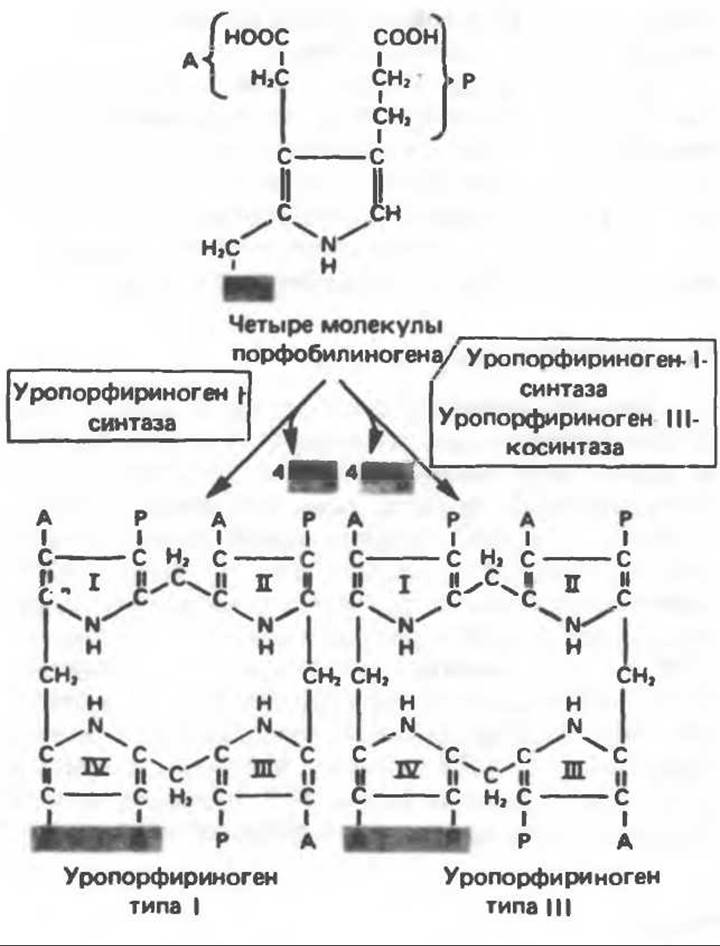
Рис. 33.6. Превращение порфобилиногена в уропорфириногены.
Обратите внимание, что в этих уропорфириногенах пиррольные кольца соединены метиленовыми мостиками, т.е. у них нет сопряженной системы. Поэтому эти соединения (и вообще все порфириногены) бесцветны. Однако порфириногены легко подвергаются автоокислению в соответствующие порфирины. Окисление стимулируется светом и уже образовавшимися порфиринами.
Уропорфириноген III превращается в копропорфириноген III путем декарбоксилирования всех ацетатных групп (А), вместо которых остаются метальные группы (М). Эта реакция катализируется уропорфириноген-декарбоксилазой, которая также способна катализировать превращение уропорфириногена I в копропорфириноген I (рис. 33.7). Копропорфириноген III далее поступает в митохондрии, где превращается в протопорфириноген III, а затем в протопорфирин III. Это превращение, вероятно, включает несколько стадий. Митохондриальный фермент копропорфириногеноксидаза катализирует декарбоксилирование и окисление двух пропионовых боковых цепей, это приводит к образованию протопорфириногена. Этот фермент действует только на копропорфириноген типа III, чем, по-видимому, и объясняется отсутствие протопорфирина типа I в природных материалах. Окисление протопорфириногена в протопорфирин катализируется другим митохондриальным ферментом — протопорфириногеноксидазой. В печени млекопитающих превращение копропорфириногена в протопорфирин требует присутствия молекулярного кислорода.
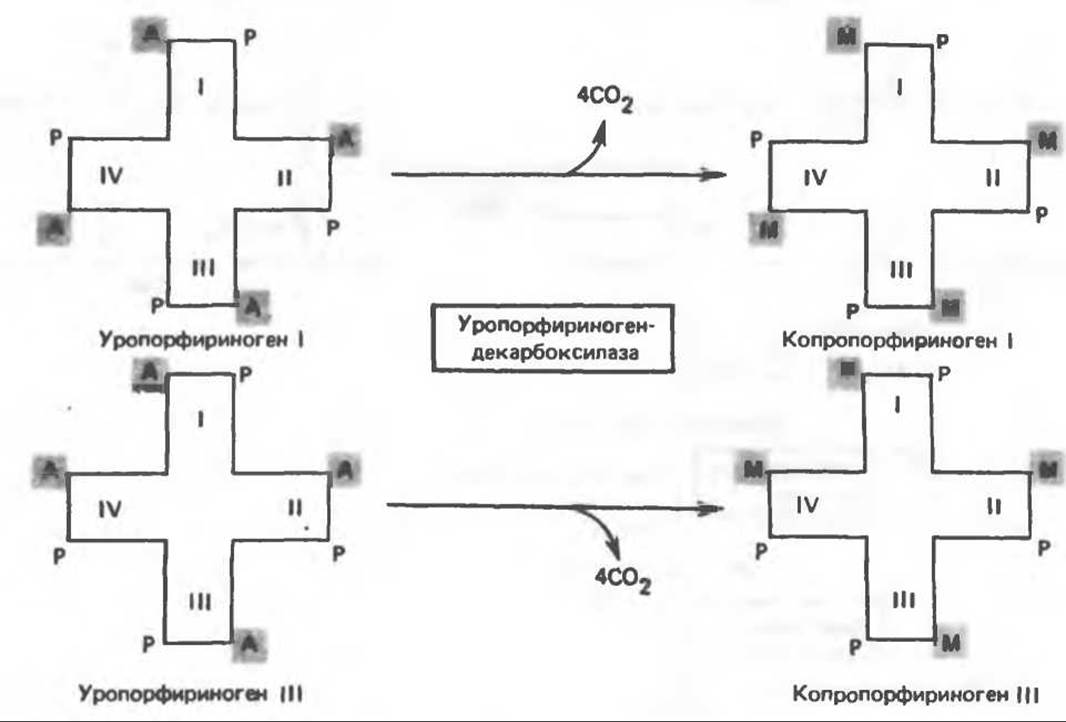
Рис. 33.7. Декарбоксилирование уропорфириногенов с образованием копропорфириногенов (в цитозоле). А — ацетатная группа, М — метильная группа, Р — пропионильная группа.
Образование гема
Завершающей стадией синтеза гема является включение в протопорфирин двухвалентного железа; эта реакция катализируется митохондриальным ферментом гем-синтазой или феррохелатазой (рис. 33.4). Реакция легко идет и в отсутствие фермента, однако при добавлении тканевых препаратов ее скорость намного выше благодаря присутствию в тканях ферментов, катализирующих образование хелатов железа.
Сводная схема биосинтеза производных порфирина из порфобилиногена представлена на рис. 33.8. Биосинтез гема идет в большинстве тканей млекопитающих, за исключением зрелых эритроцитов, которые не содержат митохондрий.
Описанные выше порфириногены бесцветны и по сравнению с соответствующими окрашенными порфиринами содержат 6 дополнительных атомов водорода. В настоящее время ясно, что именно эти восстановленные порфирины (порфириногены), а не соответствующие порфирины являются интермедиатами при биосинтезе протопорфирина и гема.
Регуляция биосинтеза гема
Скорость-лимитирующей реакцией синтеза гема является конденсация сукцинил-СоА и глицина, приводящая к образованию АЛК (рис. 33.5); эта реакция катализируется синтазой аминолевулиновой кислоты (АЛК-синтазой). В нормальных тканях, способных осуществлять синтез гема, уровень АЛК-синтазной активности значительно ниже уровня других ферментов, участвующих в синтезе гема. Однако АЛК-синтаза является регуляторным ферментом. Полагают, что гем путем взаимодействия с молекулой апорепрессора является отрицательным регулятором синтеза АЛК-синтазы. Механизм репрессии схематически показан на рис. 33.9. Вероятно, на этой стадии происходит также ингибирование гемом по принципу обратной связи, однако главный регуляторный эффект гема состоит в том, что синтез АЛК-синтазы значительно ускоряется в отсутствие гема и замедляется в его присутствии. Скорость обновления АЛК-синтазы в печени млекопитающих в норме велика (время полужизни около 1 ч), что не является неожиданным для фермента, катализирующего скорость-лимитирующую реакцию.
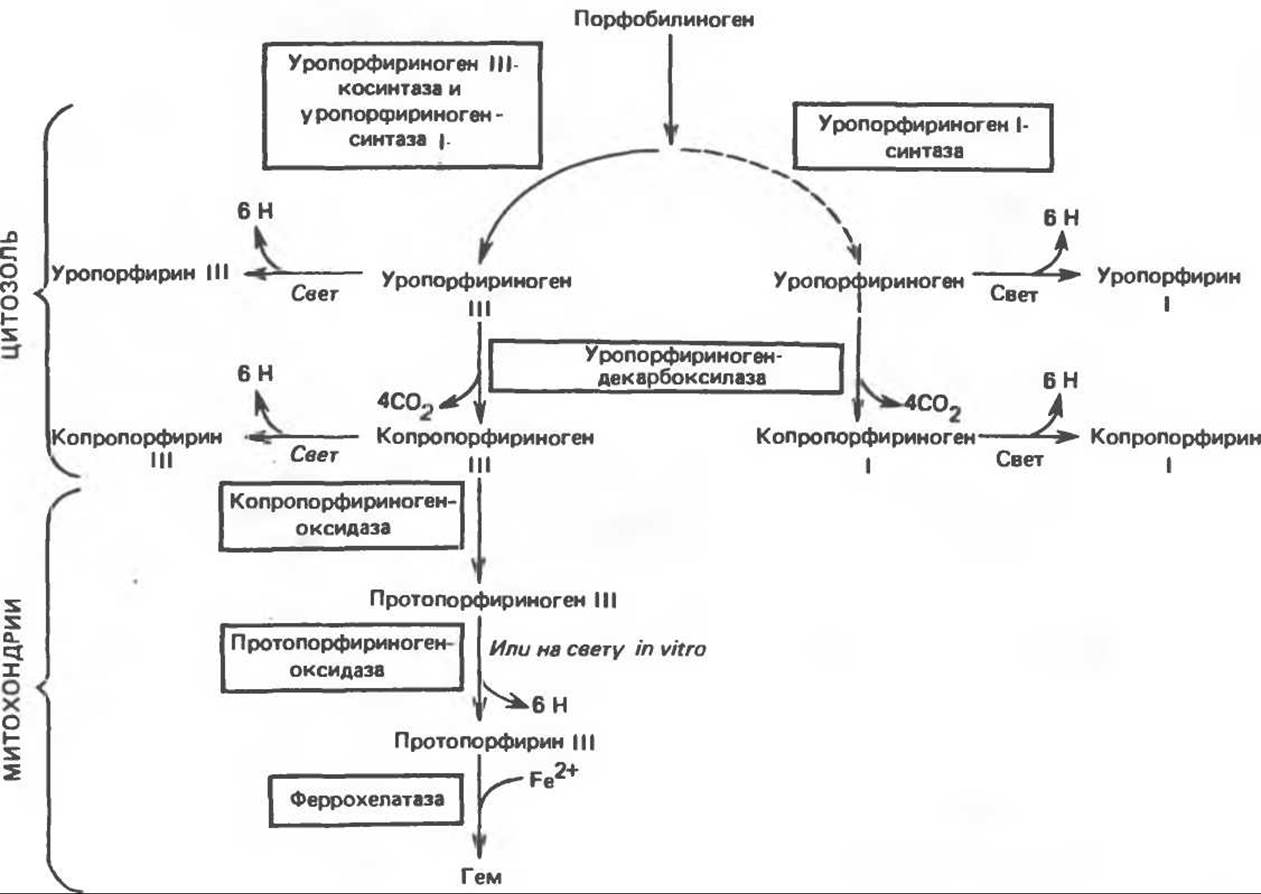
Рис. 33.8. Стадии биосинтеза производных порфирина из порфобилиногена.
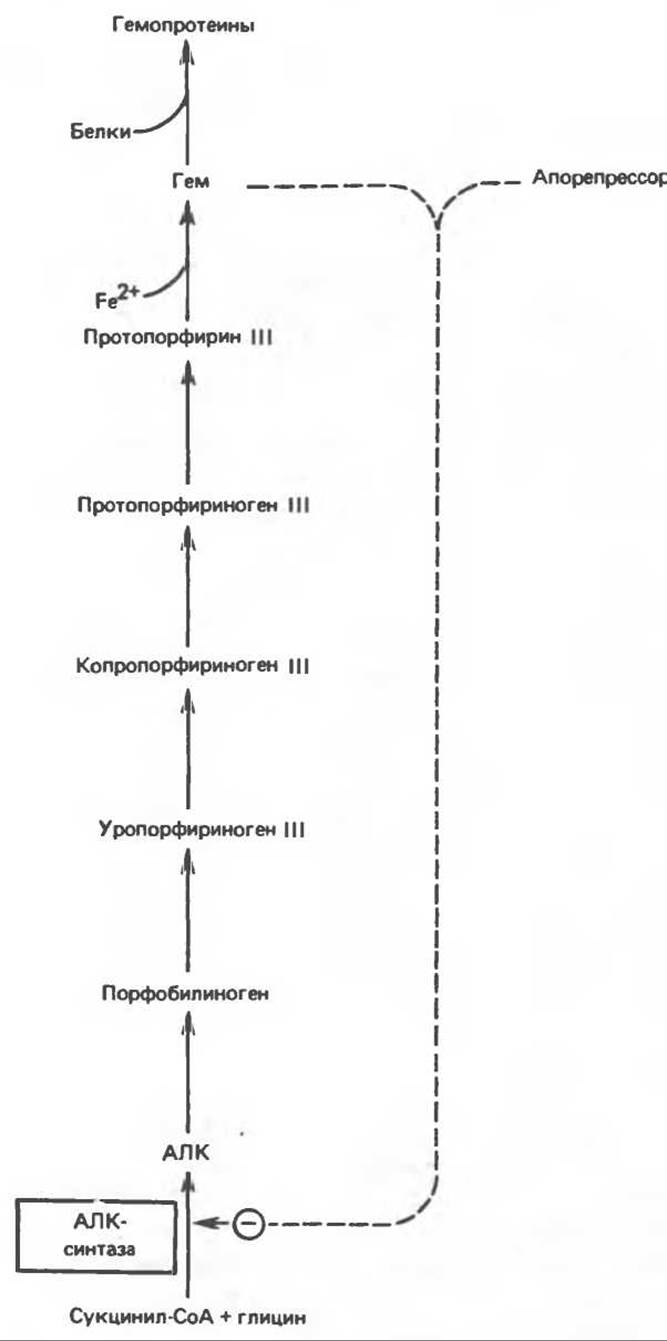
Рис. 33.9. Регуляция синтеза гема на стадии, катализируемой АЛК-синтазой, по механизму репрессии и дерспрессии синтеза АЛК-синтазы с участием гема и его гипотетического апорепрессора. Штриховая линия показывает отрицательную (⊝) регуляцию путем репрессии синтеза АЛК-синтазы.
Многие соединения различной структуры, включая применяемые в настоящее время инсектициды, канцерогенные и фармацевтические препараты, могут значительно повышать содержание в печени АЛК-синтазы. Большинство лекарственных соединений метаболизируется в печени системой, в которую входит специфический гемопротеин цитохром Р-450. В процессе метаболизма этих соединений значительно возрастает потребление гема системой цитохрома Р-450, в результате чего внутриклеточная концентрация гема снижается. Это в свою очередь вызывает дерепрессию синтеза АЛК-синтазы и как следствие — повышение скорости синтеза гема для обеспечения потребностей клетки.
На индукцию АЛК-синтазы в печени оказывают действие и некоторые другие факторы. Глюкоза может тормозить индукцию АЛК-синтазы; железо в хелатной форме оказывает синергический эффект при индукции печеночной АЛК-синтазы; стероиды способствуют дерепрессии АЛК-синтазы in vivo лекарственными препаратами. Введение же в организм гематина может препятствовать дерепрессии АЛК-синтазы (подобное же действие характерно и для гемопротеинов). В эритропоэтических тканях активность АЛК-синтазы возрастает при гипоксии, в то же время на активность АЛК-синтазы в печени гипоксия не оказывает влияния.
Важная роль этих регуляторных механизмов будет обсуждаться ниже, когда будут рассматриваться заболевания, относящиеся к группе порфирий.
Химия порфиринов
Благодаря присутствию третичных азотов в двух пирроленовых кольцах порфирины обладают свойствами слабых оснований. Порфирицы же, содержащие карбоксильные группы в одной или нескольких боковых цепях, являются также и кислотами. Их изоэлектрические точки находятся в пределах значений 3,0—4,5; в области этих значений pH порфирины легко выпадают в осадок.
Различные порфириногены бесцветны, тогда как все порфирины окрашены. При изучении порфиринов и их производных большое значение имеют характерные, для них спектры поглощения как в видимой, так и в ультрафиолетовой области. Примером может служить кривая поглощения раствора порфирина в 5%-ной соляной кислоте (рис. 33.10). Обратите внимание на резкий максимум поглощения вблизи длины волны 400 нм. Это отличительный признак порфинового ядра, характерный для всех порфиринов независимо от природы боковых цепей. Этот максимум называют полосой Соре, по имени ее первооткрывателя. Гематопорфирин в кислой среде имеет помимо полосы Соре два более слабых максимума при 550 и 592 нм.
Если растворы порфиринов в сильных минеральных кислотах или органических растворителях облучать ультрафиолетовым светом, они испускают интенсивное красное флуоресцентное свечение. Эта флуоресценция столь характерна, что часто используется для обнаружения малых количеств свободных порфиринов. Поглощение и флуоресценция порфиринов обусловлены наличием двойных связей; как уже упоминалось, восстановление метенильных (—НС =) мостиков (путем присоединения водородов) в метиленовые (—СН2—) приводит к образованию бесцветных порфиркиогенов.
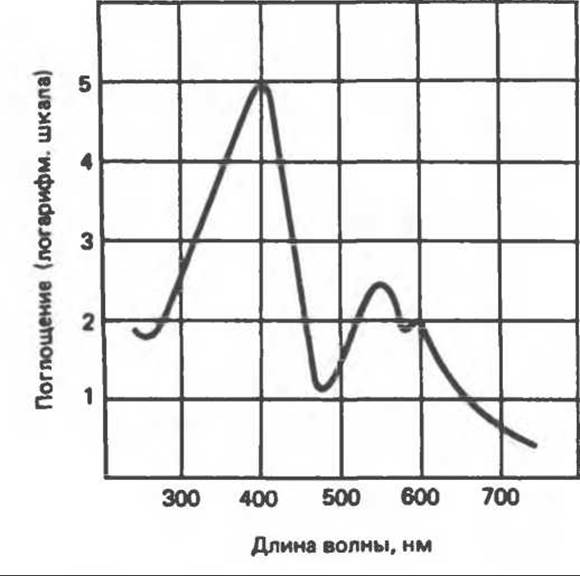
Рис. 33.10. Спектр поглощения гематопорфирина (0,01%-ный раствор гематопорфирина в 5%-ной НСl).
Присоединение металла к порфирину изменяет его спектр поглощения в видимой области. Примером может служить протопорфирин — предшественник гема, свободный от железа. В щелочном растворе в спектре порфирина имеется несколько узких и интенсивных полос поглощения (при 645, 591 и 540 нм), тогда как для гема характерна широкая полоса поглощения в виде плато, простирающегося от 540 до 580 нм.
Определение порфиринов
Копропорфирины и уропорфирины представляют значительный клинический интерес, поскольку при порфириях наблюдается увеличение экскреции этих соединений. Копропорфирины I и III растворимы в смесях эфира и ледяной уксусной кислоты, из которых их можно затем экстрагировать соляной кислотой. Уропорфирины, напротив, в этих смесях нерастворимы, но частично растворимы в этилацетате, и их можно экстрагировать соляной кислотой. Полученные солянокислые растворы при облучении ультрафиолетовым светом дают характерное красное флуоресцентное свечение. Характерные полосы поглощения могут быть зарегистрированы с помощью спектрофотометра.
Таблица 33.1. Верхние пределы нормальной экскреции порфиринов и их предшественников и содержание их в эритроцитах 1)
|
Моча (мкг∙сут-1) |
Фекалии (мкг/г сухой массы) |
Эритроциты (мкг/100 мл клеточной суспензии) |
|
|
АЛК |
4000 |
— |
— |
|
Порфобилиноген |
1500 |
— |
— |
|
Уропорфирин |
50 |
5 |
Следы |
|
Копропорфирин |
300 |
50 |
3 |
|
Протопорфирин |
— |
120 |
80 |
1) Воспроизведено (с разрешения), с изменениями, из обзора Meyer U. A., Schmid R. The porphyrias. In: The Metabolic Basis of Inherited Disease, 4th ed. Stanbury J. B., Wyngaarden J. B., Fredrickson D.S. (eds). McGraw-Hill, 1978.
В табл. 33.1 приведены верхние пределы нормальной экскреции порфиринов и их предшественников. У здоровых людей содержание в моче копропорфиринов составляет в среднем около 67 мкг∙сут-1; на изомер типа I приходится в среднем 14 мкг∙сут-1, на изомер типа III — 53 мкг∙сут-1. Отклонение от этого нормального соотношения при экскреции копропорфиринов типа I и III может служить диагностическим признаком при некоторых заболеваниях печени.
Последовательно образующиеся в процессе синтеза гема из АЛК интермедиаты становятся все более гидрофобными. Образование копропорфириногена сопровождается удалением ацетильных групп уропорфириногена; при превращении копропорфириногена в протопорфириноген происходит декарбоксилирование двух пропионильных групп. Это повышение гидрофобности отражается на распределении интермедиатов биосинтеза гема в составе мочи и фекалий. Более полярный уропорфириноген экскретируется преимущественно с мочой, тогда как более гидрофобные копропорфириноген и протопорфириноген оказываются преимущественно в желчи и удаляются в составе фекалий.