Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Пептиды
Конформация пептидов в растворе
Теоретически пептид может находиться в самых разнообразных конформационных состояниях (т.е. иметь множество вариантов пространственного расположения атомов). Однако, судя по имеющимся данным, в растворе диапазон возможных конформаций невелик. Наличие преимущественных конформаций обусловлено такими факторами, как стерические ограничения, кулоновские взаимодействия, водородные связи и гидрофобные взаимодействия (гл. 5). Как и в случае белков, физиологическая активность полипептидов (например, ангиотензина и вазопрессина) тоже зависит от их конформации (гл. 45, 48).
Физиологически активные пептиды
Животные, растительные и бактериальные клетки содержат множество разных полипептидов (от 3 до 100 аминокислотных остатков), обладающих высокой физиологической активностью. Некоторые из них, в частности большинство полипептидных гормонов млекопитающих, содержат только пептидные связи, образованные между а-амино- и а- карбоксильной группами двадцати L-а-аминокислот, входящих в состав белков. Однако в полипептидах (но не в белках) могут содержаться и другие аминокислоты или производные обычных, встречающихся в белках, аминокислот. Приведем несколько примеров такого рода.
Короткие полипептиды брадикинин и каллидин вызывают расслабление гладких мышц и являются продуктами ограниченного протеолиза специфических белков плазмы. Поскольку эти пептиды происходят из белков, они содержат только аминокислоты, встречающиеся в белках:

Глутатион (рис. 4.4) встречается во всех видах организмов; это атипичный трипептид, в котором N-концевой глутамат и цистеин связаны не а-пептидной связью. В организме человека и других животных глутатион необходим для работы ряда ферментов. По имеющимся представлениям, глутатион вместе с ферментом глутатионредуктазой участвует в образовании «правильных» дисульфидных связей во многих белках и полипептидных гормонах (гл. 5).
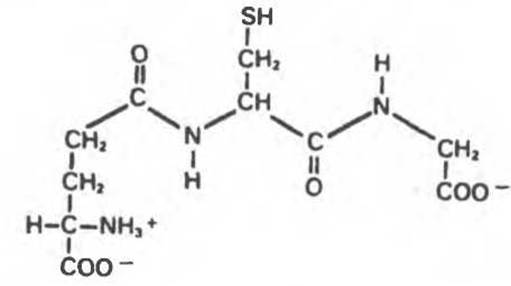
Рис. 4.4. Глутатион (у-глутамилцистеинилглицин).
Полипептидные антибиотики, синтезируемые грибами, часто содержат как D-, так и L- аминокислоты, а также некоторые аминокислоты, не встречающиеся в белках. Примерами могут служить тироцидин и грамицидин S—циклические полипептиды, содержание D-фенилаланин и «небелковую» аминокислоту орнитин. Синтез этих полипептидов осуществляется не в рибосомах.
Еще одним примером служит тиреолиберин (рис. 4.5). Его N-концевой глутамат циклизован с образованием остатка пироглутаминовой кислоты, а С- концевая карбоксильная группа пролина амидирована.
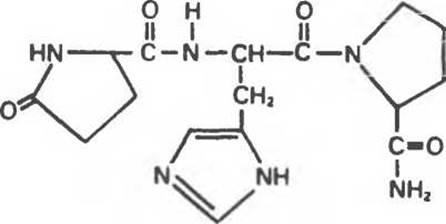
Рис. 4.5. Тиреолиберин (пироглутамилгистидилпролинамид).
В организме млекопитающих синтезируется полипептид, включающий несколько полипептидов, потенциально обладающих физиологической активностью. ß-Липотропин — гипофизарный гормон, стимулирующий освобождение жирных кислот из жировой ткани, — содержит аминокислотные последовательности, идентичные последовательностям некоторых других полипептидных гормонов с иной физиологической активностью (рис. 4.6). Этот высокомолекулярный полипептид служит предшественником полипептидов меньшего размера.