Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Пептиды
Определение аминокислотного состава пептидов
Прежде всего путем гидролиза разрушают пептидные связи. Поскольку при нейтральных pH пептидные связи стабильны, применяют кислотный или щелочной катализ. Ферментативный катализ для полного гидролиза менее пригоден. Полный гидролиз белка на составляющие аминокислоты неизбежно сопровождается частичной потерей некоторых аминокислотных остатков. Лучше всего проводить гидролиз в 6 и. HCl при 110 °С в вакуумированной ампуле. В этих условиях полностью разрушаются триптофан к цистеин и частично цистин. В присутствии металлов наблюдается частичная потеря метионина и тирозина. Глутамин и аспарагин количественно дезамидируются в глутамат и аспартат. Содержание серина и треонина тоже оказывается заниженным, причем в тем большей степени, чем дольше проводится гидролиз. Наконец, некоторые связи между нейтральными остатками (Val-Val, Ile-Ile, Val-Ile, Ile-Val) даже через 20 ч гидролизуются лишь на 50%. Обычно параллельные пробы гидролизуют в течение 24, 48, 72 и 96 ч. Затем данные по серину и треонину наносят на график в полулогарифмическом масштабе и проводят экстраполяцию к нулевому моменту времени. По валину и изолейцину используют результаты, полученные при 96-часовом гидролизе. Дикарбоновые кислоты и их амиды определяются суммарно и регистрируются как «Glx» или «Asx». Цистеин и цистин до гидролиза превращают в кислотостабильные производные (например, в цистеиновую кислоту). Для анализа триптофана проводят щелочной гидролиз; при этом происходят разрушение серина, треонина, аргинина и цистеина и рацемизация всех аминокислот. По окончании гидролиза аминокислотный состав можно определить с помощью автоматической ионообменной хроматографии (см. рис. 3.12) или жидкостной хроматографии под давлением.
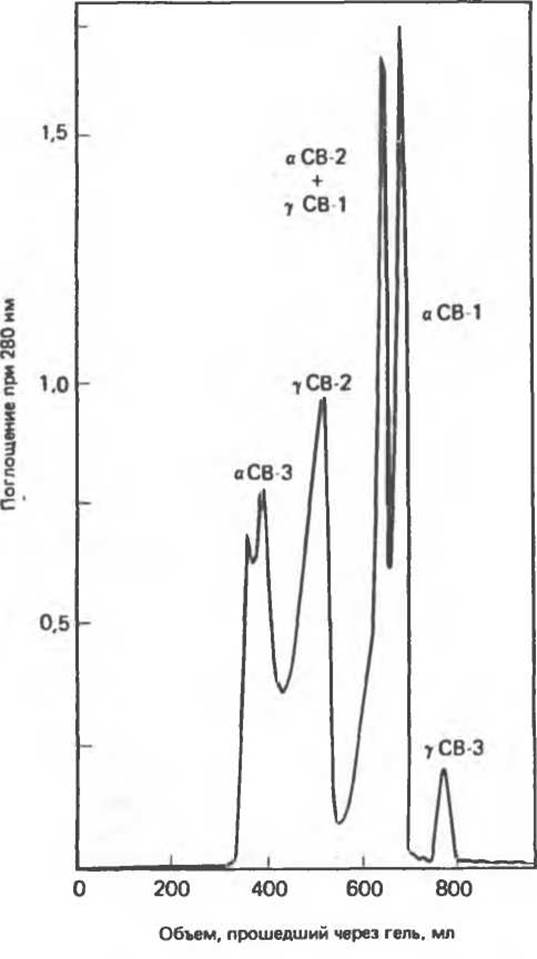
Рис. 4.7. Гель-фильтрация бромциановых (СВ) фрагментов фетального глобина человека. Хроматография проведена на колонке сефадекс G-50, уравновешенной 1%-ным НСООН, с последующей элюцией тем же раствором. Нумерация фрагментов а- и у-цепей произвольна. (С любезного разрешения J. D. Pearson et al., Department of Biochemistry, Purdue University.)
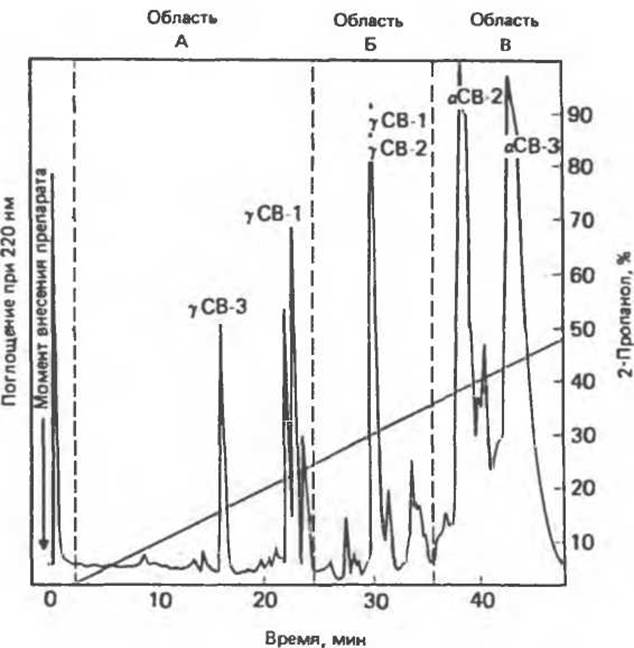
Рис. 4.8. Жидкостная хроматография с обращенной фазой при высоком давлении: профиль элюирования бромциановых (СВ) фрагментов фетального глобина человека. Нумерация фрагментов а- и у-цепей произвольна. (С любезного разрешения J. D. Pearson et al., Department of Biochemistry, Purdue University.)