Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Пептиды
Определение первичной структуры полипептидов
Уже более трех десятилетий минуло с тех пор, как Сенгер поразил биохимический мир, установив с помощью химических и ферментативных методов полную первичную структуру гормона инсулина. Подход Сенгера состоял в следующем. Сначала он разделил две полипептидные цепи инсулина, А и В, и далее провел их специфическое ферментативное расщепление на небольшие пептиды, содержащие перекрывающиеся участки последовательности. Он разделил эти пептиды и, используя реагент 1-фтор-2,4-динитробензол (рис. 4.9), идентифицировал их N-концевые остатки. Кроме того, он определил аминокислотный состав пептидов и в итоге смог установить их структуру. Сравнивая последовательности перекрывающихся пептидов, он однозначно установил первичную структуру обеих цепей, А и В.
В общих чертах стратегия Сенгера сохранила свое значение и до наших дней, однако за истекшие десятилетия были разработаны два новых подхода, которые произвели революцию в определении первичной структуры полипептидов (белков). Первый подход основан на разработанной Эдманом в 1967 г. автоматической процедуре последовательного отщепления и идентификации N-концевых аминокислотных остатков в виде их фенилтиогидантоиновых производных. Второй подход связан с методом, разработанным Сенгером и, независимо, Максамом и Гилбертом, позволяющим проводить быстрое и однозначное секвенирование гена, кодирующего рассматриваемый белок. Оптимальная стратегия состоит в одновременном использовании обоих подходов. Автоматическая деградация по Эдману, намного более быстрая по сравнению с первоначальным ручным методом Сенгера, тем не менее сильно уступает по скорости методам секвенирования ДНК и сопряжена с рядом трудностей. С другой стороны, секвенирование ДНК не всегда дает однозначную первичную структуру исследуемого белка. Главным зрелом белке. В то же время большим преимуществом метода секвенирования ДНК является относительная легкость обнаружения и секвенирования участков, присутствующих только в предшественнике белка и отщепляемых при его созревании. Таким образом, секвенирование ДНК и автоматическая процедура Эдмана дополняют друг друга; их совместное использование коренным образом изменило и расширило наши знания о первичной структуре белков. Секвенирование ДНК мы рассмотрим в гл. 38, а процедуру Эдмана — в следующем разделе.
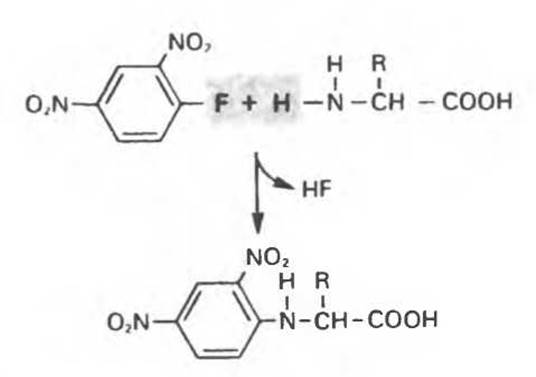
Рис. 4.9. Реакция аминокислоты с 1-фтор-2,4-динитробензолом (реагентом Сенгера). Реагент назван в честь нобелевского лауреата (1958 г.) биохимика Фредерика Сенгера, который использовал его для определения первичной структуры инсулина. Вначале арилируют (с количественным выходом) всех свободные аминогруппы, после гидролиза пептида образуются 2,4-динитрофенил-производные аминокислот, обладающие яркой желтой окраской. Количественный анализ этих производных осуществляют спектрофотометрическими методами. С динитрофторбензолом реагируют также Е-аминогруппа лизина, имидазольная группа гистидина, ОН-группа тирозина и SH-группа цистеина. Динитрофенильные группы не отщепляются при кислотном гидролизе и используются для идентификации N-концевых аминокислот в полипептидах.