Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Белки: структура и свойства
Денатурация
Сравнительно слабые связи, ответственные за стабилизацию вторичной, третичной и четвертичной структуры белка, легко разрушаются, что приводит к потере его биологической активности. Такое разрушение нативной структуры называют денатурацией. С физической точки зрения денатурацию можно рассматривать как разупорядочение конформации полипептидной цепи без изменения первичной структуры. Если речь идет о протомере, то процесс можно представить так, как это показано на рис. 5.8.
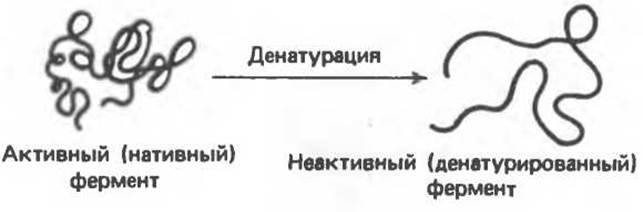
Рис. 5.8. Схематическое изображение денатурации протомера.
При денатурации олигомерного белка происходит диссоциация на протомеры, которая может сопровождаться или не сопровождаться изменением их конформации.
Большинство белков теряют биологическую активность в присутствии сильных минеральных кислот или оснований, при нагревании и обработке ионными детергентами (амфифильными соединениями), хаотропными агентами (мочевиной, гуанидином), тяжелыми металлами (Ag, Pb, Hg) или органическими растворителями. Денатурированные белки обычно менее растворимы в воде и часто из водного раствора выпадают в осадок. Это свойство широко используется в клинической лаборатории. Пробы крови или сыворотки, взятые для анализа на содержание в них малых молекул (глюкозы, мочевой кислоты, лекарственных препаратов), сначала обрабатывают трихлоруксусной, фосфовольфрамовой или фосфомолибденовой кислотой для осаждения белка. Осадок удаляют центрифугированием, а свободную от белка надосадочную жидкость анализируют.
Чувствительность большинства ферментов к нагреванию, кислотам и протеазам позволяет провести предварительное тестирование на ферментативный характер реакции. Если клеточный экстракт обладает каталитической активностью и теряет ее после кипячения, подкисления среды и последующей ее нейтрализации или после обработки какой-либо протеазой, то можно предположить, что катализатором служит фермент.
Часто на процесс денатурации оказывает влияние присутствие субстрата. Этот эффект объясняют конформационными изменениями фермента, сопровождающими связывание субстрата. Новая конформация может быть более стабильна или менее стабильна, чем исходная.