Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Белки: структура и свойства
Методы определения первичной структуры
Сначала сложные белки освобождают от простетических групп (например, от гема) и окисляют дисульфидные группы; в результате образуются линейные полипептиды (см. рис. 4.10). Методы секвенирования этих полипептидов уже обсуждались в гл. 4. Большинство белков содержит только те аминокислоты, которые перечислены в табл. 3.3, однако в некоторых белках встречаются производные этих аминокислот (табл. 5.4 и 5.5). Методы идентификации производных аминокислот выходят за рамки данной главы; отметим только, что их присутствие усложняет определение первичной структуры.
Таблица 5.4. Модификация групп а-СООН и а-NH2 находящихся в составе белков 1)
|
а-СООН |
a-NH2 |
||
|
Амид |
N-формил |
N-ацетил |
N-метил |
|
Ala |
Ala |
||
|
Asp Glu |
Asp |
Asp |
|
|
Gly His |
Gly |
Gly |
Gly |
|
Met |
Met |
Met |
Met |
|
Phe |
|||
|
Pro |
Ser |
Ser |
|
|
Thr |
Thr |
||
|
Tyr Val |
Val |
1) С изменениями, из работы Uy R., Wold F.: Posttranslational covalent modification of proteins. Science: 1977: 198: 890, с любезного разрешения авторов.
Первичная структура инсулина и рибонуклеази
Инсулин состоит из двух полипептидных цепей, ковалентно связанных дисульфидными связями (рис. 5.9). В A-цепи на N-конце находится остаток Gly, а на С-конце—Asn; в В-цепи N- и С-концевыми остатками являются Phe и Ala соответственно. При окислении инсулина надмуравьиной кислотой дисульфидные связи между А- и В-цепями разрываются. В ходе биосинтеза обе цепи вначале находятся в составе одной полипептидной цепи проинсулина, который после синтеза подвергается протеолитическому процессингу, ведущему к образованию инсулина (гл. 51).
Таблица 5.5. Модифицируемые функциональные группы в боковых цепях аминокислот в составе белков1)
|
—OH |
—N (в боковой цепи) |
||
|
PO3H2 |
N-метил |
N-диметил |
N-триметил |
|
Arg His |
Arg |
||
|
Ser |
Lys |
Lys |
Lys |
|
Thr |
|||
|
Tyr |
|||
1) С изменениями, из работы Uy R., Wold F.: Posttranslational covalent modification of proteins. Science: 1977: 198: 890, с любезного разрешения авторов.
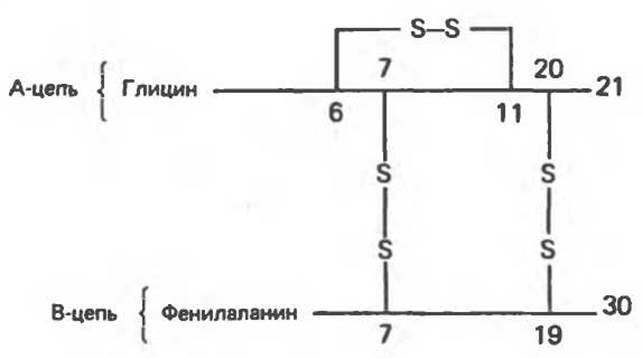
Рис. 5.9. А- и В-цепи инсулина человека, соединенные дисульфидными связями.
Рибонуклеаза состоит из одиночной цепи длиной 124 остатка, с Lys на N-конце и Val на С-конце. Восемь остатков цистеина соединены дисульфидными связями, так что в белке образуются четыре поперечные связи (рис. 5.10).