Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Ферменты: кинетика
Температура
В некотором ограниченном интервале температур скорость ферментативной реакции повышается с ростом температуры. Коэффициент, указывающий, во сколько раз повышается скорость реакции при повышении температуры на 10°, называется температурным коэффициентом и обозначается Q10. Для многих биологических реакций при повышении температуры на 10° скорость удваивается (Q10 = 2) и, аналогично, при понижении температуры на 10° уменьшается вдвое. Многие физиологические процессы (например, скорость сокращения изолированной сердечной мышцы) тоже характеризуются коэффициентом Q10, близким к двум.
Таблица 8.1. Аминокислотные последовательности вблизи важных в каталитическом отношении остатков серина (S) и гистидина (Н) в нескольких бычьих протеазах. Использованы однобуквенные обозначения аминокислот (гл. 3). (Из работы Dayhoff М. О., ed.: Atlas of Protein Sequence and Structure. Vol. 5. National Biomedical Research Foundation, 1972, с разрешения.)
|
Фермент |
Аминокислотные остатки вблизи серина (S) |
Аминокислотные остатки вблизи гисгидина (Н) |
|
Трипсин |
DSCQDG(S)GGPVVCSGK |
VVSAA(H)CYKSG |
|
Химотрипсин А |
SSCMGD(S)GGPLVCKKN |
VVTАА(Н)GGVTT |
|
Химотрипсин В |
SSCMGD(S)GGPLVCQKN |
VVTAA(Н)CGVTT |
|
Тромбин |
DACEGD(S)GGPFVMKSP |
VLTAA(H)CLLYP |
Типичная зависимость скорости ферментативной реакции от температуры представлена на рис. 8.12. Видно, что при некой оптимальной температуре скорость реакции максимальна. Повышение скорости реакции по мере приближения к оптимальной температуре слева объясняется увеличением кинетической энергии реагирующих молекул. При дальнейшем повышении температуры кинетическая энергия молекулы фермента становится достаточной для разрыва связей, поддерживающих вторичную структуру фермента в нативном, каталитически активном состоянии (происходит тепловая денатурация фермента). Вторичная и третичная структура фермента разрушается, что сопровождается потерей каталитической активности.
Для большинства ферментов оптимальная температура равна или выше той температуры, при которой в норме находятся клетки. Для ферментов микроорганизмов, адаптировавшихся к обитанию в природных горячих источниках, оптимальная температура может быть близка к точке кипения воды.
рН
Умеренные изменения pH оказывают влияние на ионное состояние фермента, а зачастую и субстрата. Как показывают измерения ферментативной активности при различных pH, оптимум активности находится обычно между pH 5,0 и 9,0. Вместе с тем отдельные ферменты, например пепсин, активны при значениях pH, лежащих далеко за пределами этого интервала.
Зависимость активности от pH определяется следующими факторами.
1. Денатурацией фермента при очень высоких или очень низких pH.
2. Изменением величины заряда молекул субстрата или фермента. Активность фермента может изменяться в результате изменений либо его структуры, либо заряда функциональных остатков, участвующих в катализе или связывании субстрата. Рассмотрим для примера взаимодействие отрицательно заряженного фермента (Enz) с положительно заряженным субстратом (SH+):
Enz- + SH+ → Enz — SH.
При низких pH происходит протонирование Enz-:
Enz- + Н+ → EnzH,
а при высоких pH — депротонирование субстрата:
SH+ -S + H+.
Поскольку взаимодействовать друг с другом могут только SH+ и Enz-, при крайних значениях pH эффективная концентрация Enz- или SH+ будет низкой, что приведет к снижению скорости реакции (рис. 8.13). И только в области, выделенной двойной штриховкой, в нужном ионном состоянии находятся одновременно и Enz, и S, а максимальной концентрации они достигают в точке X.
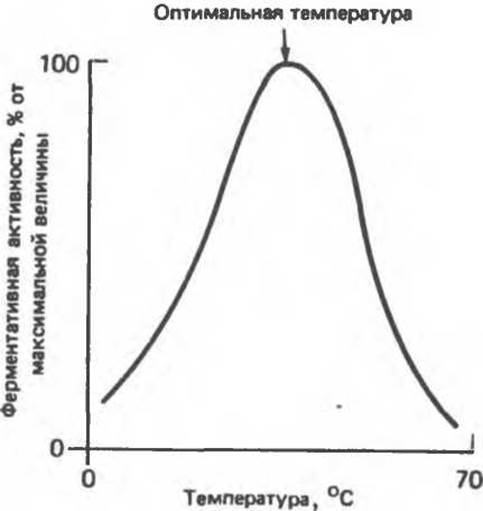
Рис. 8.12. Влияние температуры на скорость гипотетической ферментативной реакции.
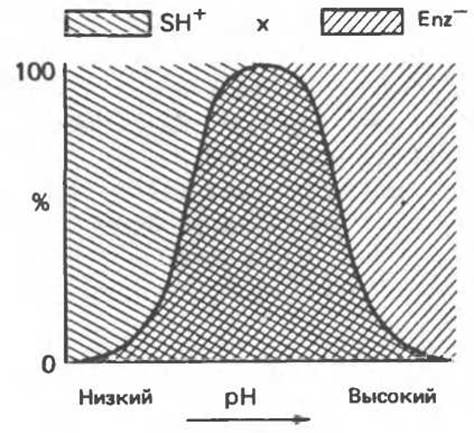
Рис. 8.13. Влияние pH на активность фермента.
При изменении pH ферменты могут претерпевать конформационные изменения. Для поддержания активной третичной или четвертичной структуры может оказаться необходимым присутствие определенного заряда на группе, удаленной от области связывания субстрата; именно такая ситуация наблюдается в случае гемоглобина (гл. 6). Если заряд этой группы изменится, могут произойти частичное развертывание белковой цепи, или, наоборот, компактизация молекулы, или же ее диссоциация на протомеры — во всех случаях с потерей активности.