Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Ферменты: механизм действия
Ферменты как катализаторы общего кислотного и общего основного типа
После связывания субстрата в области каталитического центра заряженные (или способные нести заряд) функциональные группы боковых цепей могут участвовать в катализе в качестве кислотных или основных катализаторов.
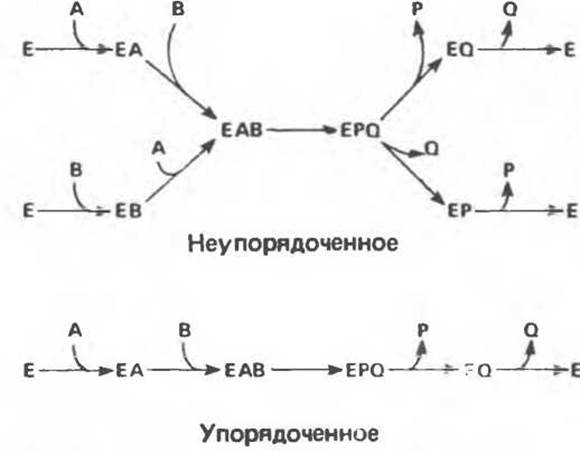
Рис. 9.8. Неупорядоченное и упорядоченное присоединение субстратов А и В к ферменту и высвобождение продуктов Р и Q из комплекса с ферментом Е.
![]()
Рис. 9.9. Схема механизма «пинг-понг» ферментативного катализа.
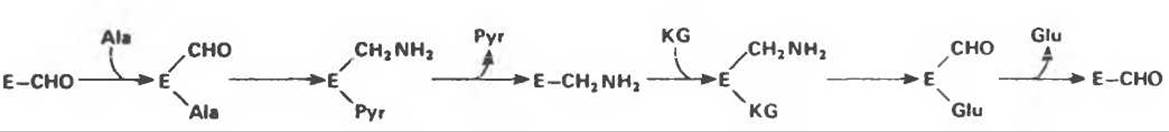
Рис. 9.10. Механизм «пинг-понг» при переаминировании. Е—СНО и Е—СН2 NH2 — комплексы фермента с пиридоксальфосфатом и пиридоксаминфосфатом соответственно. (Ala — аланин, Руr - пируват, KG -a-кетоглутарат. Glu - глутамат.)
Мы различаем две широкие категории ферментативного кислотно-основного катализа: общий кислотный (или основный) и специфический кислотный (или основный).
Реакции, скорость которых изменяется при изменении концентрации ионов Н+ или Н3O+, но не зависит от концентрации других кислот или оснований, присутствующих в растворе, рассматриваются как реакции, осуществляемые в результате специфического кислотного или специфического ocновногo катализа. Реакции, скорость которых зависит от присутствия в растворе любых кислот (доноров протонов) и любых оснований (акцепторов протонов), рассматриваются как реакции, осуществляемые в результате общего кислотного или общего основного катализа.
Для того чтобы решить, какой именно катализ имеет место в данной ферментативной реакции — общий или специфический кислотный или основный, — нужно измерить скорость реакции в следующих условиях: 1) при различных pH, но при постоянной концентрации буфера; 2) при фиксированном pH, но при различных концентрациях буфера.
Если скорость реакции при постоянной концентрации буфера изменяется с изменением pH, то имеет место специфический основный катализ (при pH > 7) или специфический кислотный катализ (при pH < 7). Если же скорость реакции при фиксированном pH возрастает с повышением концентрации буфера, то осуществляется общий основный катализ (при pH > 7) или общий кислотный катализ (при pH < 7).
В качестве примера специфического кислотного катализа рассмотрим превращение субстрата S в продукт Р. Реакция протекает в две стадии: за быстрой стадией, включающей обратимый перенос протона:
S + H3О ⇄ SH+ + Н2О,
следует более медленная, лимитирующая скорость всего процесса стадия превращения протонированного субстрата в продукт:
SH+ +H2О ⇄ P + H3О+.
Повышая концентрацию ионов гидрония [Н3О+], мы повышаем концентрацию SH+ — сопряженной кислотной формы субстрата; поскольку SH+ является субстратом лимитирующей стадии, возрастет и скорость полной реакции. Математически это можно записать следующим образом:
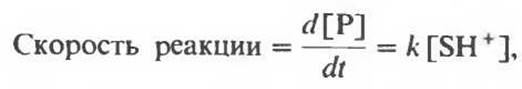
где Р — продукт, t — время, k — удельная константа скорости, [SH+] — концентрация сопряженной кислотной формы субстрата.
Поскольку концентрация SH+ зависит одновременно от концентраций S и Н, O+ общее выражение для скорости реакции, катализируемой по типу специфического кислотного катализа, примет вид
![]()
Обратите внимание на свойственную специфическому кислотному катализу особенность: в выражение для скорости реакции входят только члены [S] и [Н3О+].
Рассмотрим теперь в дополнение к описанному выше специфическому кислотному катализу также и катализ, осуществляемый ионом имидазолия имидазольного буфера. Поскольку имидазол — это слабая кислота (рКа = 7), он является плохим донором протонов; поэтому реакция
S + Имидазол Н+→ SH+ + Имидазол
протекает медленно и лимитирует скорость полной реакции. Отметим, что быстрая и медленная стадии в случаях специфического и общего кислотного катализа меняются местами. Выражение для скорости реакции в случае общего кислотного катализа часто имеет довольно сложный вид и поэтому здесь не рассматривается.