Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Ферменты: механизм действия
Ионы металлов
Свыше 25% всех ферментов содержат прочно связанные ионы металлов или активны только в их присутствии. Для изучения функций ионов металлов используются методы рентгеновской кристаллографии, ядерного магнитного резонанса (ЯМР) и электронного парамагнитного резонанса (ЭПР). В сочетании со сведениями об образовании и распаде металлсодержащих комплексов и о реакциях, в которых затрагивается координационная сфера ионов металлов, данные, полученные этими методами, позволяют лучше понять роль ионов металлов в ферментативном катализе. Об этой роли и говорится ниже.
Металлоферменты и ферменты, активируемые металлами
Металлоферменты содержат определенное количество ионов металлов, имеющих функциональное значение и остающихся связанными с молекулой фермента в ходе его очистки. Ферменты, активируемые металлами, связывают последние менее прочно, но для своей активности требуют добавления металлов в среду. Таким образом, разграничение между металлоферментами и ферментами, активируемыми металлами, основано на сродстве данного фермента к иону «своего» металла. Механизмы, основанные на участии ионов металлов в катализе, в обоих случаях, по-видимому, сходны.
Тройные комплексы фермент—металл—субстрат
Для тройных (трехкомпонентных) комплексов, включающих каталитический центр (Enz), ион металла (М) и субстрат (S) со стехиометрией 1:1:1, возможны четыре различных схемы образования:
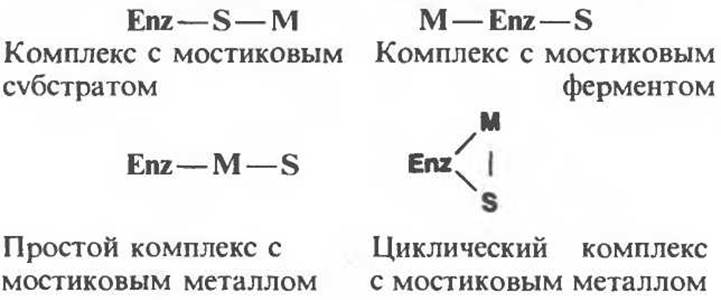
В случае ферментов, активируемых металлами, реализуются все четыре схемы. Для металлоферментов образование комплекса Enz—S—М невозможно, иначе они не могли бы удерживать металл в процессе очистки (они находятся в форме Enz — М). Можно сформулировать три общих правила.
1. Большинство (но не все) киназ (АТР:фосфотрансферазы) образуют комплексы с мостиковым субстратом типа Enz—нуклеозид—М.
2. Фосфотрансферазы, использующие в качестве субстрата пируват или фосфоенолпируват, другие ферменты, катализирующие реакции с участием фосфоенолпирувата, а также карбоксилазы образуют комплексы с мостиковым металлом.
3. Данный фермент может быть способен к образованию мостикового комплекса одного типа с одним субстратом и другого типа — с другим.
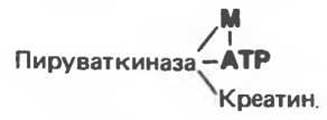
Комплексы с мостиковым ферментом (М—Enz—S)
Металлы в комплексах с мостиковым ферментом, по-видимому, выполняют структурную роль, поддерживая активную конформацию (примером служит глутаминсинтаза), или образуют мостик с другим субстратом (как в пируваткиназе). В пируваткиназе ион металла играет не только структурную роль, но и удерживает один из субстратов (АТР) и активирует его:
Комплексы с мостиковым субстратом
Образование тройных комплексов с мостиковым субстратом, которое наблюдается при взаимодействии ферментов с нуклеозидтрифосфатами, по-видимому, связано с выстеснением Н2О из координационной сферы металла, место которой занимает АТР
![]()
Затем субстрат связывается с ферментом, образуя тройной комплекс:
![]()
В фосфотрансферазных реакциях ионы металлов, как полагают, активируют атомы фосфора и образуют жесткий полифосфат-адениновый комплекс в соответствующей конформации, который включается в состав активного четырехкомпонентного комплекса.
Комплексы с мостиковым металлом
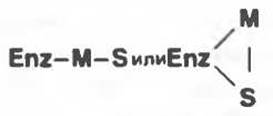
Кристаллографические данные, а также анализ первичной структуры показывают, что в активных центрах многих белков в связывании металла участвует остаток гистидина (примерами служат карбоксипептидаза А, цитохром с, рубредоксин, метмиоглобин и метгемоглобин; см. гл. 6). Лимитирующей стадией образования бинарных (двухкомпонентных) комплексов Enz—М во многих случаях является вытеснение воды из координационной сферы иона металла. Активация многих пептидаз ионами металла является медленным процессом, длящимся несколько часов. Эта медленная реакция, по всей вероятности, состоит в конформационной перестройке бинарного комплекса Enz—М, приводящей к формированию активной конформации. Этот процесс можно представить таким образом:
Связывание металла:

Перестройка с образованием активной конформации (Enz*):

В случае металлоферментов образование тройного комплекса с мостиковым металлом должно происходить путем присоединения субстрата к бинарному комплексу:
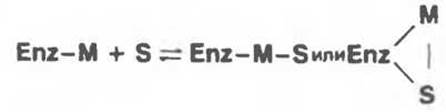
Роль металлов в катализе
Ионы металлов могут участвовать в каждом из четырех известных типов механизмов, с помощью которых ферменты ускоряют химические реакции: 1) общий кислотно-основный катализ; 2) ковалентный катализ; 3) сближение реактантов; 4) индукция напряжения в ферменте или субстрате. Помимо ионов железа, которые функционируют в гемсодержащих белках, в ферментативном катализе чаще всего участвуют Mg2+, Мn2+ и Са2+, хотя в работе некоторых ферментов важную роль играют и другие ионы (например, К+).
Ионы металлов, как и протоны, являются льюи- совыми кислотами (электрофилами) и могут образовывать со своими лигандами δ-связь за счет поделенной электронной пары. Ионы металлов можно рассматривать также как «сверхкислоты», поскольку они устойчивы в нейтральном растворе, часто несут положительный заряд (> 1) и способны к образованию п-связей. Кроме того (в отличие от протонов), металлы могут служить трехмерной матрицей, ориентирующей основные группы фермента или субстрата.
Ионы металлов могут функционировать как акцепторы электронов с образованием δ- или п-связей, активируя электрофилы или нуклеофилы (общий кислотно-основный катализ). Металлы могут активировать нуклеофилы, отдавая электроны, или же сами действовать как нуклеофилы. Координационная сфеpa металла может обеспечивать контактирование фермента и субстрата (сближение) либо путем образования хелатов переводить фермент или субстрат в напряженное состояние. Ион металла может маскировать нуклеофил, предотвращая побочные реакции. Наконец, возможен стереохимический контроль хода ферментативной реакции, который обеспечивается способностью координационной сферы металла играть роль трехмерной матрицы, удерживающей реагирующие группы в нужной пространственной ориентации (табл. 9.1).
Таблица 9.1. Примеры, иллюстрирующие роль ионов металлов в механизме действия ферментов1)
|
Фермент |
Роль иона металла |
|
Гистидиндезаминаза |
Маскирование нуклеофила |
|
Киназы, лиазы, пируватдекарбоксилаза |
Активация электрофила |
|
Карбоангидраза |
Активация нуклеофила |
|
Кобамидные ферменты |
Металл действует как нуклеофил |
|
Пируваткарбоксилаза, карбоксипептидаза, алкогольдегидрогеназа |
Удаление п-электронов |
|
Негемовые железопротеины |
Металл служит донором 71-электронов |
|
Пируваткиназа, пируваткарбоксилаза, аденилаткиназа |
Ион металла связывает лиганды и ориентирует их друг относительно друга |
|
Фосфотрансфераза, D-ксилозоизомераза, гемопротеины |
Индукция напряженного состояния |
1) Из работы Mildvan A. S.: Metals in enzyme catalysis. Vol. 2, p. 456 in: Enzymes, Boyer P. D., Lardy H., Myrbäck К. (editors). Academic Press. 1970, с изменениями.
Литература
Crane F. Hydroquinone dehydrogenases, Annu. Rev. Biochem., 1977, 46, 439.
Fersht A. Enzyme Structure and Mechanism, 2nd ed., Freeman, 1985. [Имеется перевод 1-го издания: Фёршт Э. Структура и механизм действия ферментов.— М.: Мир, 1980.]
Kraut J. Serine proteases: Structure and mechanism of catalysis, Annu. Rev. Biochem., 1977, 46, 331.
Mildvan A. S. Mechanism of enzyme action, Annu. Rev. Biochem., 1974, 43, 357.
Purich D. L. (ed.) Enzyme kinetics and mechanisms. Parts A and B. In: Methods in Enzymology, Vol. 63, 1979; Vol. 64, 1980, Academic Press.
Wimmer M.J., Rose I. A. Mechanisms of enzyme-catalyzed group transfer reactions, Annu. Rev. Biochem., 1978, 47, 1031.
Wood H.G., Barden R.E. Biotin enzymes, Annu. Rev. Biochem., 1977, 46, 385.