Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Ферменты: регуляция активности
Аллостерическая регуляция
Принципы
Каталитическая активность некоторых регуляторных ферментов может модулироваться низкомолекулярными аллостерическими эффекторами, обычно имеющими либо незначительное структурное сходство с субстратами или с коферментами регулируемого ими фермента, либо не имеющими его вообще. Ингибирование фермента, катализирующего одну из реакций в цепи, конечным продуктом этой цепи называют ингибированием по принципу обратной связи. В цепи реакций биосинтеза D из А, катализируемой ферментами Enz1, ... Enz3:
![]()
при высоких концентрациях D обычно наблюдается ингибирование превращения А в В. Это не простое «обращение» реакции, связанное с накоплением промежуточных продуктов, а следствие того, что продукт D способен связываться с ферментом Enz1, выступая в качестве его ингибитора. Таким образом, D действует как отрицательный аллостерический эффектор фермента, или ингибитор, действующий по принципу обратной связи. Следовательно, ингибирование Enz, под действием D регулирует синтез D. Обычно D связывается с ингибируемым ферментом в аллостерическом центре, удаленном от каталитического центра.
В кинетическом плане ингибирование по принципу обратной связи может быть конкурентным, неконкурентным, частично конкурентным и смешанным. Ингибирование по принципу обратной связи характерно для биосинтетических путей. Очень часто ингибитор, действующий по принципу обратной связи, является последней малой молекулой перед синтезом макромолекулы (например, аминокислотой, если речь идет о синтезе белков, или нуклеотидом в синтезе нуклеиновых кислот). Регуляция по принципу обратной связи обычно происходит на первой функционально необратимой1 стадии, уникальной для данной цепи реакций биосинтеза.
Примерами ингибирования по принципу обратной связи в микроорганизмах могут служить ингибирование фосфорибозил: АТР — пирофосфорилазы гистидином, антранилатсинтазы — триптофаном, аспартаттранскарбамоилазы — под действием СТР. В каждом случае регуляторный фермент участвует в цепи реакций биосинтеза единственного конечного продукта — His, Тrр или СТР.
Цепь реакций биосинтеза часто бывает разветвленной — ее первые реакции дают начало синтезу сразу двух или большего числа метаболитов. На рис. 10.4 указаны вероятные участки в разветвленной цепи биосинтеза, по которым осуществляется простое ингибирование по принципу обратной связи (ингибиторами могут служить аминокислоты, пурины или пиримидины). S1, S2 и S3 являются предшественниками всех четырех конечных продуктов (А, В, С и D), S4 — предшественником В и С, a Ss — предшественником только D. Последовательности являются линейными и могут подвергаться ингибированию конечными продуктами по принципу обратной связи.
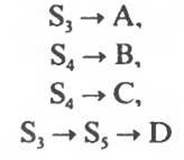
Более тонкая регуляция осуществляется с помощью множественных петель обратной связи (рис. 10.5). Например, если В присутствует в избытке, то снижается потребность в S2. Следовательно, способность В ингибировать процесс, в котором сам этот продукт образуется, представляется биологически целесообразной. Однако, если избыток В ингибирует не только реакции, которые связаны исключительно с синтезом В, но и те реакции, которые одновременно ведут к синтезу А, С и D, то он будет препятствовать синтезу всех четырех продуктов. Это, конечно, нецелесообразно. Впрочем, сформировались механизмы, позволяющие преодолеть эту трудность.
Существует несколько вариантов ингибирования по принципу обратной связи. При кумулятивном ингибировании ингибирующее действие двух и более конечных продуктов на один и тот же регулируемый фермент строго аддитивно.
1 Имеется в виду реакция, равновесие которой (в термодинамическом смысле) сильно смещено в одну сторону, т. е. реакция, характеризующаяся большим по величине отрицательным значением ∆G.
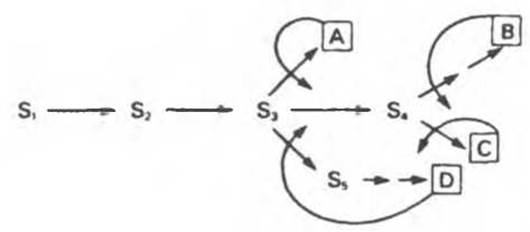
Рис. 10.4. Ингибирование по принципу обратной связи на различных участках разветвленного биосинтетического пути. S1—S5 — промежуточные соединения, образующиеся в ходе биосинтеза конечных продуктов A—D. Прямые стрелки соответствуют ферментам, катализирующим указанные превращения. Кривыми стрелками указаны петли обратной связи и вероятные участки ингибирования по принципу обратной связи специфическими конечными продуктами.
В случае согласованного или мультивалентного ингибирования полное ингибирование наблюдается только тогда, когда в избытке одновременно присутствуют два или более конечных продукта.
При кооперативном ингибировании ингибирующее действие на регуляторный фермент оказывает избыток каждого из конечных продуктов, но ингибирующее действие сразу двух и более конечных продуктов намного превосходит аддитивный эффект, характерный для кумулятивного ингибирования.
Еще один вариант регуляции наблюдается в случае ферментов аспартатного семейства: оно включает множественные формы ферментов (изозимы), каждый из которых имеет свои регуляторные характеристики. В Е. coli синтезируются три аспартокиназы. Одна из них (AKL) специфически и полностью ингибируется лизином, другая (АКТ) — треонином, а третья (АКН) — гомосерином, предшественником Met, Thr и Ile (рис. 10.6). Избыток Lys ингибирует AKL, что приводит к снижению синтеза ß-аспартилфосфата. Но одного только этого еще недостаточно, чтобы направить метаболиты на синтез гомосерина и последующих продуктов. Переключение на этот канал биосинтеза происходит с помощью ингибирования по принципу обратной связи ферментов, участвующих в следующих звеньях пути биосинтеза. Лизин ингибирует также первый фермент в последовательности реакций, ведущих от ß-аспартилфосфата к лизину. Это облегчает неограниченный синтез гомосерина, а, следовательно, также треонина и изолейцина. Следующее место регуляции находится на участке разветвления, из которого одна ветвь ведет к метионину, а другая — к треонину и изолейцину.
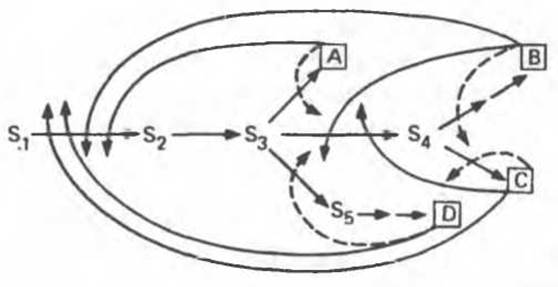
Рис. 10.5. Множественное ингибирование по принципу обратной связи на различных участках разветвленного биосинтетического пути. Помимо простых петель обратной связи (кривые штриховые стрелки) указаны петли (кривые сплошные стрелки), регулирующие активность ферментов, общих для процессов биосинтеза нескольких конечных продуктов.
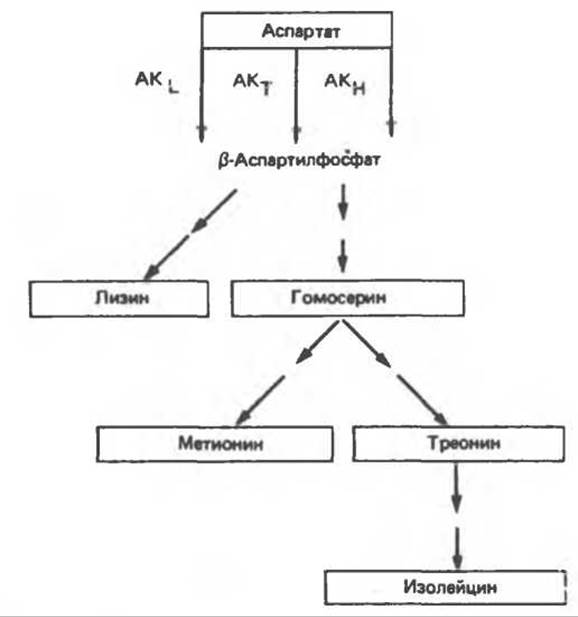
Рис. 10.6. Регуляция активности аспартокиназы (АК) в клетках E.coli. Изоформы фермента подвергаются избирательному ингибированию отдельными конечными продуктами — лизином (АКL), треонином (АКТ) и гомосерином (АКН).
О том, что рассмотренные варианты регуляции метаболизма реально функционируют, свидетельствуют данные о характере ингибирования конечными продуктами пути биосинтеза, начинающегося с аспартата, у различных бактерий (табл. 10.2).
Наиболее полно изученный аллостерический фермент, аспартат-транскарбамоилаза, катализирует первую реакцию, уникальную для биосинтеза пиримидинов (рис. 10.7). Аспартат-транскарбамоилаза (АТКаза) ингибируется по принципу обратной связи цитидинтрифосфатом (СТР). После обработки ртутьсодержащими реагентами АТКаза теряет чувствительность к СТР, но сохраняет полную активность при синтезе карбамоиласпартата. Это означает, что СТР связывается не в тех участках, где находятся центры связывания субстратов, а в специальном аллостерическом центре. АТКаза состоит из двух каталитических и трех или четырех регуляторных протомеров. Каждый каталитический протомер содержит четыре аспартатсвязывающих центра, а каждый регуляторный — по меньшей мере два СТР-связывающих (регуляторных) центра. Каждый тип протомеров находится под независимым генетическим контролем. Это было показано путем отбора мутантов, лишенных нормального контроля со стороны СТР; из этих мутантов были получены ревертанты, обладающие практически нормальными регуляторными свойствами.
Таблица 10.2. Варианты аллостерической регуляции аспартокиназы
|
Организм |
Ингибитор, действующий по принципу обратной связи |
Репрессор |
|
Е. coli (киназа I) |
Гомосерин |
|
|
Е. coli (киназа II) |
Lys |
Lys |
|
Е. coli (киназа III) |
Thr |
|
|
R. rubrum |
Thr |
|
|
В. subtilis |
Thr + Lys |
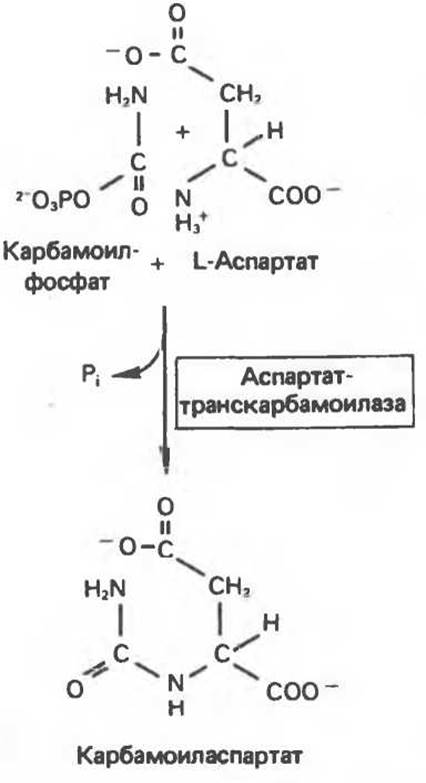
Рис. 10.7. Реакция, катализируемая аспартат-транс-карбамоилазой (АТКазой).
Данные о существовании аллостерических центров у регуляторных ферментов
Примерно в 1963 г. Моно обратил внимание на отсутствие структурного сходства между ингибитором, действующим на фермент по принципу обратной связи, и субстратом этого фермента. Отсутствие изостеричности с субстратом позволяет говорить об аллостеричности соответствующих эффекторов. Исходя из этого, Моно предположил, что ферменты, регулируемые такими аллостерическими эффекторами (в частности, ингибиторами по принципу обратной связи), связывают эффектор в аллостерическом центре, физически не совпадающем с каталитическим центром. Таким образом, аллостерические ферменты — это ферменты, активность каталитического центра которых изменяется под действием аллостерических эффекторов, связывающихся в аллостерическом центре. Данные о наличии у регуляторных ферментов физически обособленных аллостерических центров сводятся к следующему.
1. Регуляторные ферменты после модификации химическими или физическими методами часто становятся нечувствительны к аллостерическим эффекторам, сохраняя каталитическую активность. Показана избирательная денатурация аллостерических центров при действии на ферменты ртутьсодержащих реагентов, мочевины, рентгеновских лучей, протеолитических ферментов, растворов с экстремальными значениями ионной силы или pH, при длительном хранении при 0—5 °С, замораживании или нагревании.
2. Аллостерические эффекторы часто защищают каталитический центр от денатурации в условиях, когда субстрат такого защитного действия не оказывает. Трудно представить себе ситуацию, при которой эффектор, связываясь в каталитическом центре, защищает фермент, а субстрат такой способностью не обладает. Поэтому естественнее предположить, что эффектор связывается в другом, аллостерическом, центре фермента.
3. Обнаружены мутантные клетки бактерий и млекопитающих, в которых регуляторные ферменты имели существенно иные регуляторные свойства, чем ферменты из клеток дикого типа, но обладали в точности такими же каталитическими свойствами. Отсюда следует, что структура аллостерического и каталитического центров детерминируется разными участками гена.
4. Показано, что связывание субстратов и аллостерических эффекторов с регуляторным ферментом происходит независимо.
5. В некоторых ферментах (например, в АТКазе) аллостерический и каталитический центры локализованы в разных протомерах.
Кинетика аллостерического ингибирования
На рис. 10.8 представлены зависимости скорости реакции, катализируемой типичным аллостерическим ферментом, от концентрации субстрата в присутствии и в отсутствие аллостерического ингибитора. В отсутствие ингибитора наблюдается гиперболическая кривая насыщения. В его присутствии кривая приобретает сигмоидный вид; при высоких концентрациях субстрата скорость реакции может достигать значений, близких к тем, которые наблюдаются в отсутствие ингибитора. Обратите внимание на аналогию, которая прослеживается в этом случае с кривыми насыщения кислородом миоглобина и гемоглобина (гл. 6).
По данным кинетического анализа, ингибирование по принципу обратной связи может быть конкурентным, неконкурентным, частично конкурентным или может носить иной характер. Если при высоких концентрациях S активность фермента примерно одинакова в присутствии и в отсутствие аллостерического ингибитора, то кинетика внешне сходна с кинетикой конкурентного ингибирования. Однако, поскольку кривая насыщения субстратом все-таки носит сигмоидный, а не гиперболический характер, метод построения графиков в обратных координатах для аллостерических ингибиторов непригоден; он предложен для конкурентного ингибирования в каталитическом центре. Поскольку аллостерические ингибиторы связываются с ферментом в другом (аллостерическом) центре, исходная кинетическая модель утрачивает силу.
Сигмоидный характер зависимости V от [S] в присутствии аллостерического ингибитора обусловлен эффектом кооперативности. При низких концентрациях S активность в присутствии ингибитора существенно ниже, чем в его отсутствие. Однако при увеличении [S] ингибирующее действие становится менее выраженным. Такая же кинетика наблюдается. когда имеются два или больше взаимодействующих субстратсвязывающих центра: присутствие молекулы субстрата в одном каталитическом центре облегчает связывание молекулы второго субстрата в другом центре. Кооперативность связывания субстратов была описана в гл. 6 на примере гемоглобина. Сигмоидный характер кривой насыщения гемоглобина кислородом обусловлен кооперативными взаимодействиями четырех связывающих O2 центров, локализованных в разных протомерах.
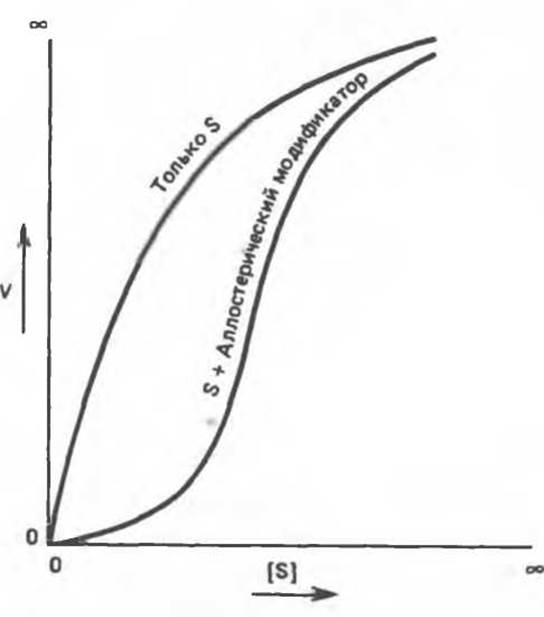
Рис. 10.8. Сигмоидная кинетическая кривая насыщения субстратом в присутствии аллостерического ингибитора.
Модели аллостерии
Попытки описать кинетику аллостерического ингибирования как «конкурентную» или «неконкурентную» по отношению к субстрату основаны на чисто механической аналогии, которая может ввести в заблуждение. Поэтому мы будем говорить о двух классах регуляторных ферментов — ферментах FC-ряда и ферментах V-ряда. Насыщение субстратом аллостерических ферментов К-ряда выглядит как конкурентный процесс в том смысле, что Км увеличивается (уменьшается сродство к субстрату), и при этом значение Vmax никак не изменяется. В случае аллостерических ферментов V-ряда уменьшается Vmaх (снижается каталитическая эффективность), но кажущееся значение Км остается неизменным. Изменения Км или Vmах, по всей вероятности, обусловлены конформационными изменениями в каталитическом центре, вызванными связыванием аллостерического ингибитора в аллостерическом центре. В аллостерических ферментах К-ряда эти конформационные изменения приводят к ослаблению связи между субстратом и субстратсвязывающими остатками. В аллостерических ферментах V-ряда основной эффект заключается в изменении ориентации каталитических остатков, что приводит к понижению Vmах. Однако могут наблюдаться и промежуточные случаи, когда конформационные изменения сказываются и на Км, и на Vmах.
Для описания регуляции аллостерических ферментов были предложены различные модели, однако вряд ли можно выбрать какую-то одну, способную объяснить поведение всех регуляторных ферментов. Поскольку сигмоидный характер кривой насыщения субстратом влечет за собой определенные регуляторные преимущества, любая мутация, приводящая к сигмоидной кривой насыщения, будет иметь тенденцию к закреплению в популяции. Едва ли можно ожидать, что все эти мутации детерминируют один и тот же механизм ингибирования. Поэтому сигмоидность кинетики еще ничего не говорит о механизме ингибирования.
Физиологические последствия кооперативности
Кооперативность связывания субстратов приводит к таким же последствиям, как и кооперативность связывания О2 гемоглобином. При низких концентрациях субстрата аллостерический эффектор является мощным ингибитором. Он, следовательно, оказывает наиболее эффективное регулирующее воздействие как раз тогда, когда в нем имеется наибольшая необходимость: при низких внутриклеточных концентрациях субстрата. По мере повышения концентрации субстрата необходимость в строгой регуляции уменьшается, поэтому степень ингибирования понижается, что приводит к образованию большего количества продукта. По аналогии с гемоглобином сигмоидная кривая насыщения субстратом в присутствии ингибитора означает, что относительно малые изменения концентрации субстрата влекут за собой большие изменения активности. Это обеспечивает тонкую регуляцию каталитической активности при малых изменениях концентрации субстрата. Наконец, как и при насыщении кислородом гемоглобинов разных видов животных, для регуляторных ферментов из разных источников сигмоидные кривые насыщения могут быть сдвинуты влево или вправо; это обеспечивает лучшее соответствие тем концентрациям субстрата, которые преобладают in vivo.
Регуляция по принципу обратной связи в клетках млекопитающих
В клетках млекопитающих, так же как и в бактериальных клетках, конечные продукты регулируют свой собственный синтез по принципу обратной связи. В некоторых случаях (в частности, в случае АТКазы) ингибирование по принципу обратной связи направлено на первый из ферментов биосинтетической цепи. Однако мы должны различать понятия регуляции по принципу обратной связи — общий термин, не содержащий никаких указаний на механизм, — и ингибирования по принципу обратной связи — механизм регуляции многих ферментов бактерий и млекопитающих путем ингибирования. Например, поступающий с пищей холестерол подавляет свой собственный синтез из ацетата в тканях млекопитающих. Этот тип регуляции, однако, не направлен непосредственно на ингибирование первого фермента пути биосинтеза холестерола. Ингибирование затрагивает один из ферментов (HMG-СоА-редуктазу); функционирующий на ранних стадиях биосинтеза механизм включает подавление холестеролом или его метаболитами экспрессии генов, кодирующих образование HMG-CoA-редуктазы. Холестерол, непосредственно добавленный в систему с HMG-СоА-редуктазой, никакого действия на ее каталитическую активность не оказывает.