Биохимия человека Том 1 - Марри Р. 1993
Структура и функции белков и ферментов
Ферменты: регуляция активности
Ковалентная модификация ферментов
Общие принципы
Обратимое изменение каталитической активности ферментов может осуществляться путем ковалентного присоединения фосфатной группы (преобладает у млекопитающих) или нуклеотида (преобладает у бактерий). Ферменты, подверженные ковалентной модификации, которая сопровождается изменением их активности, называют обратимо модифицируемыми ферментами (рис. 10.9).
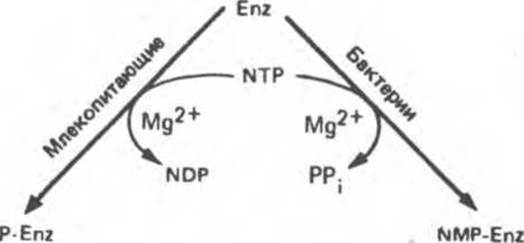
Рис. 10.9. Регуляция ферментативной активности путем ковалентной модификации. Слева — фосфорилирование, справа — присоединение нуклеотида. В обоих процессах нуклеозидтрифосфатом (NTP) обычно служит АТР.
Обратимо модифицируемые ферменты могут находиться в двух состояниях, одно из которых характеризуется высокой, а другое — низкой каталитической эффективностью. В зависимости от конкретного случая более активным катализатором может быть либо фосфо-, либо дефосфофермент (табл. 10.3).
Участки фосфорилирования
Обычно фосфорилируется специфический остаток серина и образуется остаток О-фосфосерина; реже фосфорилируется остаток тирозина с образованием остатка О-фосфотирозина. Хотя обратимо модифицируемый фермент может содержать много остатков серина или тирозина, фосфорилирование происходит в высшей степени избирательно и затрагивает лишь небольшое число (1—3) остатков. Эти участки, по всей вероятности, не являются частью каталитического центра; мы, таким образом, имеем еще один пример аллостерических эффектов.
Модифицирующие (конвертирующие) ферменты
Фосфорилирование и дефосфорилирование катализируется протеинкиназами и протеинфосфатазами соответственно (рис. 10.10). В некоторых случаях конвертирующие ферменты сами являются обратимо модифицируемыми ферментами (табл. 10.3). Так, существуют киназы и фосфатазы протеинкиназы, катализирующие модификацию конвертирующих белков (протеинкиназ). Данные о принадлежности к обратимо модифицируемым ферментам протеинфосфатаз менее убедительны, хотя их активность подвержена регуляции. Активность протеинкиназ и протеинфосфатаз находится под гормональным контролем и регулируется также нервной системой, однако детали механизма этой регуляции неясны.
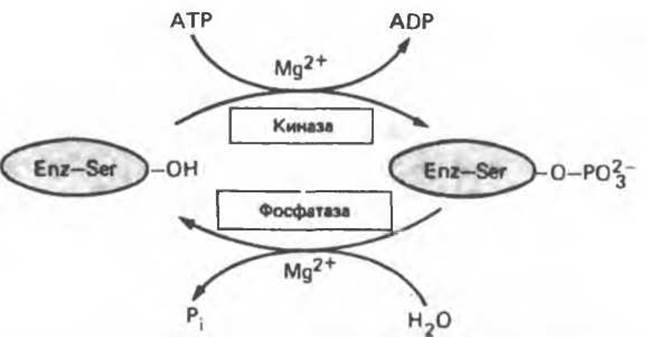
Рис. 10.10. Ковалентная модификация, регулирующая работу фермента и осуществляемая путем фосфорилирования/дефосфорилирования остатка серина.
Таблица 10.3. Некоторые ферменты млекопитающих, каталитическая активность которых в фосфорилированном и дефосфорилированном состояниях различна (Е — дефосфофермент, ЕР — фосфофермент)
|
Фермент |
Состояние активности |
|
|
низкая |
высокая |
|
|
Ацетил-СоА-карбоксилаза |
ЕР |
Е |
|
Гликогенсинтаза |
ЕР |
Е |
|
Пируватдегидрогеназа |
ЕР |
Е |
|
HMG-CoA-редуктаза |
ЕР |
Е |
|
Гликогенфосфорилаза |
Е |
ЕР |
|
Цитратлиаза |
Е |
ЕР |
|
Пируватдегидрогеназа |
Е |
ЕР |
|
Киназа фосфорилазы b |
Е |
ЕР |
|
Киназа HMG-CoA-редуктазы |
Е |
ЕР |
Энергетика
Реакции, представленные на рис. 10.10, подобны реакциям превращения глюкозы в глюкозо-6-фосфат или фруктозо-6-фосфата в фруктозо-1,6-бисфосфат (см. гл. 18). При фосфорилировании и последующем дефосфорилировании 1 моля субстрата (фермента или сахара) происходит гидролиз 1 моля АТР.
Активность киназ (катализирующих реакции 1 и 3) и фосфатаз (катализирующих реакции 2 и 4) должна в свою очередь регулироваться — в противном случае их совместное действие будет приводить к катализу неконтролируемого гидролиза АТР.

Аналогия с ингибированием по принципу обратной связи
Регуляция ферментативной активности путем фосфорилирования и дефосфорилирования в известной мере аналогична регуляции по принципу обратной связи. Оба типа регуляции обеспечивают быстрое изменение потока метаболитов в ответ на тот или иной физиологический сигнал; и в том и в другом случае экспрессия генов не затрагивается. При обоих типах регуляции действие направлено на ферменты начальных этапов многостадийной цепи метаболических реакций, чаще всего принадлежащих одному пути биосинтеза, причем не на каталитические, а на аллостерические центры. Однако ингибирование по принципу обратной связи направлено избирательно на один фермент и не зависит от гормональной или нервной регуляции. Напротив, регуляция ферментов млекопитающих путем фосфорилирования — дефосфорилирования распространяется на несколько белков, осуществляется при участии АТР или других нуклеозидтрифосфатов и находится под прямым нервным и гормональным контролем.
Литература
Gumaa К. A., McLean Р., Greenbaum A. L. Compartmentation in relation to metabolic control in liver, Essays Biochem., 1971, 7, 39.
Кип E., Grisolia S. Biochemical Regulatory Mechanisms in Eukaryotic Cells, Wiley, 1972.
Nestler E. J., Greengard P. Protein phosphorylation in the brain, Nature, 1983, 305, 583.
Newsholme E. A., Stuart C. Regulation in Metabolism, Wiley, 1973.
Schimke R. T., Doyle D. Control of enzyme levels in animal tissues, Annu. Rev. Biochem., 1970, 39, 929.
Soderling T. R. Role of hormones and protein phosphorylation in metabolic regulation. Fed. Proc., 1982, 41, 2615.
Sols A., Marco R. Concentrations of metabolites and binding sites: Implications in metabolic regulation, Curr. Top. Cell. Regul., 1970, 2, 227.
Stanbury J. B. et al. (eds.) The Metabolic Basis of Inherited Disease, 5th ed., McGraw-Hill, 1983.
Umbarger H. E. Amino acid biosynthesis and its regulation. Annu. Rev. Biochem, 1978. 47, 533.
Weber G. (ed.) Advances in Enzyme Regulation, Vols. 1—9, Pergamon Press, 1963—1987.