Биохимия человека Том 2 - Марри Р. 1993
Биохимия внутри- и межклеточных коммуникаций
Гормоны, регулирующие метаболизм кальция
Гормоны, участвующие в гомеостазе кальция - Кальцитриол [1,25-(OH)2-D3]
Общие положения о роли кальцитриола в гомеостазе кальция
А. История вопроса. Рахит — заболевание детей, характеризующееся нарушением минерализации скелета ч сильно выраженными, уродующими деформациями костей, — был широко распространен в Северной Америке и Западной Европе в начале века. Результаты серии исследований позволили предположить, что рахит обусловлен недостаточностью какого-то компонента диеты. После того как было обнаружено, что рахит можно предотвратить добавлением в пищу жира тресковой печени, но при этом не витамин А является ее активным компонентом, этот фактор предупреждения рахита обозначили как жирорастворимый витамин D. Примерно в то же время было показано, что ультрафиолетовое облучение (искусственное или солнечным светом) также предупреждает развитие заболевания. В последующем было выявлено заболевание взрослых, эквивалентное рахиту, а именно остеомаляция. Это заболевание, характеризующееся нарушением минерализации костей, также поддавалось лечению витамином D. В развитии дальнейших исследований ключевую роль сыграли данные, показавшие, что лечение витамином D больных, имевших повреждения печени или почек, не давало ожидаемого эффекта. На протяжении последних 50 лет велось изучение структуры витамина D и механизма его действия, причем особенно быстро оно продвинулось в последнее десятилетие.
Б. Роль в гомеостазе. Основная биологическая роль кальцитриола — это стимуляция всасывания кальция и фосфата в кишечнике. Кальцитриол — единственный гормон, способствующий транспорту кальция против концентрационного градиента, существующего на мембране клеток кишечника. Поскольку продукция кальцитриола очень строго регулируется (рис. 47.4), очевидно, что существует тонкий механизм, поддерживающий уровень Са2+ во ВЖ, несмотря на значительные колебания в содержании кальция в пище. Этот механизм поддерживает такие концентрации кальция и фосфата, которые необходимы для образования кристаллов гидроксиапатита, откладывающихся в коллагеновых фибриллах кости. При недостаточности витамина D (кальцитриола) замедляется формирование новых костей и нарушается обновление (ремоделирование) костной ткани. В регуляции этих процессов участвует в первую очередь ПТГ, воздействующий на клетки кости, но при этом необходим и кальцитриол в небольших концентрациях. Кальцитриол способен также усиливать действие ПТГ на реабсорбцию кальция в почках.
Биохимия
А. Биосинтез. Кальцитриол — это во всех отношениях гормон. Он образуется в сложной последовательности ферментативных реакций, которая включает перенос кровью молекул-предшественников, поступающих в различные ткани (рис. 47.4). Далее активное соединение — кальцитриол — транспортируется в другие органы, где активирует определенные биологические процессы по механизму, сходному с механизмом действия стероидных гормонов.
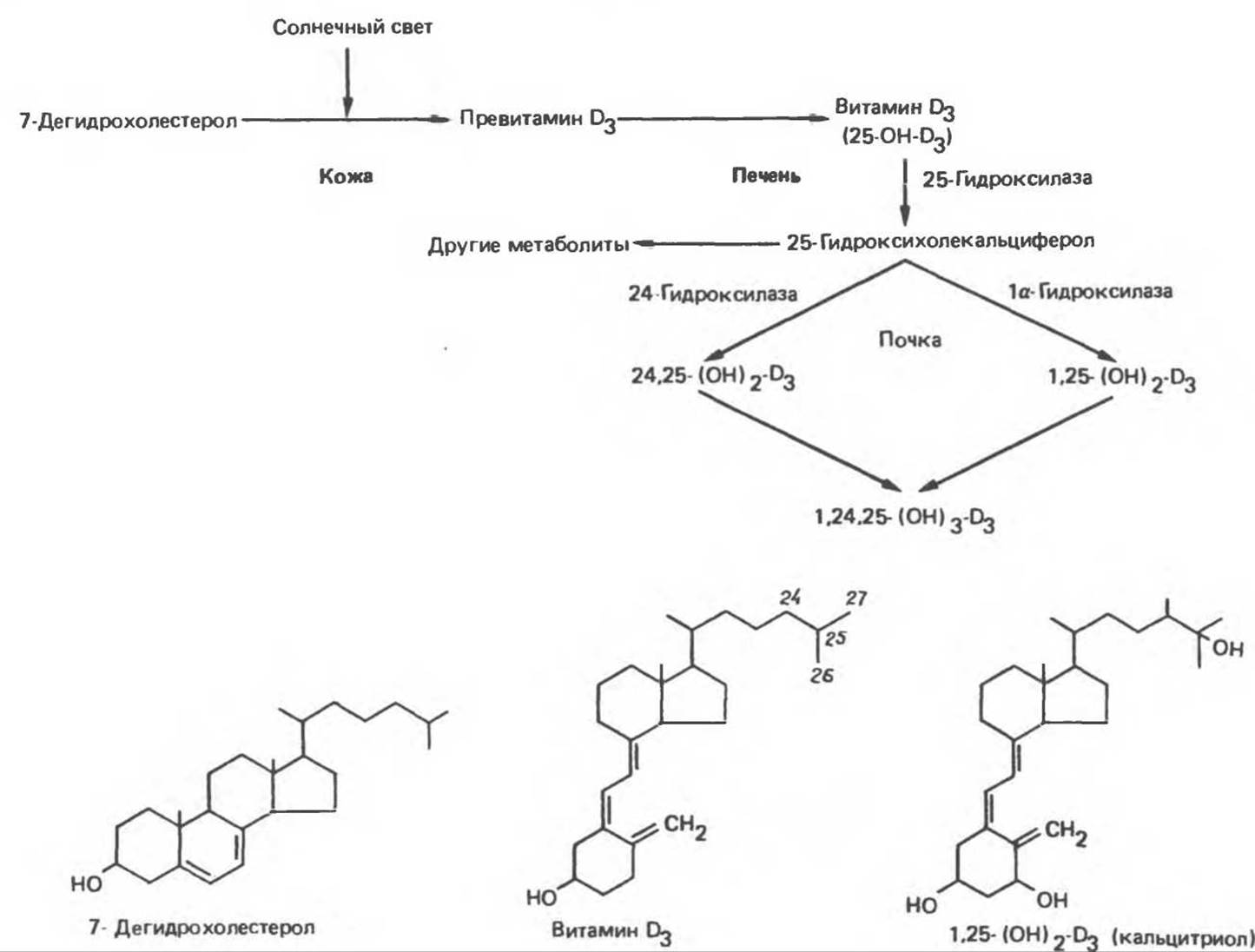
Рис. 47.4. Образование и гидроксилирование витамина D3. 25-Гидроксилирование происходит в печени, гидроксилирование по иным положениям — в почках. Вполне вероятно образование 25, 26-(OH)2-D3 и 1, 25, 26-(OH)3-D3. Изображены формулы 7-дегидрохолестерола, витамина D3 и 1,25-(OH)2-D3 (кальцитриола). (Reproduced, wiht permission, from Ganong W. F. Review of Medical Physiology, 13fh. ed. Appleton and Lange, 1987.)
1. Кожа. Небольшие количества витамина D содержатся в продуктах питания (жир, печень рыб, желток яйца), но большая часть витамина D, используемого в синтезе кальцитриола, образуется в мальпигиевом слое эпидермиса из 7-дегидрохолестерола в ходе неферментативной, зависимой от ультрафиолетового света реакции фотолиза. Активность процесса находится в прямой зависимости от интенсивности облучения и в обратной — от степени пигментации кожи. С возрастом содержание 7-дегидрохолестерола в эпидермисе снижается, что может иметь прямое отношение к развитию отрицательного баланса кальция у стариков.
2. Печень. Специфический транспортный белок, называемый D-связывающим белком, связывает витамин D3 и его метаболиты и переносит D3 от кожи или кишечника в печень, где он подвергается 25-гидроксилированию, составляющему первый обязательный этап в образовании кальцитриола. 25-Гидроксилирование происходит в эндоплазматическом ретикулуме в ходе реакции, протекающей с участием магния, NADPH, молекулярного кислорода и неидентифицированного цитоплазматического фактора. В реакции участвуют два фермента: NADPH-зависимая цитохром P-450-редуктаза и цитохром Р-450. Реакция не регулируется; она протекает не только в печени, но (с малой интенсивностью) также в почках и кишках. Продукт реакции 25-OH-D3 поступает в плазму крови (составляя основную форму витамина D, присутствующего в крови) и при посредстве D-связывающего белка транспортируется в почки.
3. Почки. 25-OH-D3 является слабым агонистом; для проявления полной биологической активности это соединение должно быть модифицировано путем гидроксилирования при С-1. Это происходит в митохондриях проксимальных извитых почечных канальцев в ходе сложной монооксигеназной реакции, протекающей при участии NADPH, Mg2+, молекулярного кислорода и по крайней мере трех ферментов: 1) почечной ферредоксин-редуктазы (флаво- протеин), 2) почечного ферредоксина (железосодержащий сульфопротеин) и 3) цитохрома Р-450. В этой системе образуется 1,25-(OH)2-D3 — самый активный из природных метаболитов витамина D.
4. Другие ткани. В плаценте содержится 1а-гидроксилаза, которая, по-видимому, играет важную роль как источник внепочечного кальцитриола. Активность этого фермента выявляется и в других тканях, включая костную, однако физиологическое значение фермента этих тканей минимально, судя по тому, что у небеременных животных после нефроэктомии уровень кальцитриола очень низок.
Б. Регуляция метаболизма и синтеза. Подобно другим стероидным гормонам, кальцитриол является объектом жесткой регуляции по механизму обратной связи (рис. 47.4 и табл. 47.1). У интактных животных низкое содержание кальция в пище и гипокальциемия вызывают значительное повышение 1а-гидроксилазной активности. В механизме этого эффекта участвует ПТГ, который также высвобождается в ответ на гипокальциемию. Роль ПТГ при этом пока не ясна, но установлено, что он стимулирует 1а-гидроксилазную активность как у D-авитаминозных животных, так и у животных, получавших витамин D. Недостаток фосфора в диете и гипофосфатемия тоже индуцируют 1а-гидроксилазную активность, но служат, видимо, более слабым стимулом, чем гипокальциемия.
Кальцитриол — важный регулятор своего собственного продуцирования. Повышение уровня кальцитриола тормозит 1а-гидроксилазу почек и активирует синтез 24-гидроксилазы, что ведет к образованию побочного продукта — 24,25-(OH)2-D3, лишенного, по-видимому, биологической активности. Эстрогены, прогестероны и андрогены значительно увеличивают количество 1а-гидроксилазы у овулирующих (несущихся) птиц. Какую роль в синтезе кальцитриола играют эти гормоны (наряду с инсулином, гормоном роста и пролактином) у млекопитающих, остается неясным.
Таблица 47.1. Регуляция почечной 1а-гидроксилазы
|
Первичные регуляторы |
Вторичные регуляторы |
|
Гипокальциемия (↑) |
Эстрогены |
|
ПТГ (↑) |
Андрогены |
|
Гипофосфатемия (↑) |
Прогестерон |
|
Кальцитриол (↑) |
Инсулин |
|
Гормон роста |
|
|
Пролактин |
|
|
Тиреоидный гормон |
Стерольная структура, составляющая основу кальцитриола, может подвергаться модификациям в альтернативных метаболических последовательностях, а именно гидроксилироваться по положениям 1, 23, 24, 25 и 26 с образованием различных лактонов. Было обнаружено свыше 20 метаболитов, но ни для одного из них не удалось однозначно доказать наличие биологической активности.
Механизм действия
Действие кальцитриола на клеточном уровне аналогично действию других стероидных гормонов (рис.47.5). В исследованиях, проведенных с радиоактивным кальцитриолом, было показано, что он накапливается в ядре клеток кишечных ворсинок и крипт, а также остеобластов и клеток дистальных почечных канальцев. Кроме того, он был обнаружен в ядре клеток, в отношении которых и не предполагалось, что они являются клетками-мишенями кальцитриола; речь идет о клетках мальпигиевого слоя кожи и островков Лангерганса поджелудочной железы, некоторых клетках головного мозга, а также некоторых клетках гипофиза, яичников, семенников, плаценты, матки, грудных желез, тимуса, клетках-предшественниках миелоидного ряда. Связывание кальцитриола было обнаружено и в клетках паращитовидных желез, что крайне интересно, так как указывает на возможное участие кальцитриола в регуляции обмена ПТГ.
А. Рецептор кальцитриола. Присутствующий в клетках кишечника белок с мол. массой 90000—100000 связывает кальцитриол с высокой степенью сродства и малой емкостью. Связывание насыщаемо, специфично и обратимо. Таким образом, этот белок отвечает основным критериям, характеризующим рецептор; он обнаружен во многих из перечисленных выше тканей. Если при анализе используют физиологические концентрации солей, то большая часть незанятого рецептора выявляется в ядре в связанном с хроматином виде. Это аналогично локализации рецепторов если не всех стероидных гормонов, то во всяком случае прогестерона и Т3. Остается не ясным, требуется ли для связывания с хроматином предварительная активация комплекса кальцитриол — рецептор, как это имеет место с типичными стероид-рецепторными комплексами.
Б. Кальцитриол-зависимые генные продукты. Как известно уже на протяжении ряда лет, изменение процессов транспорта в кишечных клетках в ответ на добавление кальцитриола требует участия РНК и синтеза белка. Исследования, показавшие связывание в ядре рецепторов кальцитриола с хроматином, позволили предположить, что кальцитриол стимулирует транскрипцию генов и образование специфических мРНК. Действительно, удалось выявить один такой пример, а именно индукцию мРНК, кодирующей кальций-связывающий белок (КСБ).
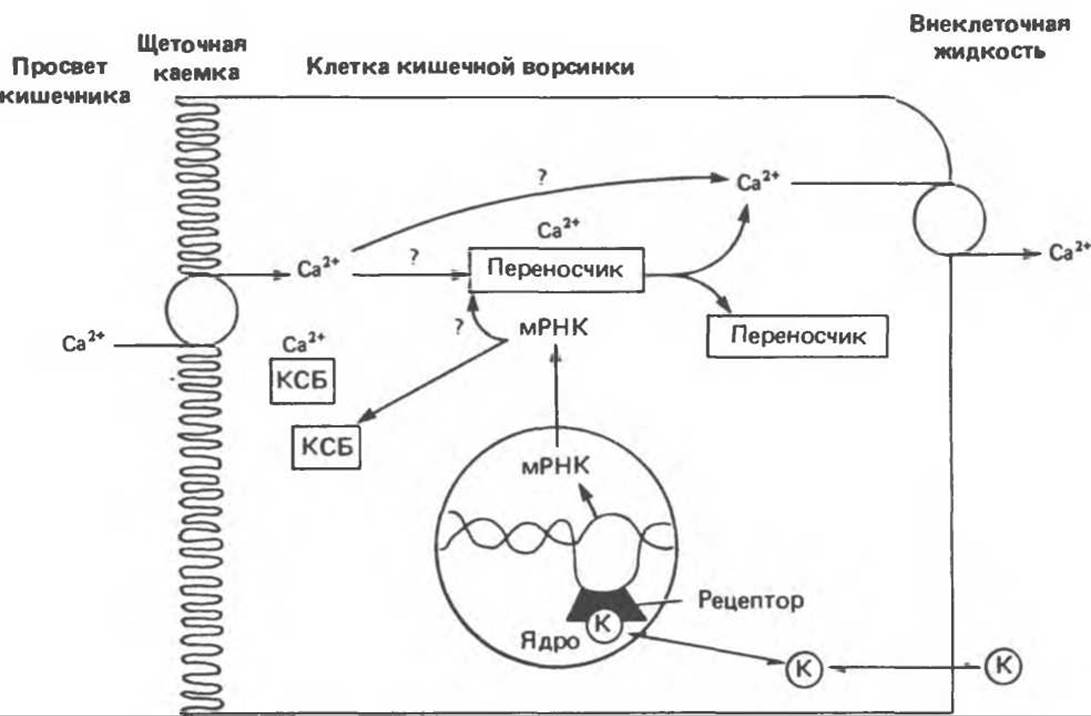
Рис. 47.5. Кальцитриол (К) функционирует подобно другим стероидным гормонам. Он индуцирует генные продукты, обеспечивающие перенос кальция из просвета кишечника во внеклеточную жидкость. КСБ — кальций-связывающий белок.
Существует несколько цитозольных белков, связывающих Са2+ с высокой степенью сродства. Часть из них принадлежит к группе кальцитриол- зависимых. В группу входит несколько белков, различающихся по молекулярной массе, антигенности и тканевому происхождению (кишки, кожа, кость). Из этих белков лучше всего изучен КСБ клеток кишечника. У D-авитаминозных крыс КСБ в таких клетках практически отсутствует; в целом концентрация КСБ в высокой степени коррелирует с количеством кальцитриола ядерной локализации.
В. Влияние кальцитриола на слизистую кишечника. Для переноса Са2+ и РО3- через слизистую кишки необходимы 1) захват и перенос через мембрану щеточной каемки и микроворсинок, 2) транспорт через мембрану клеток слизистой, 3) выведение через базальную латеральную мембрану во ВЖ. Совершенно очевидно, что кальцитриол активирует один или более из этих этапов, но конкретный механизм его действия не установлен. Предполагалось, что непосредственное участие в этом принимает КСБ, но впоследствии было показано, что перенос Са2+ происходит через 1—2 ч после введения кальцитриола, т. е. задолго до увеличения концентрации КСБ в ответ на кальцитриол. Вероятно, КСБ, связывая Са2+, защищает от него клетки слизистой в периоды активного транспорта этого иона. Некоторые исследователи продолжают поиски белков, могущих участвовать в транспорте Са2+, тогда как другие считают, что этот процесс, в особенности начальное увеличение тока Са2+, может быть опосредован изменением заряда мембраны. Обсуждается также роль метаболитов полифосфоинозитидов.
Г. Влияние кальцитриола на другие ткани. О действии кальцитриола на иные ткани известно гораздо меньше. Его ядерные рецепторы выявлены в клетках кости, причем показано, что обусловленное кальцитриолом увеличение концентрации Са2+ сопряжено с синтезом РНК и белка. Однако генные продукты, предположительно индуцируемые кальцитриолом, не идентифицированы; не известен также механизм связи между кальцитриолом и ПТГ в их действии на клетки кости.
Любопытное указание на роль кальцитриола в клеточной дифференцировке получено в исследованиях, продемонстрировавших, что этот гормон способствует превращению клеток промиелоцитарной лейкемии в макрофаги. Поскольку, как предполагают, остеокласты либо являются родственными макрофагам клетками, либо непосредственно происходят из них, вполне вероятно, что кальцитриол участвует в этом процессе, способствуя дифференцировке клеток кости.
Патофизиология
Рахит — заболевание детского возраста, которое характеризуется низким уровнем кальция и фосфата в плазме крови и нарушением минерализации костей, ведущим к деформациям скелета. Чаще всего рахит вызывается недостатком витамина D. Различают два типа наследственного витамин D-зависимого рахита. Тип I обусловлен аутосомным рецессивным геном, детерминирующим нарушение превращения 25-OH-D3 в кальцитриол. Тип II представляет собой аутосомныи рецессивный дефект, при котором, по всей видимости, отсутствуют рецепторы кальцитриола.
У взрослых недостаточность витамина D вызывает остеомаляцию. При этом наблюдается снижение как всасывания кальция и фосфата, так и уровня этих ионов во ВЖ. Вследствие этого нарушается минерализация остеоида и формирование кости; такая недостаточная минерализация костей обусловливает их структурную слабость. В случаях когда значительная часть паренхимы почек повреждена патологическим процессом или утрачена, образование кальцитриола снижается и соответственно уменьшается всасывание кальция. Последующая гипокальциемия вызывает компенсаторное увеличение секреции ПТГ, который воздействует на костную ткань таким образом, чтобы вызвать увеличение уровня Са2+ во ВЖ. Этому сопутствует интенсивное обновление костей, их структурные изменения; развиваются симптомы заболевания, известного как почечная остеодистрофия. Своевременное, на ранней стадии лечение витамином D позволяет ослабить проявление болезни.