Биохимия человека Том 2 - Марри Р. 1993
Биохимия внутри- и межклеточных коммуникаций
Гормоны, регулирующие метаболизм кальция
Гормоны, участвующие в гомеостазе кальция - Паратиреоидный гормон (ПТГ)
Структура
ПТГ — одноцепочечный пептид, состоящий из 84 аминокислотных остатков (мол. масса 9500) и не содержащий углеводов или каких-либо иных ковалентно-связанных компонентов (рис. 47.1). Вся биологическая активность принадлежит N-концевой трети молекулы: ПТГ1-34 полностью активен. Область 25—34 ответственна в первую очередь за связывание с рецептором.
ПТГ синтезируется в виде молекулы-предшественника, состоящего из 115 аминокислотных остатков (рис. 47.1). Непосредственный предшественник ПТГ — это проПТГ, отличающийся от активного гормона тем, что содержит на N-конце дополнительный гексапептид с выраженными основными свойствами и неясной функцией. Первичным генным продуктом и непосредственным предшественником проПТГ оказался препроПТГ; он отличается от проПТГ наличием дополнительной N-концевой последовательности из 25 аминокислотных остатков, обладающей (как и другие лидерные или сигнальные последовательности, характерные для секреторных белков) гидрофобными свойствами. Полная структура препроПТГ и последовательности проПТГ и ПТГ показаны на рис. 47.1.
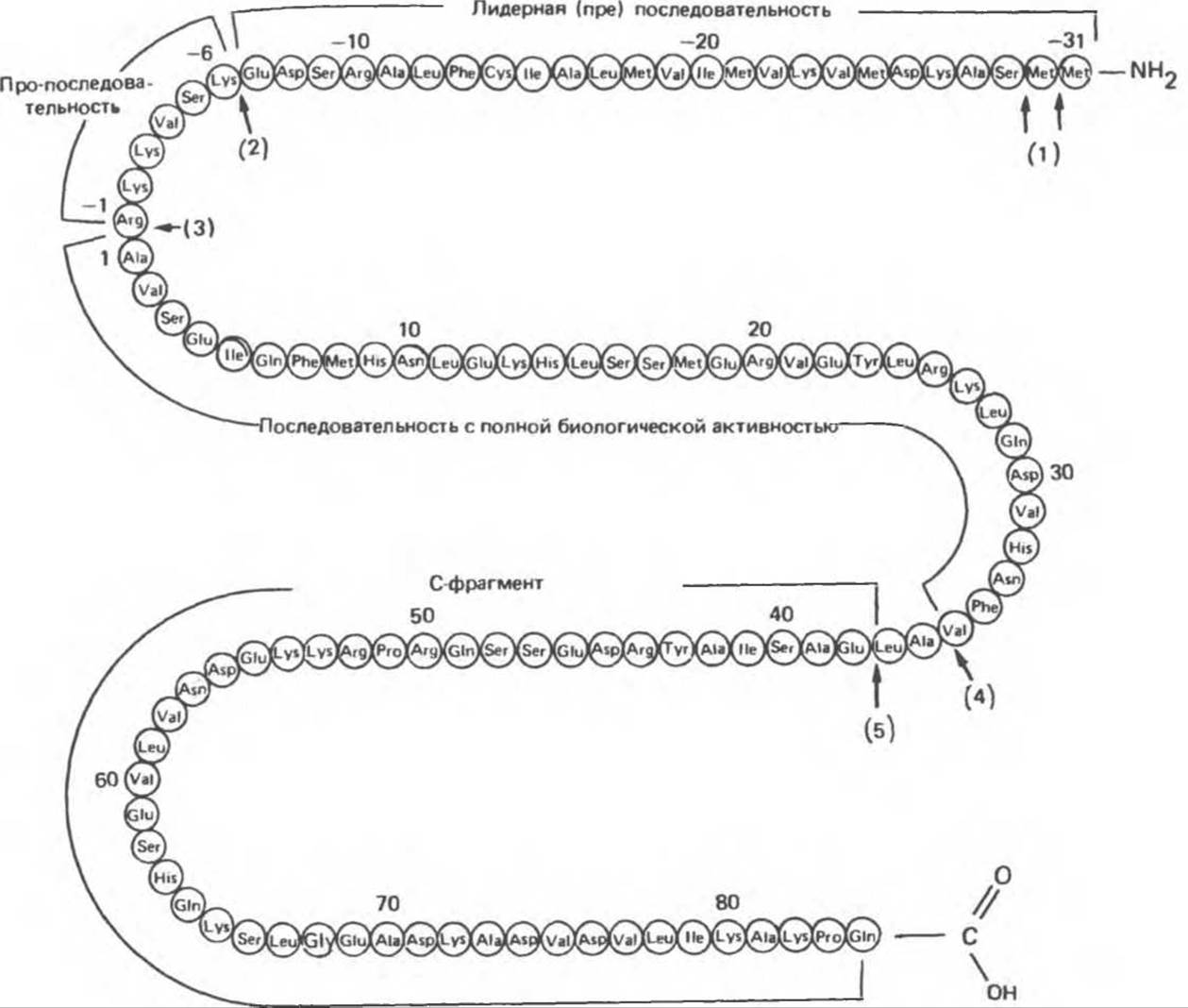
Рис. 47.1. Структура препропаратиреоидного гормона быка. Стрелками указаны участки ферментативного расщепления, осуществляемого при процессинге гормона в паращитовидной железе (1—5) и после секреции гормона — в печени (4,5). К биологически активной области молекулы присоединена последовательность, не участвующая в проявлении опосредованной рецепторами активности. (Slightly modified and reproduced, with permission, from Habener J. F., Recent advances in parathyroid hormone research. Clin. Biochem 1981; 14:223.)
ПрепроПТГ оказался первым идентифицированным препрогормоном. Последовательные стадии его превращения в ПТГ показаны на рис. 47.2. По мере того как молекулы препроПТГ синтезируются на рибосомах, происходит их перенос внутрь цистерн эндоплазматического ретикулума. Во время переноса отщепляется препептид из 25 аминокислотных остатков (сигнальный или лидерный пептид) и образуется проПТГ. Далее проПТГ транспортируется в аппарат Гольджи, где происходит ферментативное отщепление пропептида и образование конечного продукта — ПТГ. Из аппарата Гольджи ПТГ поступает в секреторные пузырьки (везикулы) и далее этот гормон может 1) накапливаться, 2) распадаться, 3) немедленно секретироваться.
Участие ПТГ в минеральном гомеостазе
А. Кальциевый гомеостаз. На центральную роль ПТГ в обмене кальция указывает следующее наблюдение: в процессе эволюции этот гормон впервые появляется у животных, пытающихся адаптироваться к наземному существованию. В основе физиологического механизма поддержания баланса кальция лежат долгосрочные эффекты ПТГ, который регулирует всасывание кальция в кишечнике путем стимуляции образования кальцитриола. В случаях хронической недостаточности Ca2+ в пище его поступление путем всасывания в кишечнике оказывается неадекватным потребностям и тогда включается сложная регуляторная система, в которой тоже участвует ПТГ. При этом ПТГ восстанавливает нормальный уровень кальция во внеклеточной жидкости путем прямого воздействия на кости и почки и опосредованного (через стимуляцию синтеза кальцитриола) на слизистую кишечника. ПТГ 1) повышает скорость растворения кости (вымывание как органических, так и неорганических компонентов), что обеспечивает переход Са2+ во ВЖ; 2) снижает почечный клиренс, т. е. экскрецию кальция, тем самым способствуя повышению концентрации этого катиона во ВЖ; 3) посредством стимуляции образования кальцитриола увеличивает эффективность всасывания Са2+ в кишечнике. Быстрее всего проявляется действие ПТГ на почки, но самый большой эффект дает воздействие на кости. Таким образом, ПТГ предотвращает развитие гипокальциемии при недостаточности кальция в пище, но этот эффект осуществляется за счет вещества кости.

Рис. 47.2. Предшественники и продукты расщепления ПТГ и локализация отдельных этапов расщепления в паращитовидных железах и печени. Цифры в скобках соответствуют числу аминокислот в пре(31) и про(6) фрагментах.
Б. Гомеостаз фосфата. Парным кальцию ионом обычно является фосфат; кристаллы гидроксиапатита в костях состоят из фосфата кальция. Когда ПТГ стимулирует растворение минерального матрикса кости, фосфат высвобождается вместе с кальцием. ПТГ повышает также почечный клиренс фосфата. В итоге суммарный эффект ПТГ на кости и почки сводится к увеличению концентрации кальция и снижению концентрации фосфата во ВЖ. Очень важно, что тем самым предотвращается возможность перенасыщения плазмы крови кальцием и фосфатом.
Биохимия
А. Регуляция синтеза. Концентрация Са2+ в среде не влияет на скорость синтеза проПТГ, но скорость образования и секреции ПТГ значительно возрастает при снижении концентрации Са2+. Оказалось, что 80—90% синтезированного проПТГ не удается обнаружить в виде ПТГ, накапливаемого в клетках либо в среде инкубации при проведении опытов in vitro. Отсюда был сделан вывод, что большая часть синтезированного проПТГ быстро распадается. Позднее было обнаружено, что скорость процесса распада снижается при низких концентрациях Са2+ и увеличивается при высоких. Таким образом, кальций влияет на продукцию ПТГ путем регуляции процесса распада, а не синтеза. Об уровне общего синтеза проПТГ можно судить по количеству ПТГ-мРНК; оказалось, что и оно не меняется при значительных колебаниях концентраций внеклеточного Са2+. По-видимому, увеличение синтеза ПТГ в организме может произойти лишь в результате возрастания числа и размеров вырабатывающих ПТГ главных клеток паращитовидных желез.
Б. Регуляция метаболизма. Распад ПТГ начинается спустя примерно 20 мин после синтеза проПТГ и на первоначальном этапе не зависит от концентрации Са2+; распаду подвергаются молекулы гормона, находящиеся в секреторных везикулах. Вновь образованный ПТГ либо немедленно секретируется, либо накапливается в везикулах для последующей секреции. Процессы распада начинаются после того, как секреторные везикулы попадают в компартмент накопления.
В ходе протеолитического расщепления ПТГ образуются весьма специфические фрагменты (рис. 47.1 и 47.2), причем большое количество С-концевых фрагментов ПТГ поступает в кровь. Их молекулярная масса составляет около 7000. В основном это последовательность ПТГ37-84, в меньшей степени — ПТГ34-84. Большая часть новосинтезированного ПТГ подвергается протеолизу; в целом на один моль интактного ПТГ секретируются примерно два моля С-концевых фрагментов. Таким образом, ПТГ в крови представлен в основном этими молекулами. Биологическая роль С-концевых фрагментов ПТГ не выявлена, но возможно, что они удлиняют время существования гормона в кровотоке. В ткани паращитовидных желез был обнаружен ряд протеолитических ферментов, в том числе катепсины В и D. Катепсин В расщепляется ПТГ на два фрагмента — ПТГ1-16 и ПТГ37-84; последний не подвергается дальнейшему протеолизу, а ПТГ1-36 быстро последовательно расщепляется до ди- и трипептидов. ПроПТГ не поступает в кровь; ПТГ1-34 выходит из железы в минимальных количествах (если вообще выходит). Пре-проПТГ удалось идентифицировать путем расшифровки кодирующей последовательности гена ПТГ. Протеолиз ПТГ проходит в основном в паращитовидной железе, но, кроме того, как показано в ряде работ, секретированный ПТГ подвергается протеолизу и в других тканях. Однако вклад этого протекающего вне эндокринной железы процесса в общий протеолитический распад ПТГ не определен; неизвестно также, какие протеазы участвуют в расщеплении и насколько сходны последовательность и продукты протеолиза.
В периферическом обмене секретированного ПТГ участвуют печень и почки. После гепатоэктомии фрагменты 34—84 практически исчезают из крови, из чего следует, что печень служит основным органом, в котором они образуются. Роль почек состоит, по-видимому, в удалении из крови и экскреции этих фрагментов. Периферический протеолиз протекает главным образом в купферовых клетках, выстилающих просвет синусоидов печени. Эндопептидаза, ответственная за начальный этап протеолиза (расщепление на N- и С-концевые фрагменты), локализована на поверхности этих макрофагоподобных клеток, непосредственно контактирующих с плазмой крови. Этот фермент, который также является катепсином В, расщепляет ПТГ между 36 и 37 остатками; аналогично событиям в паращитовидной железе образовавшийся С-концевой фрагмент продолжает циркулировать в кровотоке, а N-концевой быстро распадается.
В. Регуляция секреции. Секреция ПТГ находится в обратной зависимости от концентрации ионов кальция и магния в среде, а также от уровня иммунореактивного ПТГ в крови. Как показано на рис. 47.3, между содержанием ПТГ в сыворотке крови и концентрацией кальция в ней (в пределах от 4 до 10,5 мг% сыворотки) существует линейная зависимость.
Присутствие биологически активного ПТГ в сыворотке крови в случаях, когда уровень кальция достигает 10,5 мг% и более, служит признаком гиперпаратиреоза.
Существует также линейная зависимость между высвобождением ПТГ и уровнем сАМР в клетках паращитовидных желез. Вероятно, эта зависимость опосредована изменениями уровня Са2+ в клетках, поскольку между внутриклеточными концентрациями Са2+ и с АМР существует обратная связь. В основе ее может лежать хорошо известный активирующий эффект кальция на фосфодиэстеразу (через Ca2+/кальмодулин-зависимую протеинкиназу) либо ингибирующий эффект (по аналогичному механизму) на аденилатциклазу. Фосфат не влияет на секрецию ПТГ.
В паращитовидных железах сравнительно мало накопительных гранул, и количество гормона в них может обеспечить максимальную секрецию лишь в течение 1,5 ч. Это составляет контраст с островковой тканью поджелудочной железы, где содержание инсулина достаточно для нескольких дней секреции, а также со щитовидной железой, содержащей запас гормона на несколько недель. Таким образом, процессы синтеза и секреции ПТГ должны идти беспрерывно.
Механизм действия
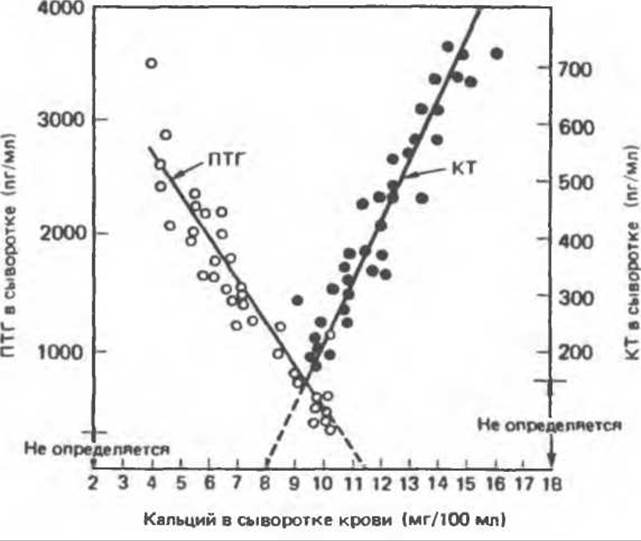
Рис. 47.3. Концентрация кальцитонина (КТ) и паратиреоидного гормона (ПТГ) как функция концентрации кальция в плазме крови. (Modified and reproduced, with permission, from Arnaud C. D., Litlledike T., Tsao H.S. Calcium homeostasis and the simultaneous measurement of calcitonin and parathyroid hormone in pig. Pages 95 — 101. In: Calcitonin: Proc. of the 2 nd intern. Symp. Taylor S. (ed.). Heinemann, 1969.)
А. Рецептор ПТГ. ПТГ связывается с мембранным рецептором, представленным простым белком с мол. массой около 70000. В клетках почек и кости рецепторы, по-видимому, идентичны; в клетках, не являющихся мишенями ПТГ, этот белок отсутствует. Взаимодействие гормона с рецептором инициирует типичный каскад событий: активация аденилатциклазы — увеличение клеточной концентрации сАМР — увеличение содержания кальция в клетке — фосфорилирование специфических внутриклеточных белков киназами — активация определенных внутриклеточных ферментов или белков, определяющих в конечном счете биологическое действие гормона. Система, отвечающая на действие ПТГ, подобно системам других белковых и пептидных гормонов, является объектом понижающей регуляции количества рецепторов; кроме того, ей свойствен феномен «десенситизации», механизм которой связан не с увеличением содержания сАМР, а с последующими реакциями каскада.
Б. Влияние ПТГ на кости. ПТГ проявляет множественные эффекты на костную ткань, влияя, по-видимому, на разные типы ее клеток. Суммарный эффект ПТГ — деструкция кости, сопровождающаяся высвобождением кальция, фосфора и элементов органического матрикса, в том числе продуктов распада коллагена. Клетками, ответственными за этот процесс, могут быть остеокласты, относительно которых доказано, что они разрушают кость при хронической стимуляции посредством ПТГ, либо остеоциты, которые тоже способны резорбировать кость. Возможно, ПТГ стимулирует дифференцировку клеток-предшественников и их превращение в клетки, резорбирующие кость. В низких концентрациях, вероятно соответствующих физиологическим, ПТГ оказывает анаболический эффект и ответствен за перестройку кости. При воздействии этих концентраций гормона наблюдается увеличение числа остеобластов, возрастание активности щелочной фосфатазы, свидетельствующее о формировании новой костной ткани, и повышенное включение радиоактивной серы (в виде сульфата) в хрящ. В действии ПТГ на кость пермиссивную роль может играть кальцитриол.
Внутриклеточным посредником ПТГ служит, видимо, Са2+. Первое проявление эффекта ПТГ состоит в снижении концентрации Са2+ в перицеллюлярном пространстве и возрастании его внутри клетки. Увеличение внутриклеточного кальция стимулирует синтез РНК в клетках кости и высвобождение ферментов, участвующих в резорбции кости. Эти процессы, по-видимому, опосредованы присоединением кальция к кальмодулину. В отсутствие внеклеточного кальция ПТГ по-прежнему повышает концентрацию сАМР, но уже не стимулирует резорбцию кости. Таким образом, важным условием для проявления стимулирующего действия ПТГ на резорбцию кости может быть парадоксальное увеличение входа ионизированного кальция в резорбирующие кость клетки.
В. Влияние ПТГ на почки. ПТГ оказывает на почки целый ряд эффектов, а именно он влияет на транспорт некоторых ионов и регулирует синтез кальцитриола. В нормальных условиях свыше 90% Са2+. содержащегося в клубочковом фильтрате, подвергается ресорбции (реабсорбции), но ПТГ увеличивает эту величину до 98% и более. Ресорбция фосфата в норме составляет 75—90% в зависимости от диеты и некоторых других факторов; ПТГ тормозит ресорбцию фосфата независимо от ее базального уровня. ПТГ ингибирует также транспорт ионов натрия, калия и бикарбоната. Эффект ПТГ на метаболизм кальцитриола (см. ниже) осуществляется, видимо, через те же участки (сайты) клеток, что и действие на минеральный обмен.
При вливании ПТГ наблюдается быстрое увеличение концентрации сАМР в почечных клетках и выведение сАМР с мочой. Этот эффект предшествует характерной для действия ПТГ фосфатурии и, очевидно, ответствен за нее. ПТГ-стимулируемая аденилатциклаза находится в базолатеральной части клеток, расположенных в кортикальных участках почечных канальцев; она отличается от аденилатциклазы почек, стимулируемой кальцитонином, катехоламином и АДГ. Внутриклеточные белки - рецепторы сАМР (т. е., как принято считать, протеинкиназы) — выявляются в щеточной каемке этих клеток, на люминальной поверхности канальцев. Следовательно, сАМР, синтезированная под влиянием ПТГ, мигрирует от базолатеральной области клетки к ее поверхности, обращенной в просвет канальца, где и оказывает эффект на транспорт ионов.
Кальций, видимо, вовлечен в механизм действия ПТГ на почки. В самом деле, первый физиологический эффект введения ПТГ — снижение содержания Са2+ во внеклеточной жидкости и увеличение его внутри клетки. Однако эти сдвиги происходят после изменения внутриклеточной концентрации сАМР, так что в почках связь между током Са2+ в клетки и действием ПТГ не столь отчетлива, как в кости.
Г. Влияние ПТГ на слизистую кишечника. ПТГ, по-видимому, не оказывает прямого эффекта на транспорт Са2+ через слизистую кишечника, но он служит решающим фактором регуляции биосинтеза кальцитриола (см. ниже) и оказывает безусловно важное непрямое действие на кишки.
Патофизиология
Недостаток ПТГ приводит к гипопаратиреозу. Биохимические признаки этого состояния — сниженный уровень ионизированного кальция и повышенный уровень фосфата в сыворотке крови. К числу симптомов относится высокая нейромышечная возбудимость, вызывающая (при умеренной тяжести) судороги и тетанические сокращения мышц. Тяжелая острая гипокальциемия ведет к тетаническому параличу дыхательных мышц, ларингоспазму, сильным судорогам и смерти. Длительная гипокальциемия сопровождается изменениями в коже, развитием катаракт и кальцификацией базальных ганглиев мозга. Причиной гипопаратиреоза обычно служит случайное удаление или повреждение паратиреоидных желез при операциях на шее (вторичный гипопаратиреоз), но иногда болезнь возникает вследствие аутоиммунной деструкции паратиреоидных желез (первичный гипопаратиреоз).
Псевдогипопаратиреоз обсуждается в гл. 44. При этом наследственном заболевании эндокринная железа продуцирует биологически активный ПТГ, но органы-мишени к нему резистентны, т.е. он не оказывает эффекта. В результате возникают те же биохимические сдвиги, что и при гипопаратиреозе. Они сопряжены обычно с такими нарушениями развития, как малый рост, укороченные пястные и плюсневые кости, задержка умственного развития. Существует несколько типов псевдогипопаратиреоза; их связывают 1) с частичным дефицитом регуляторного Gs-белка аденилатциклазного комплекса либо 2) с нарушением какого-то этапа, не относящегося к механизму образования сАМР.
Гиперпаратиреоз, т.е. избыточная продукция ПТГ, возникает, как правило, вследствие аденомы паратиреоидных желез, но может быть обусловлен и их гиперплазией либо эктопической продукцией ПТГ злокачественной опухолью. Биохимические критерии гиперпаратиреоза — повышенные уровни ионизированного кальция и ПТГ и сниженный уровень фосфата в сыворотке крови. В запущенных случаях гиперпаратиреоза можно наблюдать выраженную резорбцию костей скелета и различные повреждения почек, включая камни в почках, нефрокальциноз, частое инфицирование мочевых путей и (в отдельных случаях) снижение функции почек. Вторичный гиперпаратиреоз, характеризующийся гиперплазией паратиреоидных желез и гиперсекрецией ПТГ, можно наблюдать у больных с почечной недостаточностью. Считается, что развитие гиперпаратиреоза у этих больных обусловлено снижением синтеза 1,25- (OH)2-D3 из 25-OH-D3 в патологически измененной паренхиме почек и, как следствие, нарушением всасывания кальция в кишечнике; это нарушение в свою очередь вызывает вторичное высвобождение ПТГ как компенсаторную реакцию организма, направленную на поддержание нормальных уровней кальция во ВЖ.