Биохимия человека Том 2 - Марри Р. 1993
Частные вопросы
Сократительные и структурные белки
Клеточная подвижность и цитоскелет
Совершенно очевидно, что механическую работу, включающую амебоидные движения, морфогенез, деление, эндоцитоз, экзоцитоз, внутриклеточный транспорт и изменение формы, выполняют и немышечные клетки. Эти клеточные функции осуществляются обширной внутриклеточной сетью волокнистых структур, образующих цитоскелет. Клеточная цитоплазма — это не просто мешок с жидкостью, как думали раньше. Практически все эукариотические клетки содержат три типа волокнистых структур: актиновые филаменты (нити) (7—9,5 нм в диаметре), микротрубочки (25 нм) и промежуточные нити (10—12 нм). Каждый из этих типов можно отличить с помощью специфических биохимических и электронно-микроскопических методик.
Немышечный актин
Белок G-актин, выделенный из немышечных клеток, имеет мол. массу около 43 000 и, подобно мышечному актину (а-актину), содержит N-метилгистидиловые остатки. В присутствии магния и хлористого калия этот актин спонтанно полимеризуется с образованием двуспиральных F-актиновых нитей, подобных мышечным филаментам. В немышечных клетках имеется по меньшей мере два типа актина: ß-актин и у-актин. Оба они могут присутствовать в одной и той же клетке и даже, вероятно, сополимеризоваться в одну и ту же нить. В цитоплазме клеток актин образует микрофиламенты диаметром 7—9,5 нм. которые часто имеют вид пучков спутанных сетей. Пучки микрофиламентов располагаются под плазматической мембраной покоящихся клеток и называются «стрессовыми» фибриллами. Эти фибриллы имеют структуру двойной спирали и декорированы миозиновым фрагментом S-1 (рис. 56.10). Стрессовые фибриллы исчезают при увеличении клеточной подвижности, а также при злокачественной трансформации клеток химическими агентами или онкогенными вирусами.
Микрофиламенты плотно упакованы в виде петлистой сети, располагающейся под ведущим краем или «бахромой» подвижной клетки (рис. 56.11). Актиновые микрофиламенты обнаруживаются во всех клеточных микроотростках, таких, как филоподии и микроворсинки. Например, микроворсинки клеток слизистой кишечника содержат 20—30 актиновых микрофиламентов, расположенных продольно, как показано на рис. 56.12. Эти микрофиламенты, декорированные миозиновым фрагментом S-1, проявляют однородную полярность (рис. 56.12). В основании микроворсинок находятся миозиновые филаменты, способные втягиваться вместе с актиновыми нитями в микроворсинки. Процесс сокращения не сопровождается какими-либо изменениями длины актина или миозина и, таким образом, должен осуществляться, как и в мышцах, путем скольжения филаментов, т. е. с помощью механизма, сформулированного Хаксли. Как и в гладких мышцах, активация актин-миозинового взаимодействия и, соответственно, процесса сокращения, опосредуется фосфорилированием легкой цепи миозина.
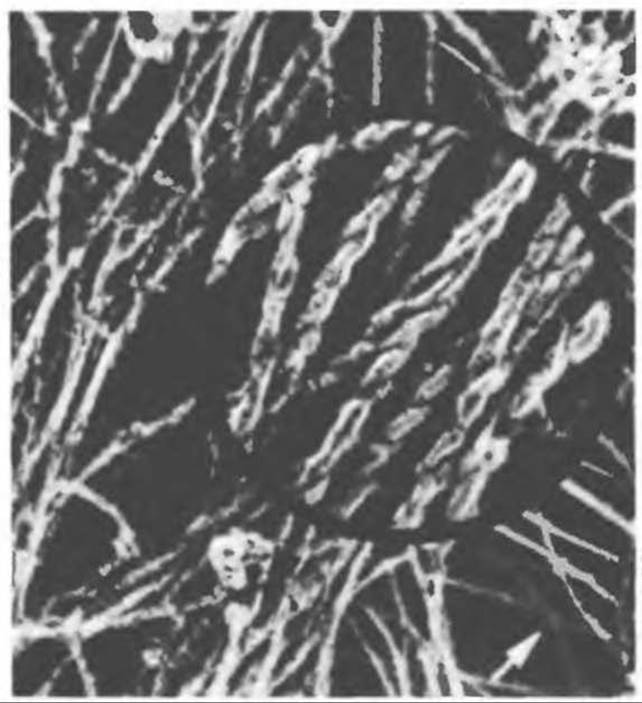
Рис. 56.10. Электронная микрофотография фрагмента цитоскелета, к которому перед быстрым замораживанием был добавлен миозиновый субфрагмент 1 (S-1). Почти все филаменты продольных пучков и многие лежащие между ними филаменты превратились в толстые канатоподобные структуры (в кружочке). Однако некоторые филаменты, самопроизвольно расположившиеся между пучками, остались лишенными «украшений» (стрелка); это преимущественно промежуточные филаменты. х 70 000; в кружочке х 200000. (Reproduced, with permission, from Heuser J. E., Kirschner M. W. Filament organization revelated in platinum replicas of freeze-dried cytoskelctons. J. Cell Biol. 1980, 86. 212.)
Актин и миозин обнаруживаются также между полюсами веретена и хромосомами и вдоль борозды дробления в телофазе митоза.
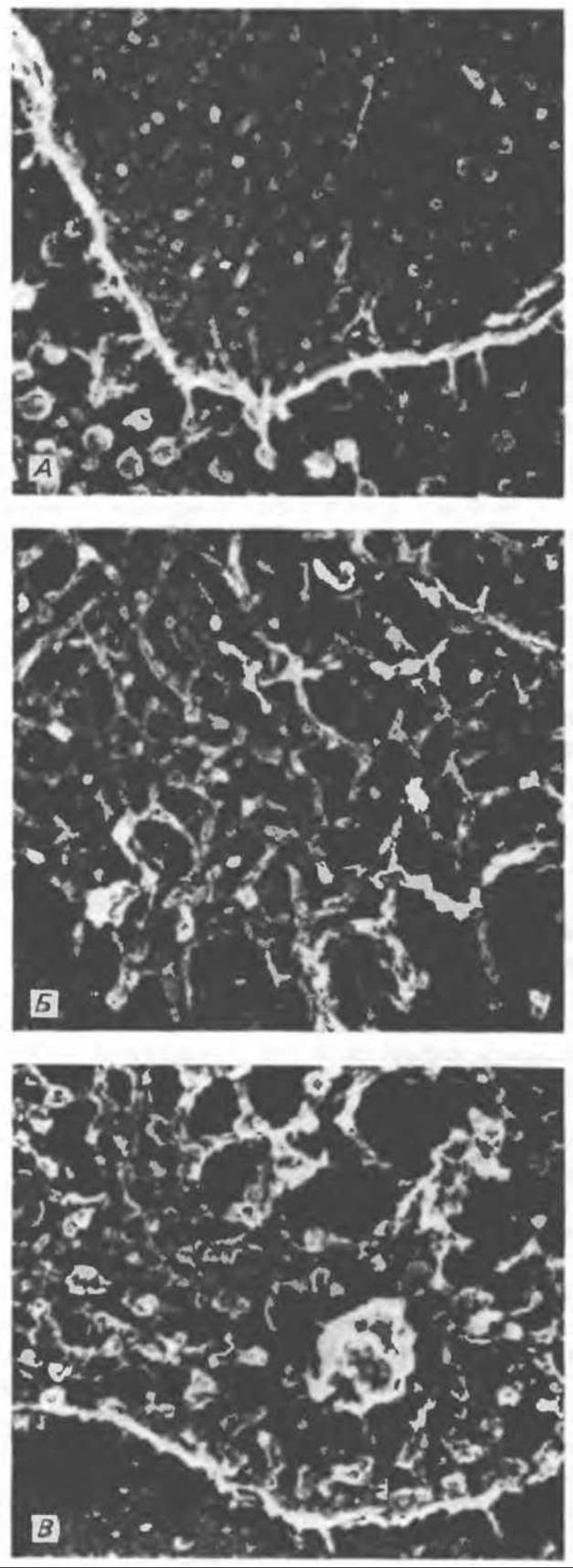
Рис. 56.11. Препараты бахромы или ламеллоподиев из фибробластов (увеличение). А. Полная фиксация. Б. Материал перед фиксацией экстрагирован тритоном В. Экстракция тритоном проведена после фиксации. В первом случае (фото А) плазматическая мембрана интактна и внутренняя структура не видна. Во втором случае (фото F) плазматическая мембрана удалена и видны лежащие под ней переплетения «кудрявых» филаментов. Фото В — плазматическая мембрана также удалена, но уже после фиксации альдегидом. Тонкая сеть подлежащих филаментов после химической фиксации выглядит более грубой. А, х 140000; Б и В, х 115000. (Reproduced, with permission, from Heuser J. E., Kirschner M. W. Filament organization revealed in platinum replicas of freeze-dried cytoskeletons. J. Cell Biol., 1980, 86. 212.)
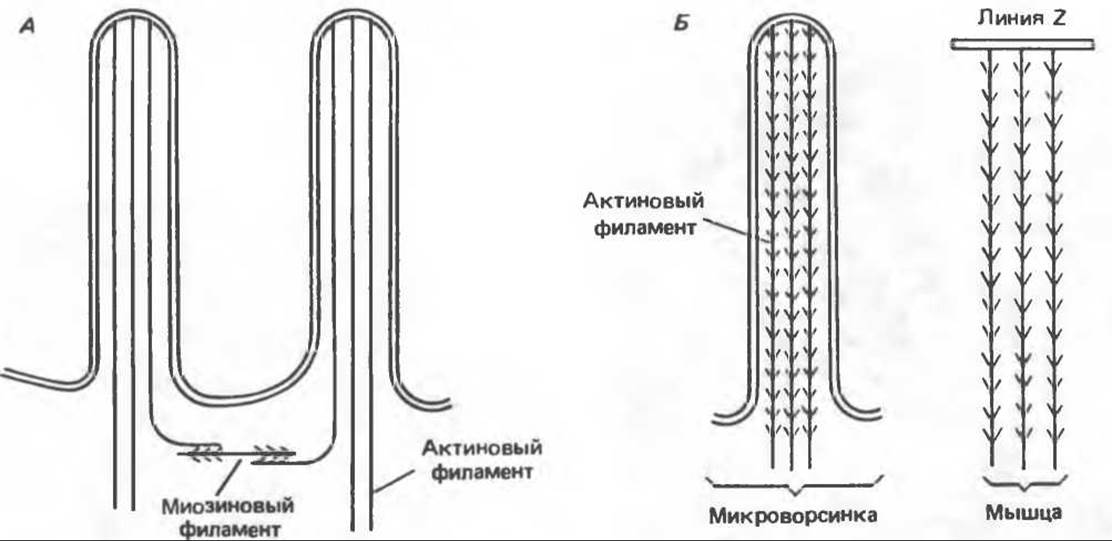
Рис. 56.12. Микроворсинки — это маленькие цитоплазматические выросты эпителиальных клеток, выстилающих тонкий кишечник и увеличивающих всасывающую поверхность. Микроворсинки содержат как актиновые, так и миозиновые филаменты и могут сокращаться подобно мышечным клеткам. Как показано на схеме А, пучки актиновых филаментов входят внутрь каждой микроворсинки; миозиновые филаменты расположены в основании микроворсинок. На схеме Б ориентация актиновых филаментов определена с помощью обработки микроворсинок изолированными «головками» мышечного миозина (тяжелый меромиозин); эти фрагменты сохраняют способность связываться с актиновыми филаментами. При этом образуются комплексы в виде «наконечников стрел», указывающих направление движения филаментов. (Reproduced, with permission, from Lazarides E, Revel J. P.: The molecular bases of cell movement. Sсi. Am. [May] 1979; 240, 100.)
Актиновые микрофиламенты в немышечных клетках связаны с другими белками, подобными мышечным. На плазматических мембранах в местах прикрепления микрофиламентов и на кончиках микроворсинок присутствует а-актинин. Геодезические купола — «леса» цитоскелета, окружающие ядра эукариотических клеток, состоят из актина, а-актинина и тропомиозина. а-Актинин обнаруживается и в самих актиновых микрофиламентах.
Как отмечалось выше, миозин присутствует в основании микроворсинок в связанном с актиновыми микрофиламентами состоянии. Он выявляется также по ходу актиновых волокон, но в виде более тонких и коротких нитей, чем в мышцах. Эти нити, по-видимому, играют роль в поддержании волокнистой структуры актина.
Тропомиозин, как упоминалось выше, участвует в образовании куполов, окружающих ядра. Тропомиозин, локализующийся вдоль актиновых микрофиламентов, вероятно, выполняет структурную, а не двигательную функцию.
Функция немышечного актина регулируется, по-видимому, несколькими специализированными белками. Профилин предотвращает полимеризацию G-актина даже в присутствии достаточных концентраций магния и хлористого калия. Филамин способствует образованию сети актиновых микрофиламентов. Тропомиозин усиливает формирование пучков стрессовых фибрилл актина. а-Актинин способствует прикреплению актиновых микрофиламентов к мембранам, субстрату и другим клеточным органеллам.
Природный пептид цитохалазин разрушает микрофиламенты и предотвращает их полимеризацию. Он часто используется для проверки присутствия микрофиламентов или тестирования их функции.
Подвижность клетки, очевидно, детерминируется бахромчатой мембраной или ламеллоподием, содержащим пальцеподобные выросты, называемые филоподиями. Бахрома своей верхушкой присоединяется к субстрату при помощи филоподиев, и клетка как бы перетекает вперед. Бахрома освобождается и вновь складывается на верхушке клетки, пока новые филоподии не присоединятся к субстрату (рис. 56.13).
Микротрубочки
Микротрубочки — это важнейший компонент клеточного цитоскелета. Они необходимы для образования и функционирования митотического веретена и, следовательно, присутствуют во всех эукариотических клетках. Эти органеллы выполняют и ряд других клеточных функций. Они определяют внутриклеточное перемещение эндоцитозных и экзоцитозных везикул (пузырьков), служат основным структурным компонентом ресничек и жгутиков и главным белковым компонентом аксонов и дендритов. Микротрубочки поддерживают их структуру и участвуют в аксоплазматическом токе веществ вдоль этих нервных отростков.
Микротрубочки представляют собой цилиндры из 13 продольно расположенных протофиламентов, каждый из которых состоит из димеров а- и ß- тубулина (рис. 56.14). а-Тубулин (мол. масса 53000) и ß-тубулин (мол. масса 55 000) являются близкородственными белками. Тубулиновые димеры собираются в протофиламенты, затем в тяжи и, наконец, в цилиндры, как показано на рис. 56.15. Для сборки тубулина в микротрубочки требуются две молекулы GTP на димер тубулина. Два белка, получившие название «высокомолекулярный белок» (ВМБ) и «тау-белок», способствуют образованию микротрубочек, но не обязательны для их сборки. В сборке микротрубочек могут участвовать также кальмодулин и реакции фосфорилирования.

Рис. 56.13. Отдельная клетка тканевой культуры. Структура внизу справа — это бахрома или ламеллоподий, который указывает на ведущий край клетки. Клетка изображена под косым углом, как она движется сквозь субстрат, образуя с помощью бахромы новые точки прикрепления. (Reproduced, with permission, from Lazarides E., Revel J.P.: The molecular basis of cell movement. Sсi. Am. [May] 1979; 240, 100.)
Многие известные алкалоиды способны предотвращать сборку микротрубочек. К ним относятся колхицин и его производное демекольцин (применяющийся для лечения острого подагрического артрита), винбластин (алкалоид Vinca, используемый для лечения рака) и гризеофульвин (противогрибковое средство).
Микротрубочки «растут» в одном направлении от специфических центров (центриолей) внутри клетки. На каждой хроматиде хромосомы (см. гл. 37) имеется кинетохор, откуда начинается рост микротрубочек. Многие нарушения в делении хромосом являются результатом аномалий в структуре или функции кинетохоров. Движение хромосом в анафазе митоза зависит от микротрубочек, но молекулярный механизм этого эффекта пока не расшифрован.
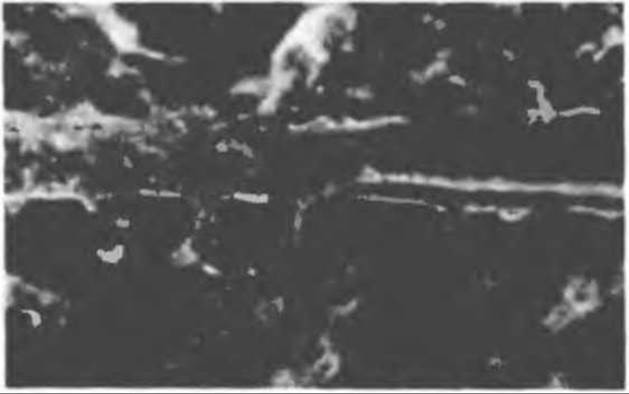
Рис. 56.14. Электронная микрофотография микротрубочки с деформированной вследствие быстрого замораживания структурой. В левой половине рисунка видна наружная поверхность микротрубочки с пучками протофиламентов, отстоящими друг от друга на 55 нм. Справа микротрубочка лопнула, так что видны ее внутренние стенки и расположенные под углом полосы, разделенные промежутками в 40 нм. Считают, что ретикулум, окружающий микротрубочку, состоит из неполимеризованного тубулина и связанных с микротрубочкой белков. (Reproduced, with permission, from Heuser J. E., Kirschner M. W. Filament organization revealed in platinum replicas of frase-dried cytoskeletons. J. Cell Biol. 1980, 86, 212.)
В основании жгутиков и ресничек эукариотических клеток расположена структура, называемая базальным телом; она идентична центриоле и функционирует как центр формирования девятипарной структуры микротрубочек в жгутиках и ресничках. Эти органеллы специализированы для движения. Каждый член пары (дублета) имеет со своим партнером общую стенку из трех протофиламентов; пары соединены между собой гибким белком, нексином. Движение осуществляется путем скольжения дублетов относительно друг друга, что вызывает волнообразные изгибы ресничек. С одним из дублетов ресничек связан большой белок динеин, обладающий АТРазной активностью, которая необходима для скольжения пар микротрубочек.
Промежуточные филаменты
Недавние исследования продемонстрировали существование внутриклеточной системы волокнистых филаментов. Их диаметр колеблется от 8 до 10 нм, т. е. по толщине они занимают промежуточное положение между микрофиламентами (диаметр 6 нм) и микротрубочками (диаметр 23 нм). Эти филаменты делятся на 6 основных групп, которые имеют общие антигенные детерминанты.
Промежуточные филаменты представляют собой прочные относительно стабильные компоненты цитоскелета, не подверженные быстрой сборке и распаду и не исчезающие при митозе. Данные о некоторых свойствах и локализации промежуточных филаментов суммированы в табл. 56.3.
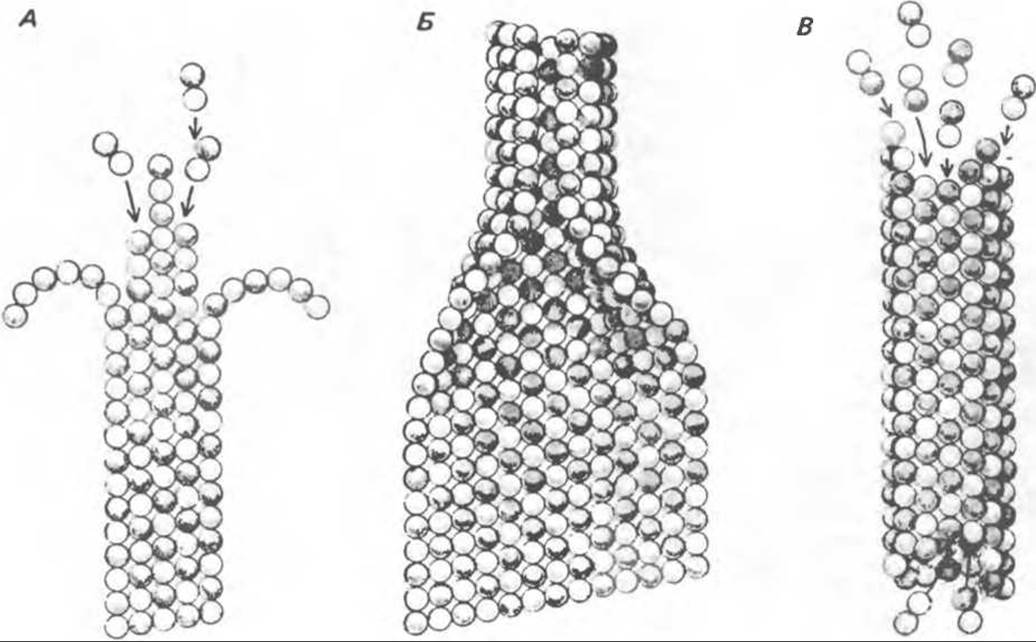
Рис. 56.15. Сборка микротрубочек in vitro начинается с двух белковых глобулярных молекул а- и ß-тубулина. (Вероятно, они имеют более вытянутую форму, чем на рисунке.) Тубулины образуют димеры, или двойные молекулы. Если их концентрация велика, они соединяются с образованием различных промежуточных структур (двойных колец, спиралей и сочетаний колец). В зависимости от условий равновесие сдвигается либо в сторону изолированных димеров, либо промежуточных структур. Можно предположить, что дальше кольца или спирали раскрываются, образуя тяжи (протофиламенты) линейно соединенных димеров, которые смыкаются «бок в бок», формируя цельный покров (А); иногда концы протофиламентов изгибаются. Если покров достаточно широк, он, вероятно, скручиваясь, образует трубку (В). Эта трубка затем удлиняется за счет присоединения димеров преимущественно с одного конца (В). (Reproduced, with permission, from Dustin P. Microtubules. Sсi. Am. [Aug] 1980, 243, 67.)
К промежуточным филамешам относятся кератины I и II типа. Они состоят из 10—20 различных полипептидов, отличающихся как друг от друга, так и от полипептидов, входящих в состав остальных четырех групп белков промежуточных филаментов — десмина, виментина, нейрофиламентов и глиальных филаментов. Между последними четырьмя классами белков отмечается высокая степень гомологии. Кератиновый филамент содержит по меньшей мере два различных кератиновых полипептида, тогда как остальные четыре типа промежуточных филаментов представляют собой гомополимеры. Каждый из них состоит из четырех а-спиральных доменов, отделенных друг от друга участками ß-складчатых слоев и фланкированных с обеих сторон неспиральными концевыми доменами. Неспиральные концевые домены участвуют в растяжении протофиламентов «конец в конец» и в интерпротофибриллярных взаимодействиях «бок в бок». Концы кератиновых микрофибрилл могут перекрестно соединяться дисульфидными связями с образованием нерастворимых филаментов, подобных филаментам шерсти.
Некоторые промежуточные филаменты, особенно мышечного и мезенхимального происхождения, присутствуют в очень многих тканях.
Таблица 56.3. Типы промежуточных филаментов и их распределение
|
Белки |
Мол. масса (тысячи) |
Диаметр (нм) |
Локализация |
|
Кератин типа I и типа II (тонофиламенты) |
40-65 (10-20 главных белков) |
8 |
Эпителиальные клетки (никогда не встречаются в клетках мезенхимального происхождения) |
|
Десмин |
50-55 |
10 |
Мышцы (линия Z) |
|
Виментин |
52 |
10 |
Мезенхимальные и немезенхимальные клетки, такие, как мышечные, глиальные, эпителиальные клетки |
|
Нейрофиламент |
200 150 70 |
10 |
Нейроны |
|
Глиальный филамент |
51 |
10 |
Глиальные клетки |