Биохимия человека Том 2 - Марри Р. 1993
Частные вопросы
Сократительные и структурные белки
Коллаген
Коллаген, главная макромолекула соединительной ткани, является наиболее распространенным белком в животном мире. Он обеспечивает внеклеточный каркас у всех многоклеточных и присутствует практически в любой животной ткани. В тканях млекопитающих существует не менее пяти различных типов коллагена: они образуют семейство молекул со многими общими свойствами. Наиболее характерная особенность коллагеновых молекул — это их трехспиральная структура. Каждая субъединица, или a-цепь, представляет собой левозакрученную спираль, у которой на виток приходится по три аминокислотных остатка. Три такие левые спирали закручиваются далее в правую суперспираль. В результате формируется жесткая палочковидная молекула с диаметром 1,4 нм и длиной около 300 нм. Затем эти молекулы коллагена ассоциируют в фибриллы (рис. 56.16).
Коллагеновые фибриллы образуют продольные зигзагообразные структуры длиной чуть меньше 1/4 длины тройной спирали. Между концом одной тройной спирали и началом следующей имеется пространство, которое может служить местом отложения кристаллов гидроксилапатита при образовании кости. Диаметр коллагеновых фибрилл колеблется от 10 до 100 нм, и под микроскопом они видны в виде пучков в экстрацеллюлярном матриксе соединительной ткани.
Еще одна характерная особенность молекулы коллагена заключается в том, что каждый третий остаток тройной спирали a-цепи представляет собой глицин. Глицин — это единственная аминокислота, размер которой позволяет ей поместиться под центральным ядром тройной спиральной молекулы. Таким образом, центральное ядро этой молекулы состоит из глициновых остатков всех трех а-субъединиц. Эту повторяющуюся структуру можно представить как (Gly-X-Y)n, где X и Y — любые аминокислоты, кроме глицина.
В коллагене млекопитающих около 100 X-положений занято пролином и около 100 Y-положений — 4-гидроксипро липом. Эти «жесткие» аминокислоты ограничивают вращение полипептидного стержня и таким образом увеличивают стабильность тройной спирали. Остатки гидроксипролина придают структуре дополнительную стабильность за счет образования большего количества внутримолекулярных водородных связей (для этого используются окружающие молекулы воды). В некоторых Х-положениях коллагена содержится также 3- гидроксипролин, а в Y-положениях — 5-гидроксилизин.
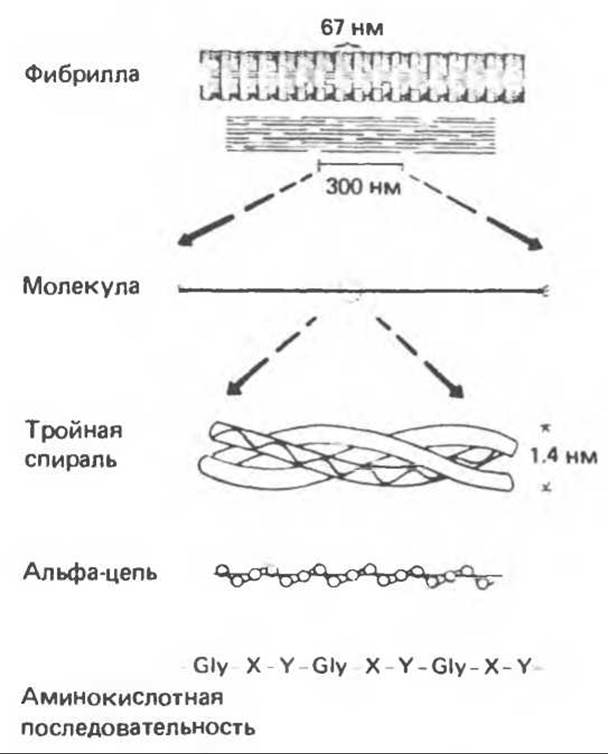
Рис. 56.16. Особенности молекулярной структуры коллагена от первичной последовательности до фибрилл. (Slightly modified and reproduced, with permission, from Eyre D. R: Collagen. Molecular diversity in the body’protein scaffold. Science 1980, 207, 1315.)
Тройная спираль коллагена стабилизируется многочисленными межценочечными поперечными сшивками между лизиловыми и гидроксилизиловыми остатками. Химическая природа этих перекрестных связей рассматривается ниже. Зрелый коллаген представляет собой гликопротеин, содержащий сахариды, связанные с остатками гидроксилизина О-гликозидной связью.
Данные о коллагенах позвоночных, их распределении в тканях и отличительных особенностях суммированы в табл. 56.4.
Синтез коллагена
Коллаген — внеклеточный белок, но он синтезируется в виде внутриклеточной молекулы-предшественника, которая перед образованием фибрилл зрелого коллагена подвергается посттрансляционной модификации. Подобно всем секретируемым белкам, предшественник коллагена претерпевает процессинг в ходе прохождения через эндоплазматический ретикулум и комплекс Гольджи до появления во внеклеточном пространстве. Наиболее ранним предшественником коллагена является препроколлаген, который содержит на N-конце лидерную, или сигнальную, последовательность примерно из 100 аминокислот. Препроколлаген образуется на рибосомах, прикрепленных к эндоплазматическому ретикулуму. Когда сигнальная последовательность проникает в везикулярное пространство эндоплазматического ретикулума, лидерная последовательность отщепляется, а N-конец проколлагена продолжает продвигаться в этом пространстве. Здесь пролиновые и лизиновые остатки в Y-положении пептида (Gly-X-Y)n подвергаются действию соответственно пролил-4-гидроксилазы и лизилгадроксилазы. Пролил-3-гидроксилаза действует на пролиловые остатки в Х-положениях, непосредственно предшествующие 4-гидроксипролину в Y-положениях.
Таблица 56.4. Генетически различные коллагены позвоночных. У высших животных присутствуют по меньшей мере пять различных молекул, содержащих семь генетически различающихся а-цепей
|
Тин |
Молекулярная формула |
Нативный полимер |
Распределение в тканях |
Характерные особенности |
|
I |
[а1(I)]2а2 |
Фибрилла |
Кожа, сухожилия, кости, дентин, фасции; содержится в изобилии |
Низкое содержание гидроксилизина; малое количество сайтов гликозилирования; широкие фибриллы |
|
II |
[а1(II)]3 |
Фибрилла |
Хрящ, nucleus pulposus, нотохорд, стекловидное тело |
Высокое содержание гидроксилизина; сильно гликозилирован; фибриллы обычно тоньше, чем в случае типа I |
|
III |
[а1(III)b |
Фибрилла |
Кожа, матка, кровеносные сосуды; вообще «ретикулиновые» волокна |
Высокое содержание гидроксипролина; низкое содержание гидроксилизина; малое число сайтов гликозилирования гидроксилизина; межцепочечные дисульфидныс связи между цистеинами на С-конце спирали; длинный карбоксильный телопептид |
|
IV |
[al(IV)], (приблизительная, обсуждается) |
Базальная пластина |
Почечные клубочки, капсула хрусталика, мембрана Десцемета; базальная пластина всех эпителиальных и эндотелиальных клеток (?) |
Очень высокое содержание гидроксилизина; почти полностью гликозилирован; относительно богат 3-гидроксипролином; низкое содержание аланина; содержит фрагменты проколлагена |
|
V |
aA(aB)2 или (аА)3 и (аВ)3 |
Неизвестен |
Широко распространен в малых количествах; базальная пластина клеток кровеносных сосудов и гладких мышц; экзоскелет фибробластов и других мезенхимальных клеток (?) |
Высокое содержание гидроксилизина; сильно гликозилирован; низкое содержание аланина; неспособен образовывать нативные фибриллы in vitro |
Молекула проколлагена содержит на N- и Суконцах пептиды с мол. массой соответственно 20 000 и 30000—35000, которые отсутствуют в зрелом коллагене. Оба этих пропептида содержат остатки цистеина. N-концевой пропептид образует только внутрицепочечные дисульфидные связи, С-концевые пептиды образуют и внутри- и межцепочечные дисульфидные связи. Вслед за образованием этих связей молекулы проколлагена собираются в тройную спираль.
После формирования тройной спирали дальнейшее гидроксилирование пролиловых и лизиловых остатков становится невозможным. Гликозилтрансфераза, которая переносит глюкозу или галактозу на остатки гидроксилизина, также может действовать только на a-цепи проколлагена, не имеющие еще спиральной конфигурации.
После завершения этого внутриклеточного процессинга молекулы гликозилированного проколлагена продвигаются к наружной поверхности клетки через комплекс Гольджи. Внеклеточные аминопротеаза и карбоксипротеаза проколлагена удаляют соответственно аминоконцевой и карбоксиконцевой про пептиды. Вновь образованные молекулы коллагена содержат примерно 1000 аминокислот на цепь и спонтанно собираются в коллагеновые фибриллы, неотличимые от зрелых фибрилл, присутствующих в тканях.
Однако эти фибриллы не обладают силой напряжения зрелых коллагеновых фибрилл до тех пор, пока не произойдет перекрестное связывание их рядом ковалентных связей. Внеклеточный медь-содержащий фермент, лизилоксидаза, осуществляет окислительное дезаминирование ε-аминогрупп некоторых лизиловых и гидроксилизиловых остатков коллагена с образованием реактивных альдегидов. Альдегиды могут формировать Шиффовы основания с ε-аминогруппами других лизинов, гидроксилизинов или даже гликозилированных гидроксилизинов. Эти Шиффовы основания подвергаются химической перегруппировке, обеспечивая стабильные ковалентные сшивки. Альдегидный компонент, образующийся из гидроксилизина, формирует более стабильную перекрестную связь, чем альдегид из лизилового остатка. Альдольные мостики также обеспечивают перекрестное связывание (сшивку) молекул.
Данные о внутриклеточном и внеклеточном процессинге молекулы-предшественника коллагена суммированы в табл. 56.5.
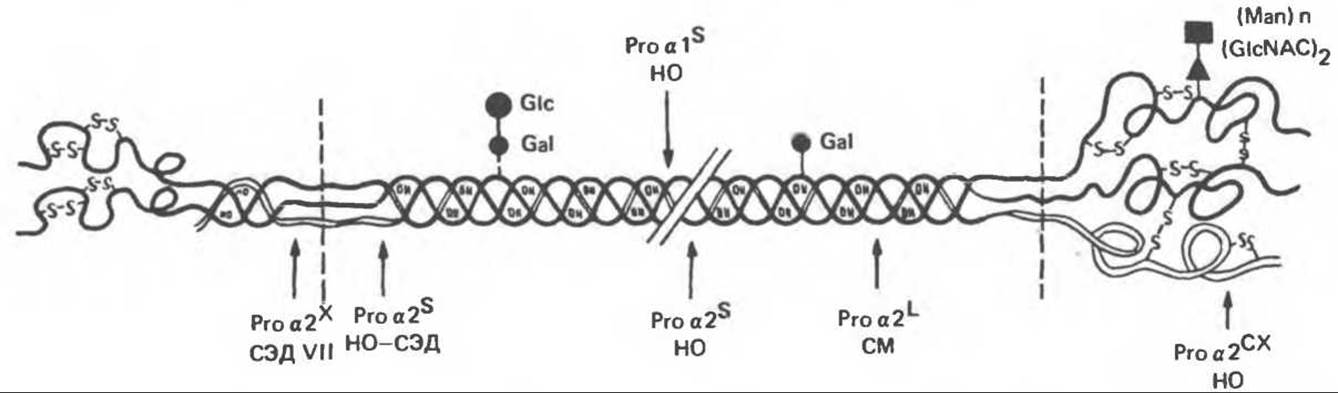
Рис. 56.17. Сайты мутаций в молекуле проколлагена типа I. СЭД — синдром Элерса — Данлоса; СМ — синдром Марфана. НО — несовершенный остеогенез. (Reproduced, with permission, from Prockop D. J., Kivirikko K., I. Heritable diseases of collagen. N. Engl. J. Med. 1984, 311, 376.)
Таблица 56.5. Порядок и локализация этапов процессинга предшественника коллагена (содержащего повторяющуюся структуру [Gly-X-Y]n
|
Внутриклеточные (эндоплазматический ретикулум) |
|
1) Отщепление сигнального пептида |
|
2) 4-Гидроксилирование Y-пролиловых остатков |
|
3) 3-Гидроксилирование Х-пролила, где Y — остаток 4-гидроксипролина |
|
4) 5-Гидроксилирование Y-лизиловых остатков |
|
5) Гликозилирование гидроксилизиловых остатков |
|
6) Образование внутрицепочечных и межцепочечных S—S-связей |
|
7) Образование тройной спирали проколлагена |
|
Внеклеточные |
|
1) Отщепление NH2-концевого пропептида (мол. масса 20000) |
|
2) Отщепление СООН-концевого пропептида (мол. масса 30000-35000) |
|
3) Образование фибрилл незрелого коллагена |
|
4) Окисление лизиловых, гидроксилизиловых и гликозилированных гидроксилизиловых остатков в альдегиды |
|
5) Перекрестное связывание цепей и спиральных молекул фибрилл через Шиффовы основания и альдольную конденсацию |
Клетки, секретирующие коллаген, секретируют также фибронектин, большой гликопротеин, присутствующий на клеточной поверхности, во внеклеточном матриксе и в крови. Фибронектин связывается с агрегирующимися проколлагеновыми фибриллами и меняет кинетику образования фибрилл в перицеллюлярном матриксе. С фибронектином и проколлагеном в этом матриксе ассоциированы протеогликаны гепарансульфат и хондроитинсульфат (см. гл. 54).
Хрящ — это внеклеточный матрикс, в котором коллаген обусловливает силу напряжения, а протеогликаны — выраженную эластичность.
Таблица 56.6. Молекулярные дефекты, лежащие в основе четырех наследственных коллагенозов. (Reproduced, with permission, from Prockop D.J., Kivirikko K.I. Heritable diseases of collagen. N. Engl. J. Med., 1984, 311, 376.)
|
Болезнь |
Дефект 1) |
Последствия |
|
Несовершенный остеогенез |
Proa1 (I)0 |
Снижение вдвое количества коллагена типа I |
|
Тип I |
Proa2 (I)s Другие (неидентифицированные) |
Вероятно, аномальные фибриллы |
|
Тип II |
Proa 1 (I)s |
Нестабильная тройная спираль; повышение синтеза proal (III) |
|
Proa2(I)s и proa2(I)0 Другие (неидентифицированные) |
Неясны |
|
|
Тип III |
Proa2 (I)cx |
Синтез тримеров proa1(I) |
|
Proa I (I)сх или proa2(I)cx |
Увеличение количества маннозы в С-пропептиде и снижение растворимости проколлагена типа I |
|
|
Другие (неидентифицированные) |
||
|
Вариант с симптомами Элерса-Данлоса |
Proa2 (I)s |
Нечувствительность к проколлагсн-N-протеиназе и стабильность pN-коллагена2) |
|
Синдром Марфана |
Proa2 (I)L Другие (неидентифицированные) |
Вероятно, нарушение образования поперечных сшивок |
|
Синдром Элeрса Данлоса |
Proa1 (III)+ |
Резкое уменьшение количества коллагена типа III |
|
Тип IV |
Proa1 (III)SM |
Нестабильная тройная спираль |
|
Proa1 (III)x |
Снижение скорости секреции коллагена типа III |
|
|
Другие (неидентифицированные) |
||
|
Тип VI |
Дефицит лизингидроксилазы Другие (неидентифицированные) |
Коллаген с дефицитом гидроксилизина и нарушенное образование поперечных связей |
|
Тип VII |
Дефицит проколлаген-N-протеиназы |
Стабильность pN-коллагена 2) |
|
Ргоа2 (I)x |
Нечувствительность к проколлаген-N-протеиназс и стабильность pN-коллагена 2) |
|
|
Тип IX |
Нарушение метаболизма меди |
Дефицит лизиноксидазы и нарушенное образование поперечных связей |
|
Синдром Менке |
Нарушение метаболизма меди |
Дефицит лизиноксидазы и нарушенное образование поперечных связей |
1) Proa 1(I)0. proa2(I)0 и proa1 (ІІI)+- нефункционирующие или неэффективно функционирующие аллели proa-цепей: proa 1 (I)s и proa2(І)s-yкороченные proa-цепи; proa2(I)L-удлиненные proa-цепи; proal(I)cx и proa2(I)cx-мутации, изменяющие структуру С-полипептидов proa-цепей; proa1 (III)SM-измененная proal (III)-цепь, медленно мигрирующая при электрофорезе в геле; proa1(III)x и proa2(I)x нерасшифрованные еще мутации, изменяющие структуру proa-цепей.
2) Интермедиат в реакциях превращения проколлагена, содержащий N-пропептиды, но не С-пропептиды.
Наследственные дефекты коллагена и его сборки
Наследственные болезни, обусловленные аномалиями коллагена, носят название коллагенозов. Наиболее известные среди них: несовершенный остеогенез, синдром Марфана, синдром Элерса—Данлоса и синдром Менке (синдром курчавых волос). Первоначально эти болезни диагностировали только на основании фенотипа пробандов, но по мере накопления знаний о структуре и функции коллагена становились понятными молекулярные механизмы, лежащие в основе этих синдромов.
Многие клинические симптомы объясняются нарушением процессинга предшественников коллагена из-за аномалий самого предшественника или дефектов в ферментной системе процессинга. Понимание молекулярной природы нарушения позволяет предсказать характер наследования патологии (рецессивный или доминантный).
В табл. 56.6 суммированы молекулярные дефекты и их последствия при некоторых наследственных коллагенозах человека, а на рис. 56.17 указаны дефектные сайты в молекуле проколлагена типа I.
Литература
Adelstein R. S., Eisenberg R. Regulation and kinetics of actin — myosin ATP interaction, Annu. Rev. Biochem., 1980, 49, 921.
Adelstein R. S. et al. Phosphorylation of muscle contractile proteins, Fed. Proc., 1980, 39, 1544.
Barany Т. М. Barany К. Phosphorylation of the myofibrillar proteins, Annu. Rev. Physiol., 1980 42, 275.
Bornstein P., Sage H. Structurally distinct collagen types, Annu. Rev. Biochem., 1980, 49, 957.
Caplan A. Cartilage, Sсi. Am. (Oct.), 1984. 250, 84.
Clark M., Spudich J. A. Nonmuscle contractile proteins: The role of actin and myosin in cell motility and shape determination, Annu. Rev. Biochem., 1977, 46, 797.
DeCrombrugghe B., Pastan I. Structure and regulation of a collagen gene. Trends Biochem. Sсi., 1982, 7, 11.
Dustin P. Microtubules, Sсi. Am. (Aug.), 1980, 243, 67.
Eyre D. R. et al. Cross-linking in collagen and elastin, Annu. Rev. Biochem., 1984, 53, 717.
Fuchs E., Hanukoglu I. Unraveling the structure of intermediate filaments. Cell, 1983, 34, 332.
Heuser J. E., Kirschner M. W. Filament organization revealed in platinum replicas of freeze-dried cytoskelctons. J. Cell Biol., 1980, 86, 212.
Kleinman H. K., Klebe R.J., Martin G.R. Role of collagenous matrices in the adhesion and growth of cells, J. Cell Biol., 1981, 88, 473.
Lazarides E. Intermediate filaments: A chemically heterogeneous, developmentally regulated class of proteins. Annu. Rev. Biochem., 1982. 51, 219.
Lazarides E., Revel J. P. The molecular basis of cell movement, Sсi. Am. (May), 1979, 240. 100.
Murray J. M., Weber A. The cooperative action of muscle proteins, Sс. Am. (Feb.), 1974, 230, 59.
Prockop D. J., Kivirikko К. I. Heritable diseases of collagen, N. Engl. J. Med., 1984. 311. 376.
Sandberg L. B., Soskel N. T., Leslie J. G. Elastin structure, biosynthesis, and relation to disease states, N. Engl, J. Med., 1981, 304, 566.