Биохимия человека Том 2 - Марри Р. 1993
Структура, функция и репликация информационных макромолекул
Синтез и процессинг РНК
Синтез РНК
Процесс синтеза РНК по ДНК-матрице наиболее полно охарактеризован для прокариот. Хотя в клетках млекопитающих регуляция синтеза и процессинг РНК отличаются от прокариотических систем, сами процессы синтеза РНК у обоих типов организмов практически одинаковы. Вот почему описание синтеза РНК у прокариот вполне приложимо и к эукариотическим клеткам, несмотря на то что ферменты и регуляторные сигналы синтеза РНК различаются.
Последовательность рибонуклеотидов в молекуле РНК комплементарна последовательности дезоксирибонуклеотидов одной из цепей ДНК (рис. 37.8). Та из двух цепей ДНК, по которой непосредственно идет транскрипция РНК-молекул, называется кодирующей цепью. Другую цепь часто называют некодирующей цепью соответствующего гена. Важно понимать, что в двухцепочечной ДНК, содержащей много генов, кодирующая цепь каждого данного гена вовсе не обязательно представлена в рамках одной и той же цепи ДНК (рис. 39.1). Другими словами, одна цепь молекулы ДНК для одних генов является кодирующей, а для других соответственно — некодирующей. Обратите внимание, что, за исключением замещения Т на U, последовательность РНК-транскрипта идентична некодирующей цепи.
ДНК-зависимая РНК-полимераза — это фермент, полимеризующий рибонуклеотиды в последовательность, комплементарную кодирующей цепи гена (рис. 39.2). Фермент связывается с определенным участком кодирующей цепи, называемым промотором. Затем в стартовой точке инициируется синтез терминирующая последовательность. Область транскрибируемой ДНК между промотором и терминатором называется единицей транскрипции. Образующаяся при этом молекула РНК, синтезируемая в направлении 5'→3', называется первичным транскриптом. В прокариотических организмах первичный транскрипт часто содержит РНК-копии сразу нескольких генов, а у эукариот, как правило, — лишь единичного гена. 5'-Концы первичного прокариотического транскрипта и зрелой цитоплазматической РНК идентичны. Это означает, что стартовая точка транскрипции соответствует 5'-нуклеотиду мРНК. У эукариот первичные транскрипты, синтезированные РНК-полимеразой II, тут же модифицируются посредством присоединения «кэпа» — 7-метилгуанозинтрифосфата (рис. 37.10) (он постоянно присутствует на 5'-конце зрелых цитоплазматических мРНК). По-видимому, кэпирование необходимо как для процесса созревания первичного транскрипта, так и для последующей трансляции зрелой мРНК.
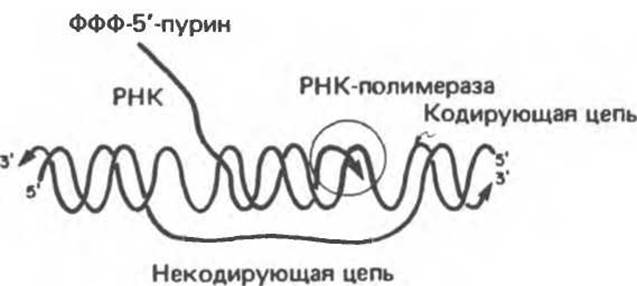
Рис. 39.2. Полимеризация рибонуклеотидов в последовательность РНК, комплементарную кодирующей цепи гена. Реакция катализируется РНК-полимеразой. (From: J. D. Watson, Molecular Biology of the Gene, 3rd. ed., Copyright 1976, 1970, 1965, by W. A. Benjamin Inc. Menlo Park, Calif.)
Молекула ДНК-зависимой РНК-полимеразы Е. coli состоит из четырех субъединиц — двух идентичных (а-субъединицы) и еще двух — близких по размеру, но не идентичных (ß-и ß'-субъединицы). Для осуществления полимеразной функции должен образоваться холофермент — комплекс так называемого кор-фермента, т. е. собственно РНК-полимеразы, с дополнительным белковым фактором (σ-фактор), способствующим более прочному связыванию полимеразы со специфической промоторной последовательностью ДНК. Бактерии продуцируют множество различных a-факторов, каждый из которых функционирует в роли регулятора, модулирующего промоторную специфичность РНК-полимеразы. Появление различных a-факторов коррелирует во времени с запуском различных «комплексных программ» экспрессии определенного набора генов в прокариотических системах, таких, как развитие бактериофагов, споруляция или ответ на тепловой шок.
Процесс синтеза РНК, изображенный на рис. 39.3, включает связывание РНК-полимеразного комплекса с ДНК-матрицей в промоторной области. Вслед за этапом инициации синтеза РНК высвобождается σ-фактор и происходит элонгация синтеза РНК в направлении 5'→3' антипараллельно матричной цепи ДНК. Фермент полимеризует рибонуклеотиды в определенной последовательности, отражающей структуру кодирующей цепи в соответствии с принципом комплементарности. В ходе реакции высвобождается пирофосфат. И в прокариотических, и в эукариотических организмах полимеризация РНК начинается обычно с пуринового рибонуклеотида.
По мере продвижения комплекса элонгации, содержащего РНК-полимеразу (кор-фермент) по кодирующей цепи, должно происходить расплетание ДНК. Оно необходимо для правильного образования комплементарных пар со встраиваемыми в цепь РНК рибонуклеотидами. Размер расплетенного участка ДНК постоянен в течение всего процесса транскрипции и составляет около 17 пар на молекулу полимеразы (судя по всему, он не зависит от транскрибируемой последовательности ДНК). Это позволяет предположить, что РНК-полимераза ассоциирована с дополнительным фактором, проявляющим расплетающую активность, благодаря которой и раскрывается спираль ДНК. Тот факт, что для протекания транскрипции двойная спираль ДНК должна развернуться, а цепи разойтись (по крайней мере временно), означает неизбежность некоторого нарушения структуры нуклеосом.
Сигнал терминации синтеза молекулы РНК представляет собой определенную последовательность, расположенную в рамках кодирующей цепи ДНК. Этот сигнал распознается терминирующим белком — р-фактором. После терминации синтеза данной цепи РНК кор-фермент отделяется от ДНК-матрицы и, связавшись с новой молекулой σ-фактора, может узнавать соответствующие промоторные участки и приступать к синтезу новой молекулы РНК. Одну и ту же кодирующую цепь могут одновременно считывать несколько молекул РНК-полимеразы, но процесс отрегулирован таким образом, что в каждый данный момент каждая молекула транскрибирует различные участки ДНК. Электронная микрофотография синтеза РНК представлена на рис. 39.4.
В клетках млекопитающих обнаружено несколько типов ДНК-зависимых РНК-полимераз. Их свойства представлены в табл. 39.1. По-видимому, каждый из этих ферментов отвечает за транскрипцию различных наборов генов. Молекулярные массы трех важнейших классов РНК-полимераз млекопитающих варьируют в пределах 500000—600000. Их структура имеет много общего со структурой бактериальной ДНК-зависимой РНК-полимеразы. Все они имеют по две больших субъединицы и по несколько малых субъединиц. Недавние работы по клонированию и секвенированию продемонстрировали сходство аминокислотных последовательностей эукариотических и прокариотических РНК-полимераз. Функции индивидуальных субъединиц пока не выяснены. Некоторые из них могут нести регуляторные функции, осуществляя узнавание специфических последовательностей промотора и терминатора.
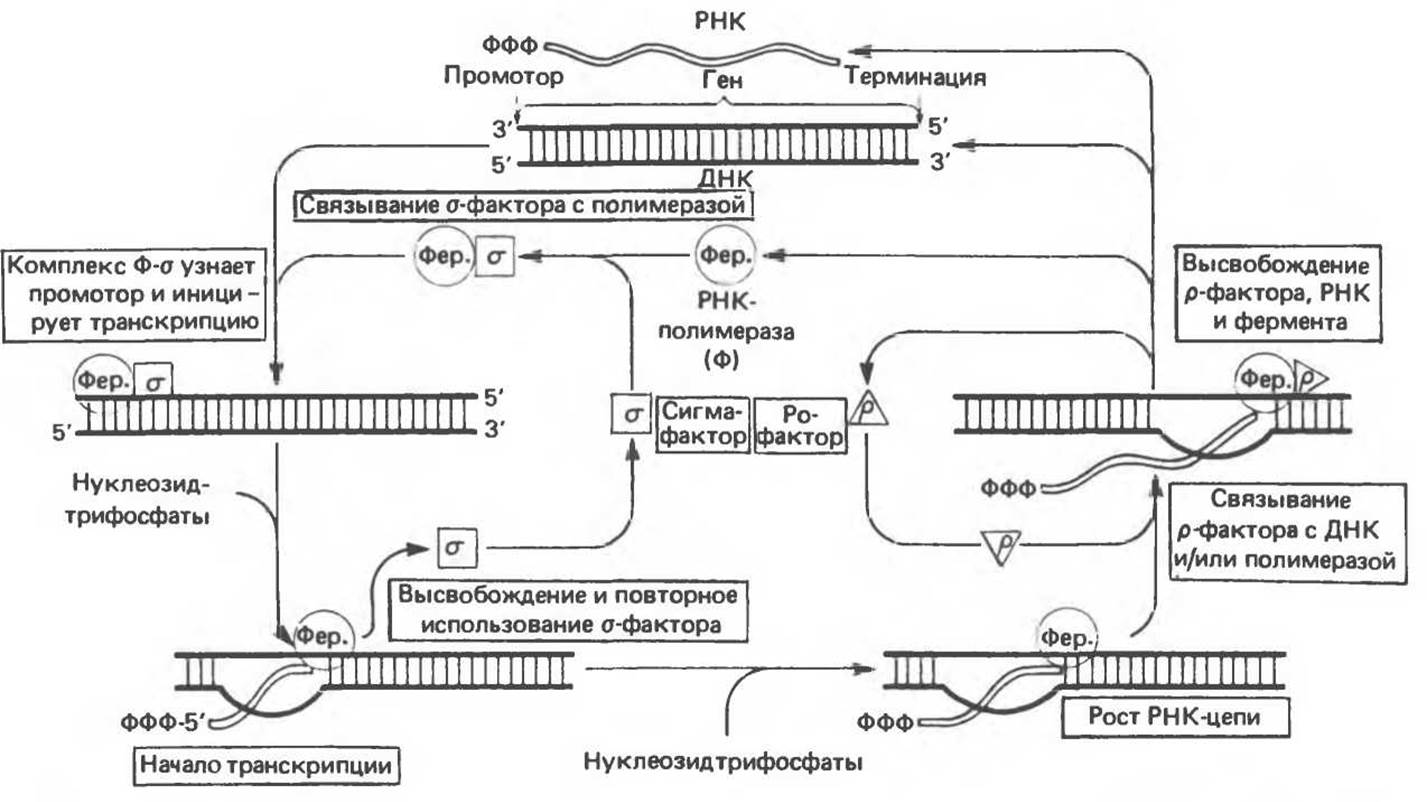
Рис. 39.3. Процесс синтеза РНК. Начало процесса показано слева вверху, где сигма-фактор, соединяясь с кор-ферментом РНК-полимеразы, образует комплекс, способный узнавать промотор и начать транскрипцию. Процесс заканчивается высвобождением РНК-полимеразы. Свободная полимераза и другие высвобожденные каталитические факторы могут принять участие в новом акте транскрипции. Символом Фер. обозначен фермент. (From J. D. Watson, Molecular Biology of the Gene, 3rd. ed., Copyright 1976, 1970, 1965 by W. A. Benjamin Inc. Mario Park, Calif.)
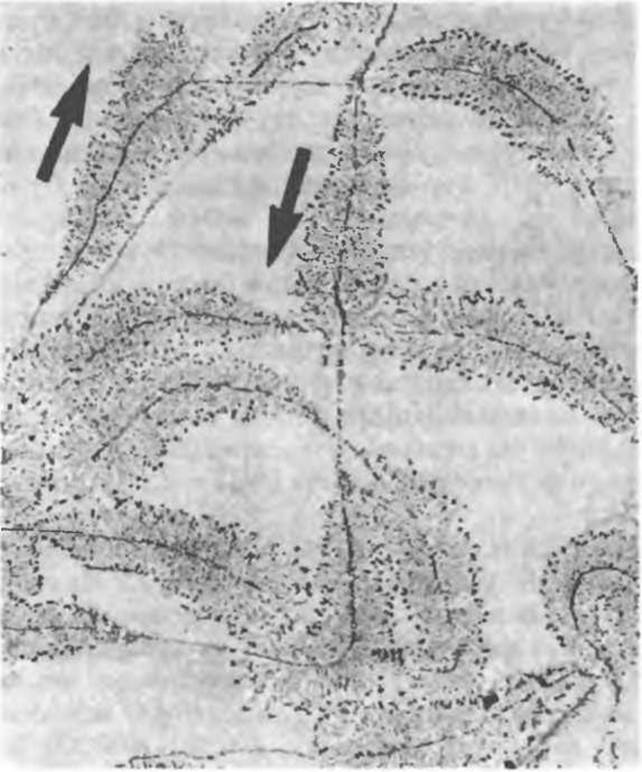
Рис. 39.4. Электронная микрофотография множественных копий транскрибируемых генов рибосомной РНК клеток амфибий. Увеличение х6000. На фотографии видно, что при продвижении РНК-полимеразы вдоль гена длина транскрипта увеличивается. С ближним концом гена связан короткий транскрипт, а с дальним концом — гораздо более протяженный. Стрелками указано направление (5'→3') транскрипции. (Reproduced with permission from Miller O. L. Jr, Beatty B. R., Portrait of a Gene. J. Cell Physiol. 1969. 74 [Suppl. 1]:225.)
Таблица 39.1. Номенклатура и локализация ДНК- зависимых РНК-полимераз животных
|
Класс фермента |
Чувствительность к а-аманитину |
Продукты |
Локализация |
|
I (А) |
Нечувствительный |
рРНК |
Ядрышко |
|
II (В) |
Чувствителен к низким концентрациям (10-8—10-9 моль/л) |
гяРНК (мРНК) |
Нуклеоплазма |
|
III(С) |
Чувствителен к высоким концентрациям |
тРНК и 5S-PHK |
Нуклеоплазма |
Один из токсинов — а-аманитин, продуцируемый грибом Amantia phaloides, является специфическим ингибитором нуклеоплазматической ДНК-зависимой РНК-полимеразы (РНК-полимеразы II), благодаря чему его удалось эффективно использовать во многих молекулярно-биологических исследованиях (см. табл. 39.1).
Сигналы транскрипции
Анализ нуклеотидной последовательности клонированных генов позволил выявить ряд областей ДНК, играющих существенную роль в процессах транскрипции. На основе изучения большого числа бактериальных генов стало возможным построение консенсусных моделей последовательностей, выполняющих функции промоторов и терминаторов транскрипции. Бактериальные промоторы состоят примерно из 40 нуклеотидных пар (4 витка двойной спирали ДНК), т.е. они достаточно малы, чтобы полностью закрываться РНК-холополимеразным комплексом Е. coli. В рамках консенсусной структуры промотора выявлены два коротких консервативных элемента. На расстоянии около 35 нуклеотидных пар в сторону 5'-конца от точки начала транскрипции находится восьмичленная последовательность, изображенная на рис. 39.5. На более близком расстоянии к точке инициации транскрипции (около
10 нуклеотидов) расположен 6-членный АТ-богатый участок. Он имеет относительно низкую температуру плавления из-за отсутствия GC-пap. В связи с этим считается, что на данном участке, называемом ТАТА-последовательностью (а также Прибиовбоксом), легко происходит диссоциация цепей ДНК так, что РНК-полимераза, связанная с областью промотора, получает доступ к участку последовательности кодирующей цепи, непосредственно прилегающему к промотору со стороны 3'.
Как показано на рис. 39.6, p-зависимые сигналы терминации транскрипции в клетках Е. coli также характеризуются определенной консенсусной структурой. Консервативная последовательность терминатора, состоящая примерно из 40 нуклеотидов, содержит разнесенные на некоторое расстояние инвертированные повторы и заканчивается серией АТ-пар. РНК-транскрипт, образовавшийся после прохождения транскрипционного комплекса через область инвертированных повторов, может формировать внутримолекулярную шпилечную структуру, изображенную на рис. 39.6. Транскрипция продолжается далее в вышеупомянутую АТ-область, после чего под воздействием специфического белка- терминатора, так называемого р-фактора, РНК-полимеразный комплекс останавливается и диссоциирует, высвобождая первичный РНК-транскрипт.
Транскрипционные сигналы генов млекопитающих, как и следовало ожидать, организованы более сложно. Данные, полученные с помощью генной инженерии, свидетельствуют о наличии нескольких типов сигналов, контролирующих транскрипцию. Вблизи собственно промоторной области расположены сигнальные последовательности двух типов. Одна из них указывает, где должна начаться транскрипция, а другая определяет, как часто должно происходить это событие. В гене тимидинкиназы вируса герпеса, использующего транскрипционную систему хозяина для экспрессии собственных генов, существует один уникальный сайт инициации транскрипции. Точная транскрипция с этого сайта определяется прилежащей 5'-последовательностью, расположенной на участке 32—16 нуклеотидов от точки инициации. Этот участок содержит последовательность TATAAAAG, которая отчетливо гомологична функционально родственному Прибнов-боксу (ТАТААТ), расположенному обычно на расстоянии около 10 пар оснований от точки начала синтеза прокариотических мРНК. РНК-полимераза II, вероятно, связывается с ДНК в области ТАТА-бокса и начинает синтез РНК примерно через 32 нуклеотида — у остатка тимидина, находящегося в окружении пуриновых нуклеотидов (рис. 39.7). Таким образом, ТАТА-бокс, вероятно, является именно тем сигналом, который указывает, где должна начаться транскрипция.
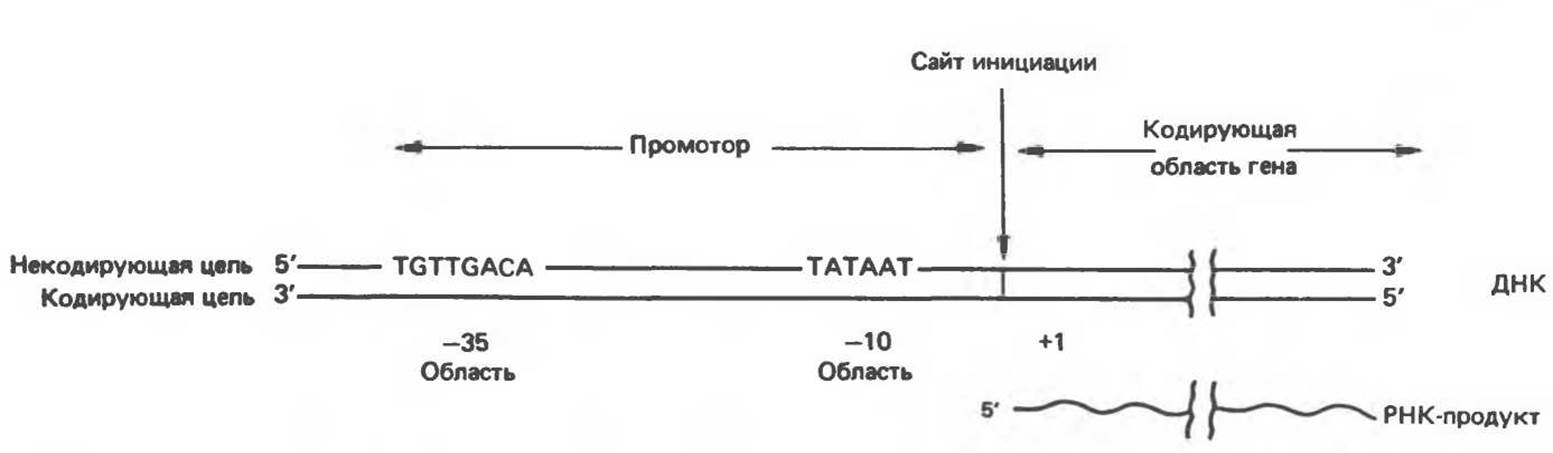
Рис. 39.5. Бактериальные промоторы содержат две высококонсервативные последовательности, отстоящие на 35 и 10 нуклеотидов со стороны 5'-конца от точки инициации транскрипции, обозначенной +1.
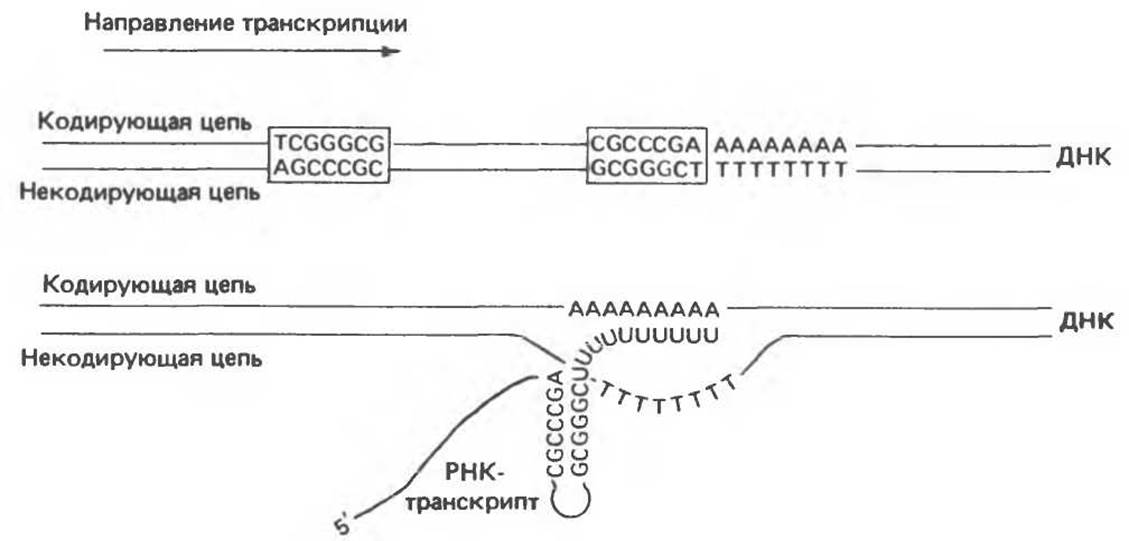
Рис. 39.6. Бактериальный сигнал терминации транскрипции, состоящий из удаленных друг от друга на некоторое расстояние инвертированных повторов и АТ-участка (сверху). После транскрипции эта область формирует в РНК-транскрипте вторичную структуру, показанную в нижней части рисунка.
Два более удаленных от сайта инициации транскрипции участка последовательности образуют один функциональный элемент, определяющий, как часто должна происходить транскрипция данного гена. Мутация в любой из этих областей, расположенных на участке от —61 до —47 и от — 105 до —80 пар оснований от точки инициации транскрипции гена тимидинкиназы, снижает частоту актов инициации в 10—20 раз. Функционирование таких промоторных элементов, контролирующих точность и частоту инициации, в сильной степени зависит от их расположения и ориентации. Замена даже единичного нуклеотида в этой области может весьма существенно сказаться на их функции. Критичным является также и расстояние до точки инициации транскрипции; при изменении 5'→3'-ориентации на обратную эти элементы, как правило, утрачивают регуляторную активность (рис. 39.8).
Третий класс последовательностей увеличивает или уменьшает обычный (базовый) уровень транскрипции эукариотических генов. Эти элементы в зависимости от оказываемого ими эффекта называют «энхансерами» или «сайленсерами» соответственно. Они могут быть расположены как до (со стороны 5'), так и после (со стороны 3') сайта инициации транскрипции. В отличие от промоторных последовательностей энхансеры и сайленсеры могут оказывать цис-эффект на расстоянии сотен и тысяч оснований от соответствующей транскрипционной единицы. Их функционирование не зависит от ориентации.
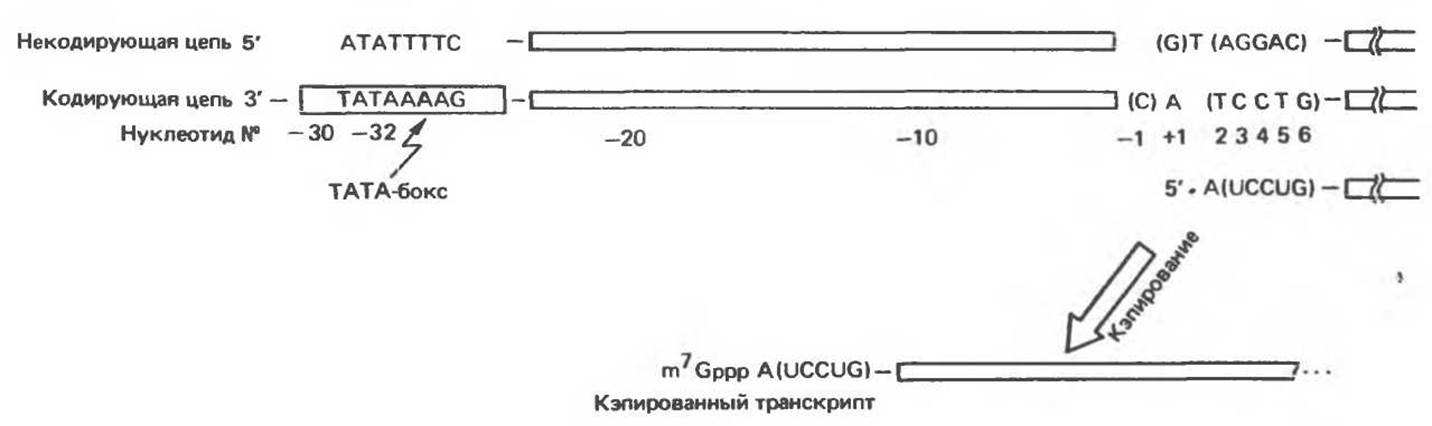
Рис. 39.7. Транскрипция гена тимидинкиназы. ДНК-зависимая РНК-полимераза II связывается с областью, комплементарной ТАТА-боксу, и начинает транскрипцию кодирующей цепи с остатка Т, окруженного пуринами и отстоящего от ТАТА-бокса примерно на 32 нуклеотида. Первый 5'-остаток пурина в первичном транскрипте быстро модифицируется
присоединением «кэпа».
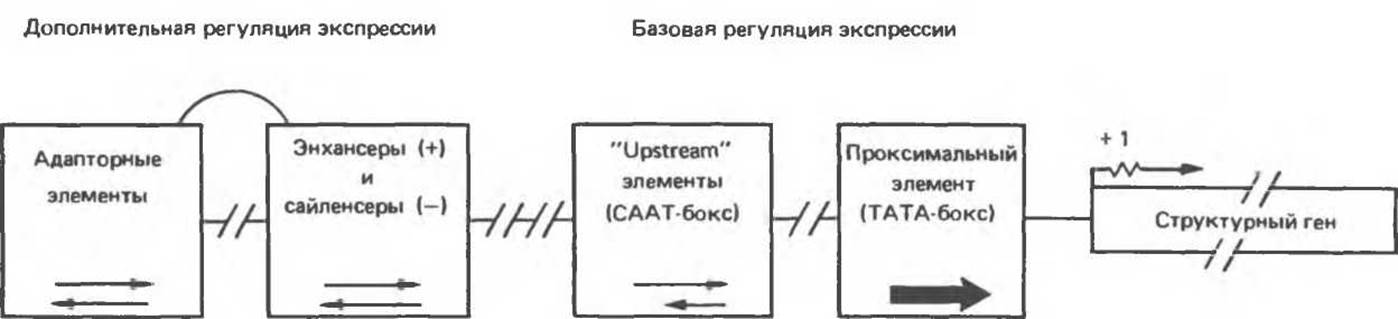
Рис. 39.8. Схема организации регуляторных блоков типичного эукариотического гена. В функциональном гене можно выделить регуляторную и структурную области, разделенные сайтом инициации транскрипции (показан стрелкой). Регуляторная область состоит из двух элементов, определяющих базовый уровень экспрессии. Проксимальный элемент, ТАТА-бокс, направляет РНК-полимеразу к сайту инициации транскрипции и, следовательно, определяет точность начала синтеза РНК. Другой регуляторный элемент (upstream) контролирует частоту, с которой происходит инициация транскрипции. Наиболее изученным регуляторным элементом этого класса является так называемый СААТ-бокс, однако в других генах могут использоваться и иные элементы. В регуляции экспрессии участвуют также энхансеры и сайленсеры — элементы, усиливающие или ослабляющие базовый уровень транскрипции, и элементы, регулирующие экспрессию определенных генов в ответ на различные сигналы (включая гормоны, тепловой шок, ионы металлов, некоторые химические препараты). Сюда же относятся и функционально подобные элементы, обусловливающие тканевую специфичность экспрессии генов. Возможно, что два последних блока регуляторных элементов функционально перекрываются (показано соединяющей линией). Зависимость функции элемента данного типа от ориентации указана стрелками. Так, проксимальный элемент обязательно должен быть в ориентации 5'→3'. СААТ-бокс и аналогичные ему элементы наиболее эффективно работают в ориентации 5'→3', но некоторые функционируют в обеих ориентациях. Разорванные линии между квадратами указывают на то, что положения данных элементов относительно сайта инициации транскрипции строго не фиксированы. В действительности элементы регуляции экспрессии могут быть расположены также и правее (т. е. ближе к 3'-концу) сайта инициации транскрипции.
И наконец, известен еще один класс регуляторных элементов, обеспечивающих адаптивную регуляцию экспрессии некоторых генов. Представителями этого класса являются регуляторные элементы, чувствительные к гормонам (стероидам, Т3, ТРГ, сАМР, пролактину и т. д.; см. гл. 44). Сюда же включены элементы, специфически регулирующие клеточный ответ на тепловой шок, действие металлов (Cd2+ и Zn2+) и некоторых химических токсинов (диоксин). К этому классу относятся и определенные участки последовательности ДНК, ответственные за регуляцию тканеспецифичной экспрессии генов, например гена альбумина в печени. Некоторые из таких адаптационных структур функционируют подобно сайленсерам или энхансерам (так регуляторный элемент, чувствительный к глюкокортикоидным гормонам, действует как энхансер).
Общее свойство всех регуляторных элементов, как основных, так и дополнительных, состоит в том, что их функционирование зависит от взаимодействия определенных участков ДНК со специфическими белковыми факторами. Множество таких белковых факторов было идентифицировано (табл. 39.2). Изучению механизма влияния таких ДНК-белковых взаимодействий на транскрипцию генов посвящено значительное число исследований.
Таблица 39.2. Некоторые регуляторные элементы, контролирующие транскрипцию, и связывающиеся с ними факторы, найденные для генов, транскрибируемых РНК-полимеразой II

Сигналы терминации транскрипции, направляемой эукариотической РНК-полимеразой II, изучены очень плохо. Однако есть основания считать, что сигналы терминации расположены на значительном расстоянии от 3'-конца кодирующей области эукариотических генов. Например, сигналы терминации транскрипции гена ß-глобина мыши обнаружены в нескольких местах на расстоянии 1000—2000 оснований далее сайта, по которому обычно происходит полиаденилирование транскрипта. Мало что известно о самом процессе терминации. Неизвестно, участвуют ли в терминации какие-либо специфические белковые факторы, подобные р-фактору бактерий. 3'-Конец зрелой мРНК генерируется уже после завершения транскрипции, по-видимому, в два этапа. После того как РНК-полимераза II пройдет область, кодирующую 3'-конец транскрипта, первичный транскрипт расщепляется РНК-эндонуклеазой в области, отстоящей от консенсусной 3'-последовательности AAUAAA на 15 оснований. По-видимому, в эукариотических транскриптах последовательность AAUAAA выполняет функцию сигнала разрезания РНК. Затем вновь образованный 3'-конец полиаденилируется в нуклеоплазме, как описано ниже.
ДНК-зависимая РНК-полимераза III, транскрибирующая гены тРНК и малых ядерных РНК (мяРНК, см. гл. 37), узнает внутригенный промотор, расположенный непосредственно в рамках транскрибируемой последовательности. В случае эукариотических генов тРНК функцию внутригенного промотора выполняют два отдельных внутренних блока последовательностей. Они транскрибируются, сохраняются в зрелой тРНК в высококонсервативной области и участвуют в образовании DHU- и ТΨС- петель соответственно (рис. 37.11). При изучении структуры генов тРНК in vitro было показано, что для выполнения промоторных функций расстояние между двумя блоками должно составлять 30—40 пар оснований. Транскрипция инициируется на участке между 10- и 16-м нуклеотидом перед блоком А. Что касается гена 5S-PHK, также транскрибируемого РНК-полимеразой III, то для него выявлено взаимодействие со специфическим белковым фактором транскрипции. Судя по всему, связываясь с внутригенным промотором, этот фактор взаимодействует с РНК-полимеразой III, контролируя точность расположения каталитического центра фермента в точке инициации транскрипции.