Биохимия человека Том 2 - Марри Р. 1993
Структура, функция и репликация информационных макромолекул
Синтез и процессинг РНК
Процессинг молекул РНК
У прокариотических организмов первичные транскрипты мРНК-кодирующих генов начинают использоваться в качестве матриц белкового синтеза еще до полного завершения транскрипции. Транскрипция и трансляция у прокариот — это сопряженный процесс. Транскрипты прокариотических рРНК и тРНК имеют гораздо большую протяженность, чем соответствующие зрелые молекулы РНК. Так, многие тРНК-транскрипты содержат более одной молекулы тРНК. Таким образом, для прокариотических организмов процессинг первичных рРНК- и тРНК-транскриптов является необходимым этапом образования зрелых молекул.
Практически все первичные транскрипты РНК у эукариот подвергаются сложному процессингу в период между их синтезом и началом реализации ими соответствующей функции — в роли мРНК или в роли самостоятельных структурных факторов, таких, как рРНК, 5SPHK или тРНК. Процессинг происходит в первую очередь в самом ядре. Процессинг включает кэпирование, реакции расщепления и лигирования, присоединение дополнительных концевых нуклеотидов и нуклеозидную модификацию. От 50 до 75% ядерной РНК млекопитающих, включая и 5'-кэпированные цепи, не входит в дальнейшем в состав цитоплазматических мРНК. Эта величина внутриядерной потери РНК значительно выше, чем та, которую можно подсчитать, учитывая только удаление некодирующих областей транскриптов (см. ниже). Точная функция «избыточной» РНК ядра клеток млекопитающих остается пока неизвестной.
Благодаря развитию методов рестрикционного картирования и секвенирования молекул ДНК удалось установить, что во многих генах эукариот между экзонами (т. е. кодирующими фрагментами последовательности) располагаются протяженные участки ДНК, не несущие генетической информации, непосредственно транслируемой в аминокислотную последовательность белков (см. гл. 38). Такие промежуточные последовательности, или нитроны, обнаруживаются в большинстве, но не во всех генах высших эукариот. Первичные транскрипты структурных генов включают и участки, соответствующие нитронам. В ходе процесса, называемого «сплайсинг», эти участки первичного транскрипта точно вырезаются, а соответствующие экзоны — сшиваются. Процесс протекает в ядре, затем сформировавшиеся молекулы мРНК выходят в цитоплазму, где и происходит их трансляция (рис. 39.9).
До сих пор неизвестны точные механизмы безошибочного вырезания интронов и сшивания экзонов, транспорта РНК в цитоплазму. Однако исследования последних лет дали много новой информации об этих процессах. Хотя последовательности нуклеотидов в интронах даже в пределах одного транскрипта очень гетерогенны, удается выявить консенсусную последовательность для каждого из двух участков соединения интронов с экзонами (сайтов сплайсинга) (рис. 39.10). Консенсусная последовательность сайтов сплайсинга на границе интрон — экзон не настолько уникальна, чтобы гарантировать ее строго специфическое расщепление исключительно за счет действия какой-либо специализированной эндонуклеазы. Присутствующая в значительных количествах малая ядерная РНК (РНК U1) содержит последовательность, комплементарную консенсусной последовательности сайта сплайсинга (рис. 39.11). Кроме того, установлено, что молекулы U1-РНК в эукариотическом ядре специфически связываются с определенными белковыми факторами. Такие РНК-белковые комплексы избирательно ассоциируются с 5'- и 3'- последовательностями сайтов сплайсинга в РНК. Антитела против U1-белкового комплекса ингибируют процесс вырезания интронов in vitro.
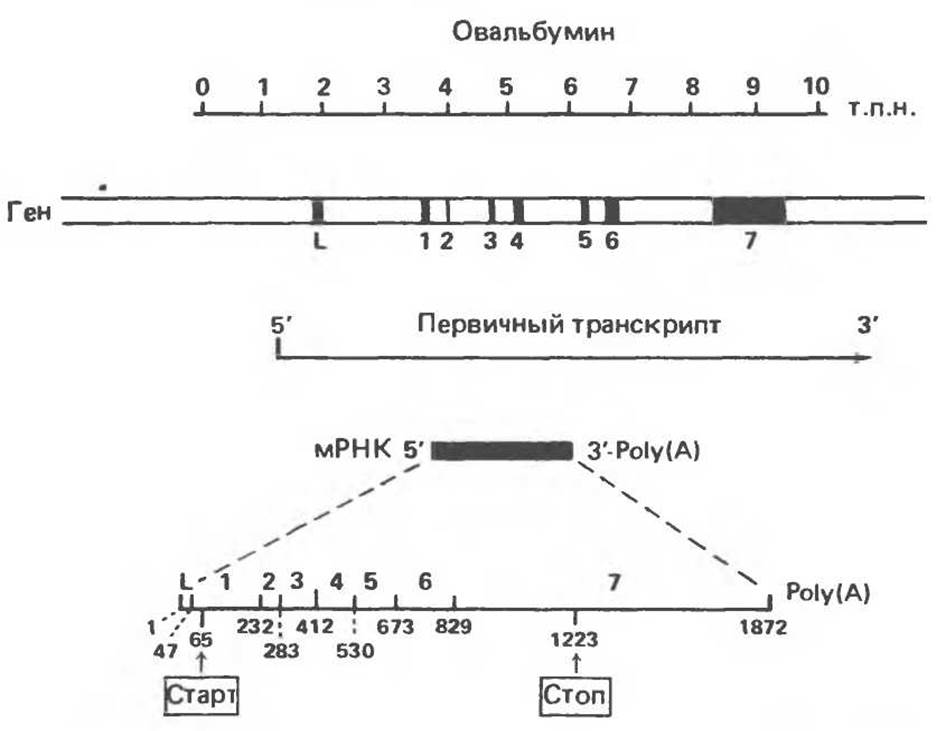
Рис. 39.9. Расположение кодирующих и некодирующих последовательностей (интронов) в структуре гена куриного овальбумина. На рисунке информационные сегменты, входящие в состав зрелой мРНК, пронумерованы и выделены черным цветом. Первичный транскрипт начинается левее L-экзона и заканчивается в 3'-нетранслируемой области за экзоном 7. В нижней части рисунка представлена структура зрелой мРНК; над ней указаны номера экзонов, а под ней — порядковые номера нуклеотидов, точка инициации трансляции и положение стоп-кодона.
Интересно, что у пациентов с аутоиммунным заболеванием — системной красной волчанкой — обнаружены антитела против некоторых специфических U1-белковых комплексов. Как это связано непосредственно с самим заболеванием, пока неясно.
Недавно было установлено, что в процессе удаления интронов из молекул-предшественников мРНК образуется необычная петлеобразная структура. Оказалось, что 5'-конец последовательности интрона соединяется 2'—5'-фосфодиэфирной связью с аденилатом, расположенным на расстоянии 28—37 нуклеотидов от его 3'-конца. Этот процесс и соответствующие структуры схематически представлены на рис. 39.12.
Что касается загадки взаимоотношений гяРНК и соответствующих зрелых мРНК, то ее уже можно считать разгаданной. Гетерогенная ядерная РНК представляет собой первичные транскрипты плюс молекулы, находящиеся на ранних стадиях процессинга, которые после кэпирования, добавления poly А-хвоста и удаления интронов транспортируются в цитоплазму уже в форме зрелых мРНК.
Процессинг гяРНК является еще одной потенциальной точкой регуляции экспрессии генов. Так, была продемонстрирована возможность альтернативного сплайсинга для одного и того же первичного транскрипта. Например, мРНК а-амилазы из слюнных желез и из печени крысы отличаются друг от друга структурой 5'-концевых участков последовательности. Остальные участки мРНК, включая кодирующую область и сайт полиаденилирования, — идентичны. Дальнейший анализ показал, что для присоединения к одному и тому же «телу» мРНК двух различных кэпированных лидирующих последовательностей используются разные сайты сплайсинга. Другой пример альтернативного сплайсинга — образование молекул мРНК, кодирующих две тяжелые цепи иммуноглобулинов. Одна молекула мРНК кодирует мембраносвязанную тяжелую цепь, а другая — секретируемую тяжелую цепь (см. гл. 41). Таким образом, сплайсинг необходим для формирования зрелых молекул мРНК и, кроме того, может использоваться в качестве одного из механизмов дифференциальной экспрессии генов.

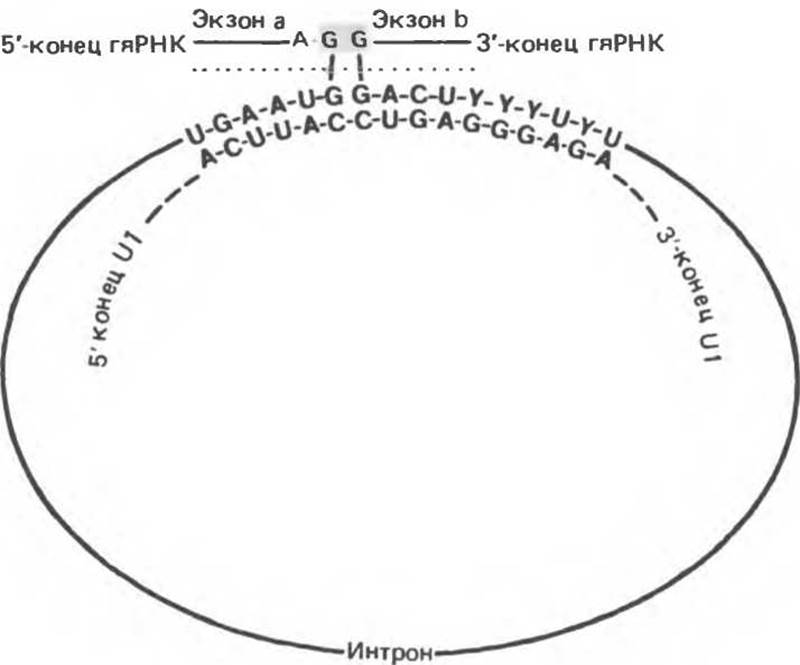
Рис. 39.11. Предполагаемый механизм идентификации сайта сплайсинга при удалении интронов из гяРНК. 5'-Конец мяРНК U1 образует комплементарный комплекс с дистальным концом консенсусной последовательности сайта сплайсинга на 3'-конце экзона а. Другой конец U1-РНК взаимодействует с консенсусным сайтом сплайсинга экзона b. Структура, обозначенная линией точек, вырезается, и молекула сшивается по остаткам G (затемненный прямоугольник).
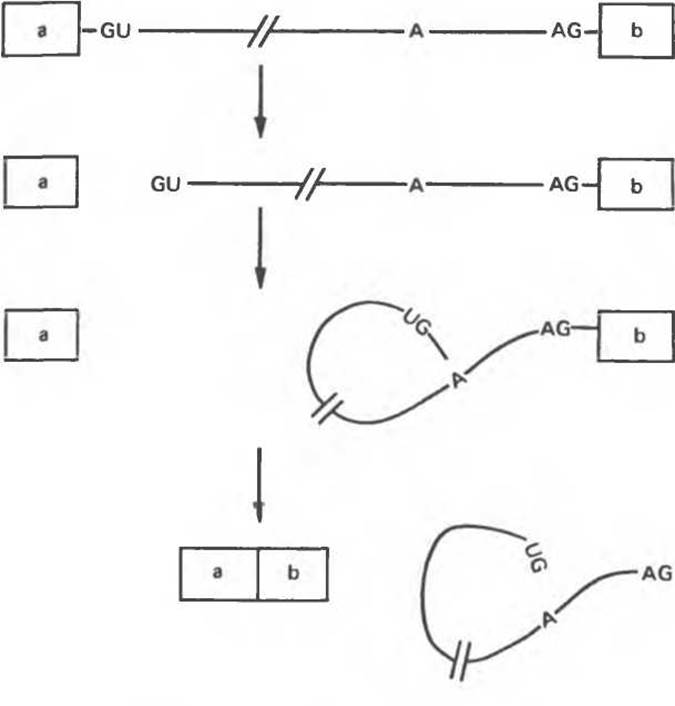
Рис. 39.12. Предполагаемый путь сплайсинга пре-мРНК. Расщепление в 5'-сайте сопровождается образованием петли и последующим ее высвобождением за счет отщепления от экзона b. Интрон изображен линией, экзоны а и b — квадратами. Эти реакции происходят при участии мяРНК и пре-мРНК, объединенных в прочный комплекс, входящий в состав рибонуклеопротеиновой структуры, которая получила название «сплайсосома».
Как оказалось, по крайней мере одна из форм ß-талассемии, болезни, при которой заметно снижен уровень экспрессии одной из цепей гемоглобина, является результатом нуклеотидной замены на границе интрон-экзон, что препятствует удалению нитрона и ведет к снижению или полному подавлению синтеза ß-цепи.
Матричные РНК (мРНК)
Как упоминалось выше, молекулы мРНК млекопитающих содержат «кэпирующую» структуру на 3'-конце и в большинстве случаев полиаденилатный «хвост» на 3'-конце. Кэпирующая структура добавляется к мРНК в ядре до переноса мРНК в цитоплазму. Структура polyA присоединяется к 3'-концу транскрипта либо в ядре, либо в цитоплазме. Вторичное метилирование молекулы мРНК, в том числе 2'-гидроксильных групп и атомов N6 аденилатных остатков, происходит после перехода молекулы РНК в цитоплазму. Этот процесс может протекать и в ядре и играть определенную роль при сплайсинге. 5'-Кэпирующая структура, судя по всему, нужна для образования нуклеопротеинового комплекса, в свою очередь необходимого для осуществления сплайсинга. Кроме того, она может участвовать в транспорте и инициации трансляции мРНК.
Функция полиаденилатного «хвоста» мРНК неизвестна. Во многих случаях присутствие или отсутствие poly А непосредственно не связано с транспортом в цитоплазму, поскольку не все полиаденилированные гетерогенные ядерные РНК выходят в цитоплазму и не все цитоплазматические мРНК — полиаденилированы. В клетках млекопитающих в ходе процессов, протекающих в цитоплазме, полиаденилатные «хвосты» мРНК могут как удлиняться, так и укорачиваться.
Оборот роlуА-содержащих мРНК в культивируемых клетках млекопитающих — процесс первого порядка со значением t1/2, близким к времени удвоения количества клеток в культуре. Кинетика деградации гистоновых мРНК, не содержащих poly A-структур, является процессом нулевого порядка, для которого характерна зависимость распада от возраста со временем жизни около 6 часов. Пока неясно, связаны ли эти различия с наличием или отсутствием концевых роlуА-последовательностей или с какими-то иными структурными особенностями молекул мРНК этого класса.
Размер молекул цитоплазматических мРНК даже после удаления poly А-цепочки остается значительно большим (часто в 2—3 раза), чем требуется для кодирования соответствующего полипептида. Избыточные нетранслируемые области есть как на 5'-, так и на 3'-концах транслируемого участка, причем, как правило, 3'-нетранслируемая область достигает большей длины. Точная функция этих последовательностей неизвестна, есть основания считать, что они участвуют в процессинге, транспорте, деградации и трансляции РНК.
Транспортные РНК (тРНК)
Молекулы тРНК, как описано в гл. 37 и 40, выполняют функцию адапторных молекул при трансляции мРНК в белковые последовательности. Молекулы тРНК содержат много необычных («минорных») нуклеиновых оснований. Некоторые из них представляют собой метилированные производные обычных оснований, другие — содержат нетрадиционные гликозидные связи. Молекулы тРНК как про-, так и эукариот первоначально транскрибируются в виде больших предшественников, которые часто содержат более одной молекулы тРНК, подвергающихся нуклеолитическому процессингу при действии рибонуклеаз особого класса. Кроме того, гены некоторых тРНК содержат единичный интрон длиной 10—40 нуклеотидов, расположенный непосредственно перед участком, соответствующим антикодоновому плечу. Поэтому процессинг первичных транскриптов многих тРНК-молекул должен включать этап удаления интронов и точного сплайсинга в кодон-узнающей области. Этот этап имеет критическое значение для выполнения тРНК функции адапторных молекул при синтезе белка. Нуклеолитический процессинг предшественников тРНК, по-видимому, направляется не собственно нуклеотидной последовательностью, а особой трехмерной структурой, которую могут формировать молекулы тРНК, и потому реализуется только для молекул, способных к сворачиванию в определенные функциональные структуры.
Дальнейшие модификации молекул тРНК включают алкилирование нуклеотидов и присоединение характерного CCA-триплета к 3'-концу молекулы. Этот триплет служит точкой присоединения соответствующей аминокислоты, направляемой данной молекулой тРНК в реакцию синтеза полипептида. Метилирование предшественников тРНК млекопитающих происходит, вероятно, в ядре, а расщепление и присоединение ССА-триплета — в цитоплазме, поскольку скорость оборота для концевой части тРНК оказывается выше, чем для молекулы в целом. Для присоединения аминокислоты к CCA-концу требуются определенные ферменты цитоплазмы клеток млекопитающих.
Рибосомные РНК (рРНК)
В клетках млекопитающих молекулы рибосомных РНК (двух основных и одной минорной) транскрибируются в составе большого общего первичного транскрипта (рис. 39.13). Процессинг этого транскрипта с образованием зрелых рРНК, транспортируемых в цитоплазму, происходит в ядрышке, где собственно и локализованы сами гены рибосомных РНК. В каждой клетке присутствуют сотни копий этих генов. Транскрипционные единицы содержат последовательности 18S-, 5,8S- и 28S-pPHK, расположенные друг за другом в направлении 5'→3'. Первичный транскрипт размером 45S подвергается интенсивному метилированию непосредственно в ядрышке. В этом 45S-предшественнике участок, соответствующий 28S-pPHK, содержит 65 метилированных рибозных остатков и 5 метилированных нуклеиновых оснований. Метилирование идет только на участках, формирующих в дальнейшем зрелые молекулы рРНК. 45S-предшественник подвергается нуклеолитическому процессингу, однако сигналы процессинга заметно отличаются от соответствующих сигналов в гяРНК. Вероятно, и механизм процессинга также отличается от механизма нуклеолитического процессинга при созревании гяРНК.
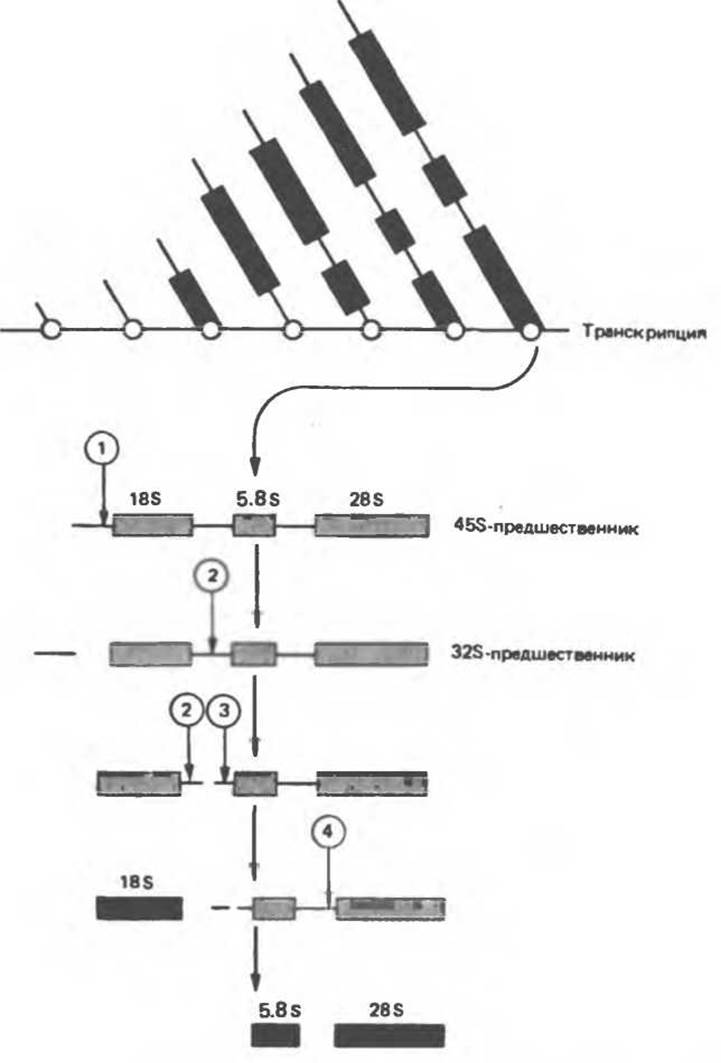
Рис. 39.13. Схема формирования зрелых рибосомных РНК в ходе процессинга молекул РНК-предшественников. Конечный продукт обозначен черными прямоугольниками. (Reproduced, with permission from Perry R. P.: Processing of RNA Annu. Rev. Biochem. 1976, 45:605.)
Почти половина исходного первичного транскрипта (рис. 39.13) подвергается деградации. В ходе процессинга рРНК в ядрышках происходит дальнейшее метилирование, и там же 28S-pPHK, связываясь с рибосомными белками, формирует большую 60S-субъединицу рибосомы. Молекула 5,8S-pPHK также образуется в ядрышке и входит составной частью в большую рибосомную субъединицу. Молекула 18S-pPHK в комплексе с набором соответствующих полипептидов образует малую 40S-субъединицу рибосомы.