Биохимия человека Том 2 - Марри Р. 1993
Структура, функция и репликация информационных макромолекул
Регуляция экспрессии генов
Регуляция экспрессии генов у прокариот
Lac-онерон
В 1961 г. Франсуа Жакоб и Жак Моно описали ставшую теперь классической модель оперона. Их концепция в значительной мере была основана на изучении регуляции метаболизма лактозы у кишечной палочки Е. coli. Молекулярный механизм регуляции генов, участвующих в метаболизме лактозы, на сегодняшний день наиболее изучен. Фермент ß-галактозидаза гидролизует лактозу до галактозы и глюкозы (рис. 41.2). Структурный ген ß-галактозидазы (ген LacZ) локализован в одном кластере с геном, ответственным за синтез галактозид-пермеазы, осуществляющей активный транспорт галактозы в клетку (ген Y) и геном галактозидацетилазы (ген А), функциональное значение которой неизвестно. Структурные гены трех соответствующих ферментов связаны физически и образуют так называемый Lac-оперон (рис. 41.3). Такая генетическая компоновка структурных и соответствующих регуляторных генов обеспечивает скоординированную экспрессию всех трех ферментов метаболизма лактозы. Все три гена транскрибируются в виде обшей молекулы мРНК, содержащей независимые кодоны начала трансляции (AUG) и стоп-кодоны (UAA) для каждого цистрона. Такой тип мРНК называется полишим ровной мРНК. Образование полицистронных мРНК характерно главным образом для прокариотических организмов.
Когда в растущую культуру клеток Е. coli добавляют лактозу или некоторые ее аналоги, экспрессия активностей ß-галактозидазы, галактозидпермеазы и галактозидацетилазы возрастает в 10—100 раз. Индукция лактозного оперона по вышеприведенной классификации ответов относится к типу А (рис. 41.1). После удаления индуктора (сигнала) интенсивность наработки всех трех ферментов падает. Поскольку сами ферменты в клетках Е. coli не подвергаются существенной деградации, уровень активности ß-галактозидазы и двух других ферментов остается на прежнем уровне и падает лишь в связи с «разбавлением» в результате клеточного деления.
Когда клетки Е. coli выращивают в среде, содержащей смесь лактозы и глюкозы, в качестве единственных источников углерода, то в первую очередь метаболизируется глюкоза. После исчерпания глюкозы в среде рост клеток временно приостанавливается, пока не пройдет индукция лактозного оперона, в результате которой достигается уровень экспрессии соответствующих ферментов, достаточный для обеспечения метаболизма лактозы. Несмотря на то, что лактоза присутствует с самого начала, Lac-оперон не индуцируется до полного исчерпания глюкозы. Этот феномен сначала объясняли исходя из предположения о репрессии оперона одним из продуктов катаболизма глюкозы. Поэтому он получил название — «катаболитная репрессия». Сейчас уже известно, что «катаболитная репрессия» в действительности опосредуется действием белка-активатора катаболитных генов — так называемого СAP-белка (от англ. catabolite gene activator protein) — совместно с сАМР. Уровень экспрессии многих индуцибельных ферментных систем или оперонов у Е. coli и других прокариот чувствителен к катаболитной репрессии (см. ниже).
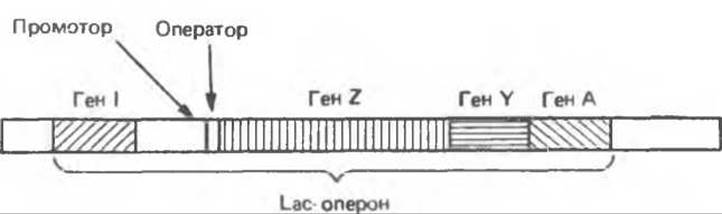
Рис. 41.3. Взаимное расположение структурных и регулярных генов в Lac-опероне.
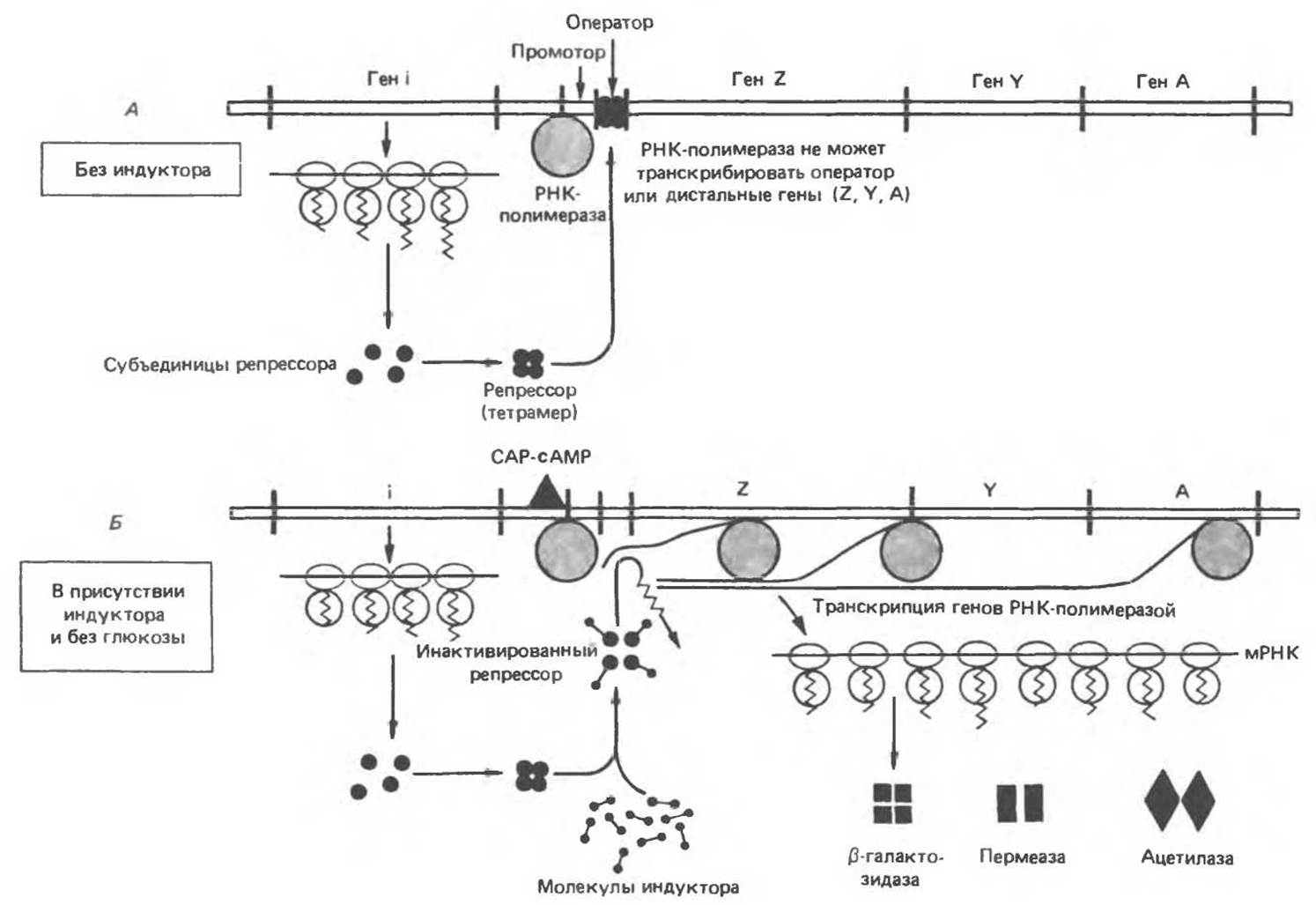
Рис. 41.4. Механизм репрессии и дерепрессии Lac-оперона. В отсутствие индуктора (А) репрессор (продукт конститутивно экспрессируемого гена i), связываясь с оператором, препятствует посадке PHК-полимеразы на локус промотора и соответственно предотвращает транскрипцию структурных генов Z, Y, А. В присутствии индуктора (Б) конститутивно синтезируемый репрессор инактивируется и не может связаться с оператором. В этом случае при наличии сАМР — САР-комплекса РНК-полимераза транскрибирует структурные гены Z, Y, А. Образующаяся полицистронная цепь мРНК транслируется с образованием белковых молекул ß-гатактозидазы. пермеазы и ацетилазы. обеспечивающих нормальный катаболизм лактозы.
Физиология индукции Lac-оперона в настоящее время хорошо изучена (рис. 41.4). Экспрессия нормального гена і Lac-оперона конститутивна, она проявляется в наработке с постоянной скоростью субъединиц Lac-peпpeccopa. Белковая молекула Lac-репрессора состоит из четырех идентичных субъединиц, каждая из которых имеет мол. массу 38 000. Репрессор — продукт гена і — обладает высоким сродством к соответствующему операторному локусу (Kd около 10-12 моль/л). Операторный локус — это определенный участок последовательности двухцепочечной ДНК длиной 27 пар оснований. В рамках этого участка последовательность длиной 21 п. о. характеризуется двойной симметрией вращения (показано сплошными линиями, ось симметрии обозначена точками):
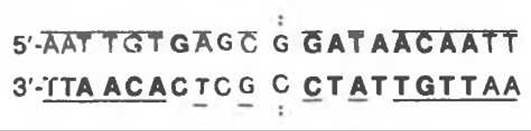
Минимальный эффективный размер оператора, с которым может связаться молекула Lac- репрессора, составляет 17 пар оснований (выделены жирным шрифтом). В каждый данный момент времени с оператором связаны две субъединицы репрессора. Внутри последовательности в 17 пар оснований по крайней мере одно основание каждой пары принимает участие в узнавании и связывании репрессора. Связывание происходит в основном в большой бороздке ДНК без нарушения нормальной двухспиральной структуры области оператора. Участок молекулы репрессора, включающий первые 52 аминокислотных остатка, связывается с ДНК, не проявляя, судя по всему, специфичности к какой-то определенной последовательности. Другая область репрессора (остатки с 53 по 58) строго специфично связывается с 17-звенным фрагментом операторной области протяженностью 6—7 нм. Аминокислотные остатки в положении 74—75 особенно важны для связывания индуктора с молекулой репрессора. Операторный локус находится между промотором, к которому перед началом транскрипции присоединяется ДНК-зависимая РНК-полимераза, и началом гена Z — структурного гена ß-галактозидазы (рис. 41.3). Присоединившись к оператору, репрессор препятствует транскрипции операторного локуса и дистальных структурных генов Z, Y и А. Таким образом, репрессор является негативным регулятором; в его присутствии подавляется экспрессия Z, Y и А-генов. Обычно на клетку приходится 20—40 тетрамерных молекул репрессора и 1—2 операторных локуса.
Аналог лактозы, способный индуцировать экспрессию Lac-оперона и не являющийся в то же время истинным субстратом ß-галактозидазы, можно назвать нерасходуемым индуктором. Добавление лактозы или нерасходуемого индуктора к культуре бактерий, выращиваемой на плохо утилизируемом источнике углерода (например, сукцинате), вызывает незамедлительную индукцию ферментов Lac-оперона. Небольшие количества лактозы или индуктора способны проникать в бактериальную клетку и в отсутствие пермеазы. Молекулы репрессора, как связанные с операторным локусом, так и находящиеся в свободном виде в цитоплазме, обладают сродством к молекулам индуктора. Связывание индуктора с молекулой репрессора, прикрепленной к операторному локусу, вызывает конформационные изменения структуры репрессора и приводит к диссоциации комплекса с ДНК. Если к этому моменту ДНК-зависимая РНК-полимераза уже связана с кодирующей цепью в промоторной области, то начинается транскрипция. Образующаяся при этом полицистронная мРНК имеет на 5'-конце последовательность, комплементарную кодирующей цепи оператора. Таким образом, индуктор дерепрессирует Lac-оперон и обеспечивает возможность транскрипции структурных генов ß-галактозидазы, галактозидпермеазы и галактозидацетилазы. Трансляция полицистронной мРНК может начаться еще до полного завершения транскрипции. Дерепрессия Lac-оперона позволяет клетке синтезировать ферменты, необходимые для катаболизма лактозы как источника энергии.
Для связывания РНК-полимеразы с последовательностью промотора необходимо наличие комплекса белка-активатора катаболитных генов (САР) с сАМР. Накопление сАМР происходит независимым образом только при недостатке в питательной среде источника углерода. В присутствии глюкозы или глицерола в концентрациях, обеспечивающих рост, концентрация сАМР в бактерии оказывается недостаточной для образования комплекса с САР и ДНК-зависимая РНК-полимераза не может начать транскрипцию Lac-оперона. Транскрипция начинается только при наличии комплекса САР—сАМР, связанного с промотором. Комплекс САР—сАМР действует как позитивный регулятор, поскольку его присутствие необходимо для обеспечения экспрессии генов. Таким образом, Lac-оперон является объектом как позитивной, так и негативной регуляции.
Если ген i мутирует таким образом, что его продукт — Lac-peпpeccop — утрачивает способность связываться с оператором, то экспрессия Lac-оперона становится конститутивной. И наоборот, если мутация приводит к неспособности репрессора связываться с индуктором, то дерепрессии Lac-оперона (необходимым условием которой является именно образование комплекса между индуктором и репрессором, связанным с операторной областью) не наблюдается даже при высоких концентрациях индуктора в среде.
Мутантная бактерия, у которой операторная последовательность изменена так, что нормальный репрессор оказывается неспособным связаться с ней, также приобретает способность к конститутивной экспрессии Lac-оперона.
Бактериофаг лямбда
Некоторые бактерии несут вирусы (умеренные бактериофаги), которые либо встроены в хромосому клетки-хозяина и реплицируются вместе с ней, либо существуют в клетке автономно и реплицируются самостоятельно, что в конечном итоге приводит к лизису и гибели бактерий. Один из таких умеренных бактериофагов — бактериофаг лямбда (λ). При инфицировании чувствительных бактерий Е. coli он «инъецирует» в бактериальную клетку свой геном, состоящий из линейной двухцепочечной ДНК размером 45000 пар оснований (рис. 41.5). В зависимости от физиологического статуса микроорганизма дальнейшее развитие фага может протекать либо по лизогенному пути, который заключается в интеграции фаговой ДНК с хозяйским геномом и сохранении в скрытой форме вплоть до «активации» (см. ниже), либо по пути литического развития. При этом происходит серия репликаций ДНК фага и образуется примерно 100 копий фагового генома. Каждый из них пакуется в белковый капсид, зрелые фаговые частицы вызывают лизис хозяйской клетки. Освободившиеся бактериофаги могут вновь инфицировать чувствительные бактериальные клетки.
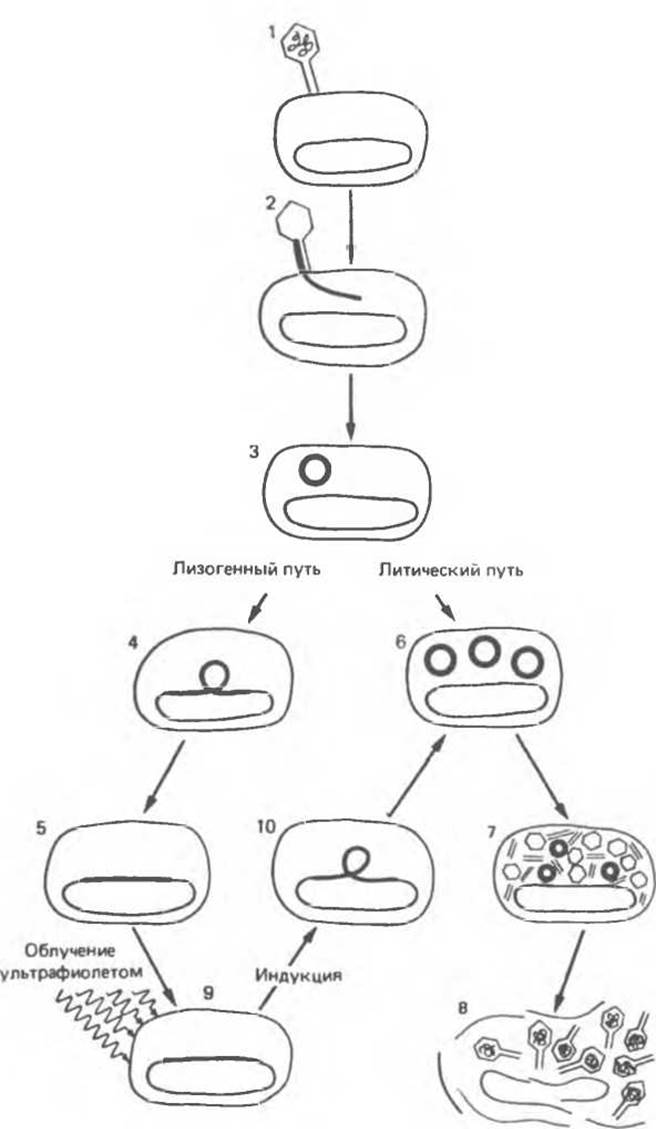
Рис. 41.5. Заражение Е.соli фагом λ начинается с адсорбции фаговой частицы на поверхности бактериальной клетки (1). Следующий этап — инъекция фаговой ДНК (темная линия) в клетку (2, 3). Далее события развиваются в одном из двух возможных направлений. При лизогенном пути фаговая ДНК встраивается в бактериальную хромосому (4, 5). В этом случае ДНК фага реплицируется, как интегральная часть хромосомы — пассивно, при клеточном делении. Клетки, несущие интегрированный («спящий») вирус, называют лизогенными, а сам интегрированный фаг профагом. При альтернативном литическом пути развития инфекции фаговая ДНК реплицируется независимо (6) и направляет синтез фаговых белков (7). Образуется около 100 новых фаговых частиц. Размножение фага в конечном итоге приводит к лизису клетки-хозяина (8). Профаг может быть индуцирован при воздействии различных факторов, например при ультрафиолетовом облучении (9). Индуцирующий агент осуществляет переключение в работе двух альтернативных наборов генов. При этом ДНК фага вырезается из хозяйской хромосомы (10) и начинается литический цикл. (Reproduced, with permission, from Ptashne M., Johnson A. D., Pabo С. О A genetic switch in a bacterial virus. Sсi. Am. [Nov.] 1982, 247, 128.)
Будучи интегрированной с геномом клетки-хозяина, ДНК фага λ сохраняется в «скрытом» состоянии (в виде профага) до тех пор, пока не будет подвержена активации в результате воздействия на лизогенную клетку тех или иных ДНК-повреждающих агентов. В ответ на такое воздействие профаг «индуцируется» — начинается транскрипция и трансляция фаговых генов, необходимых для вырезания фаговой ДНК из хозяйской хромосомы, ее репликации, упаковки в белковый капсид и клеточного лизиса. Это развитие запускается с помощью механизма, подобного триггерному, что соответствует варианту С на рис. 41.1. Это означает, что после акта индукции профага обратное развитие становится невозможным: процесс протекает вплоть до клеточного лизиса и высвобождения новых фаговых частиц. Переключение пути развития с лизогенного (состояние профага) на литический (вирулентный фаг) прекрасно изучено на молекулярном и генетическом уровнях и будет далее представлено в виде парадигмы.
В переключении пути развития фага участвует область ДНК размером в 80 пар оснований, называемая «правым оператором» (ОR) (рис. 41.6. А). Правый оператор фланкирован слева структурным геном репрессора фага лямбда, а справа — структурным геном другого регуляторного белка, называемого сrо. Единственным фаговым геном, экспрессирующимся при нахождении фаговой ДНК в составе хозяйской хромосомы, т. е. в состоянии профага, является ген репрессора. При литическом развитии ген репрессора не экспрессируется, но идет активная экспрессия гена crо, равно как и многих других фаговых генов. Таким образом, когда ген репрессора включен, ген crо — включен, и наоборот, когда ген crо включен, ген репрессора — выключен. Как мы увидим далее, эти два гена регулируют друг друга, что в конечном счете и определяет выбор между литическим и лизогенным путями развития фага λ.
Область оператора состоит из трех расположенных друг за другом дискретных похожих, но не идентичных участков последовательности длиной по 17 пар оснований (рис. 41.6, Б). Каждый из этих трех участков ОR1, OR2 и ОR3 може г связывать репрессор или сrо-белок главным образом за счет контактов между молекулой белка небольшой бороздкой двойной спирали ДНК. Область ДНК между генами репрессора и его также содержит две промоторные последовательности, которые определяют связывание РНК-полимеразы в определенной ориентации. Один промотор направляет транскрипцию вправо, и потому с него транскрибируется его и другие дистальные гены. Другой промотор направляет транскрипцию влево, т. е. в направлении транскрипции гена репрессора (рис. 41.6, В).
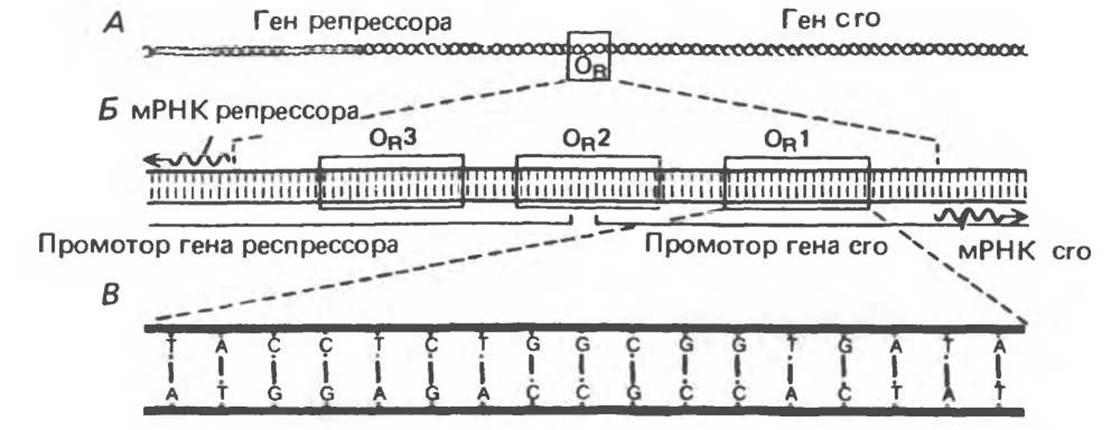
Рис. 41.6. Схематическое изображение правого оператора (OR) фага λ (серия рисунков с последовательным увеличением количества деталей структуры). Область оператора — это участок фаговой ДНК размером около 80 п. о. А. Операторная область фланкируется геном лямбда-репрессора (слева) и геном регуляторного белка его (справа). Б. Область оператора состоит из трех функциональных участков OR1, OR2, OR3, каждый длиной 17 пар оснований. Все три участка узнаются как репрессором, так и белком его. Эти участки перекрываются с последовательностями двух промоторов, т. е. с участками связывания РНК-полимеразы, что необходимо для начала синтеза мРНК (волнистая линия), по которой затем идет синтез соответствующего белка. В. Нуклеотидная последовательность участка OR1. (Reproduced with permission from Ptashne M., Johnson A. D, Pabo C.O. A genetic switch in a bacterial virus. Sci. Am. [Nov.] 1982, 247, 128.)
Продукт гена репрессора, белок-репрессор, состоящий из 236 аминокислот, организован в двухдоменную структуру, в которой N-концевой домен связывается с ДНК операторного участка, а С-концевой домен отвечает за связывание с другой молекулой репрессора с образованием димера. Димерный репрессор связывается с ДНК оператора более прочно, чем мономер (рис. 41.7, А—В).
Продукт гена crо, сrо-белок, состоящий из 66 аминокислот, обладает однодоменной структурой, но также связывается более прочно с оператором в димерной форме (рис. 47.7, Г). Очевидно, что единственный домен cro-белка отвечает как за связывание с ДНК, так и за димеризацию.
В лизогенной бактерии, содержащей фаг λ, в состоянии профага, λ-репрессор связывается преимущественно с OR1, и при этом за счет кооперативных взаимодействий способствует связыванию другой димерной молекулы репрессора с участком ОR2 (рис. 41.8). Из трех участков оператора наименьшим сродством к репрессору характеризуется участок OR3. Связывание репрессора с ОR1 приводит к двум основным эффектам. Во-первых, РНК-полимераза не может связаться с правонанравленным промотором, и, следовательно, сrо-ген не экспрессируется. Во-вторых, как сказано выше, репрессорный димер, связавшись с ОR1, усиливает связывание другого димера с ОR2. Связывание репрессора с ОR2 дает важный дополнительный эффект, проявляющийся в повышении эффективности связывания РНК-полимеразы с левонаправленным промотором, перекрывающимся с OR2, что приводит к усилению экспрессии гена репрессора. Такое усиление, по-видимому, опосредовано взаимодействием белок — белкового характера между репрессором, связанным с OR2, и РНК-полимеразой, связанной с промотором. Следовательно, Х-репрессор служит одновременно и негативным регулятором, препятствующим транскрипции гена crо, и позитивным регулятором, усиливающим транскрипцию своего собственного гена. Этот двойственный характер действия репрессора обусловливает стабильность состояния профага: репрессор не только подавляет экспрессию генов литического развития, но и усиливает свою собственную экспрессию. И то и другое способствует поддержанию лизогенного статуса клетки (т. е. существование бактеориофага в форме профага). Когда концентрация репрессора достигает очень высоких значений, становится возможным его связывание с OR3, что в свою очередь понижает эффективность транскрипции гена репрессора с левого промотора. Как следствие этого, концентрация репрессора снижается до таких значений, при которых происходит диссоциация комплекса репрессора с участком OR3.
Когда ДНК-повреждающий сигнал, например ультрафиолетовое облучение, оказывает воздействие на лизогенную бактериальную клетку, образующиеся фрагменты одноцепочечной ДНК активируют специфическую бактериальную протеазу, кодируемую геном rеc А (рис. 41.8). Активированная rесА-протеаза расщепляет ту часть молекулы репрессора, которая соединяет его N- и С-концевые домены. Такое расщепление приводит к диссоциации димера репрессора, а затем и его комплекса с ОR2 и с OR1. Последствия удаления репрессора с участков OR1 и OR2 легко предсказуемы. РНК-полимераза немедленно получает доступ к правонаправленному промотору и начинает транскрипцию гена crо. Кроме того, утрачивается и усиливающий эффект комплекса репрессор — ОR2 на левостороннюю транскрипцию (рис. 41.8).
Белок crо, образующийся при трансляции новообразованного транскрипта, также связывается с операторной областью в димерной форме, но порядок предпочтения операторных участков у сrо-белка — обратный по сравнению с белком-репрессором. То есть сrо-белок наиболее прочно связывается с ОR3, при этом полностью отсутствует какой-либо кооперативный эффект связывания с OR3 в отношении связывания другой димерной молекулы с участком ОR2. При повышении концентрации сrо-белок начинает связываться с ОR2, а затем и с OR1.
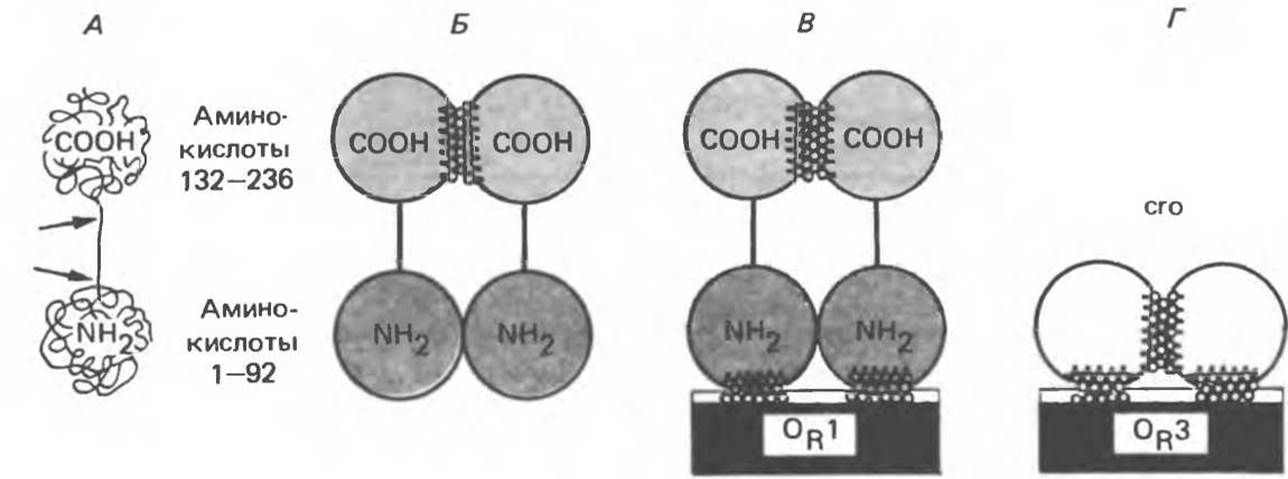
Рис. 41.7. Белок лямбда-репрессора представляет собой полипептид длиной 236 аминокислот. Полипептид свертывается в гантелеобразную структуру, в рамках которой можно выделить два домена — N- и С-концевой. Эти два домена соединены между собой участком полипептидной цепи, чувствительным к действию протеаз (А). Единичные молекулы репрессора (мономеры) ассоциируют в димеры (В). Димер способен вновь диссоциировать до мономеров. Мономеры удерживаются в димере в основном за счет взаимодействия С-концевых доменов (область контакта заштрихована). Димеры репрессора способны обратимо связываться с операторным участком, проявляя наибольшее сродство к участку OR1 (В). Контакты с ДНК (заштрихованная область) осуществляются в основном при участии N-концевых доменов. Белок crо (Г) — однодоменный белок, обладающий сайтами димеризации; в димерной форме этот белок связывается с оператором, предпочтительно с участком OR3. (Reproduced with permission from Ptashne M., Johnson A. D., Pabo C. O. A genetic switch in bacterial virus Sci. Am [Nov.] 1982, 247, 128.)
«Посадка» сrо-белка на ОR3 незамедлительно отключает левостороннюю транскрипцию и, следовательно, препятствует дальнейшей экспрессии гена репрессора. Таким образом происходит полное переключение — экспрессируется сrо-ген, а ген репрессора выключен. Это событие необратимо, вслед за ним начинается экспрессия остальных фаговых генов, т. е. запускается цикл нормального литического развития фага λ. Когда концентрация cro-белка становится достаточно высокой, он связывается с участком OR1 и таким образом снижает уровень экспрессии собственного гена, что существенно для реализации последних стадий цикла литического развития.
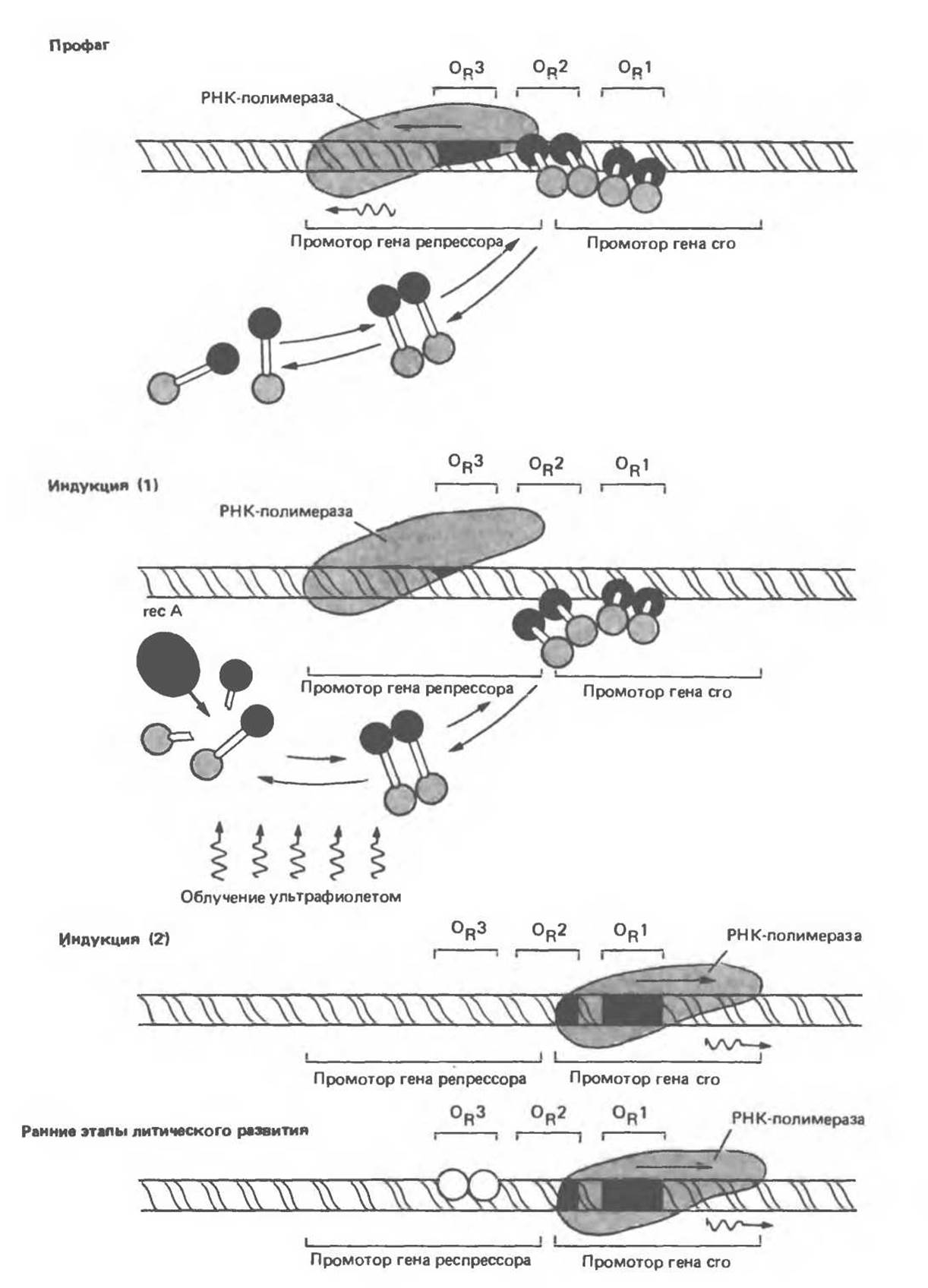
Рис. 41.8. Четыре стадии жизненного цикла фага λ и схема переключения пути развития. Лизогенный путь (вирус в состоянии профага) избирается при связывании димерного репрессора с OR1. Посадка репрессора на OR1 способствует связыванию другой молекулы репрессора с ОR2. В состоянии профага (вверху) димеры репрессора, связавшись с OR1 и ОR2, препятствуют посадке РНК-полимеразы на расположенный справа промотор и таким образом блокируют синтез сrо-белка (негативный контроль). При этом одновременно стимулируется связывание полимеразы с расположенным слева промотором (позитивный контроль), что приводит к более активной транскрипции гена репрессора (рспрессорная мРНК изображена волнистой линией) и соответственно к более эффективной наработке белка-репрессора, обеспечивающего поддержание лизогенного состояния. Профаг может быть индуцирован, кoгда активированная ультрафиолетовым облучением протеаза rеc А начинает расщеплять мономеры репрессора. Равновесие между свободными молекулами мономеров, димеров и связанных с оператором димеров нарушается, и димеры покидают операторный участок. Ничто более не способствует связыванию РНК-полимеразы с левым промотором, и синтез репрессора прекращается. В процессе индукции высвобождаются все операторные участки, полимераза связывается с правым промотором и начинается наработка сrо-белка. На ранних этапах литического цикла единичный димер сrо-белка связывается с участком ОR3, к которому он обладает повышенным сродством. Теперь полимераза не может связаться с левым промотором, а правый промотор остается доступным. Полимераза продолжает связываться с ним. Происходит транскрипция гена crо и других ранних литических генов. Устанавливается литический путь развития. (Reproduced with permission from Ptashne M., Johnson A. D., Pabo C. O. A genetic switch in bacterial virus. Sci. Am. [Nov.] 1982, 247, 128.)
И для cro-белка, и для белка-репрессора с помощью методов рентгеновской кристаллографии установлена пространственная структура. Предложены и проверены модели связывания данных белков с ДНК, проанализированы и имеющие к этому отношение молекулярные и генетические события. До настоящего времени фаг λ остается наиболее изученным и в отношении молекулярного механизма регуляции экспрессии генов.
Аттенуация транскрипции
Бактериальные опероны, ответственные за биосинтез аминокислот, часто обладают дополнительной системой контроля экспрессии, основанной на преждевременной терминации транскрипции. Этот процесс, называемый аттенуацией, функционирует независимо от промоторно — операторной системы регуляции экспрессии. Аттенуация используется для регуляции экспрессии в ответ на воздействие различных физиологических факторов. Процесс регуляции на основе аттенуации включает начало трансляции, остановку рибосомы и переключение альтернативных вариантов вторичной структуры РНК, один из которых формирует терминатор транскрипции, а другой — препятствует образованию терминаторной структуры. У Е. coli объектами аттенуации являются опероны триптофана, фенилаланина, гистидина, треонина, лейцина, изолейцина и валина.
Остановимся на аттенуации триптофанового (Тrр) оперона, как наиболее полно изученной системе. Структура триптофанового (Тrр) оперона представлена на рис. 41.9. Его промоторно — операторная система регуляции аналогична описанной выше для Lac-оперона. Репрессия Тrр-оперона приводит к 70-кратному снижению уровня транскрипции, однако мутанты, лишенные функциональной системы репрессии, тем не менее сохраняют способность отвечать на триптофановое голодание 8—10-кратным повышением уровня синтеза Тrр-мРНК. При анализе других типов мутаций в Е. coli стало ясно, что процесс аттенуации связан скорее с эффективностью трансляции триптофановых кодонов, чем с непосредственным влиянием изменения концентрации свободного триптофана в среде. Вскоре было установлено, что в TrpL-участке (рис. 41.9) оперона может происходить преждевременная терминация транскрипции, предотвращающая транскрипцию дистальных генов (TrpEDCBA) оперона. Эта преждевременная терминация происходит тогда, когда трансляция триптофановых кодонов в TrpL протекает с нормальной скоростью. В результате такой терминации (аттенуации) образуется так называемый лидерный транскринт длиной 140 нуклеотидов вместо протяженного полицистронного транскрипта всего оперона, необходимого для образования всех ферментов пути биосинтеза триптофана. С помощью методов генной инженерии удалось получить мутации по аттенуаторному участку и провести анализ соответствующих нуклеотидных последовательностей. Комбинация генетических и генноинженерных подходов позволила воссоздать следующую динамическую картину процесса аттенуации.
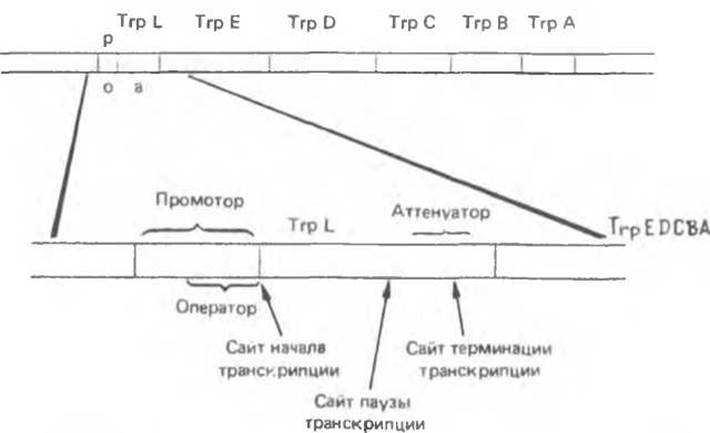
Рис. 41.9. Регуляторная область и структурные гены Ткр- оперона E.coli Инициация транскрипции контролируется промотором-оператором Терминация транскрипции контролируется аттенуатором в области 162-звенной лидерном последовательности Тrр L. Все молекулы полимеразы, осуществляющие транскрипцию оперона, прежде чем двигаться дальше, делают временную остановку на участке аттенуации (Reproduced with permission from Yanofsky C Attenuation in control of expression of bacterial operons. Nature 1981. 289, 751.)
На участке Тгр-промотора РНК-полимераза, свободная от контроля со стороны репрессора, начинает транскрипцию оперона и доходит до 90-го нуклеотида (рис. 41.10), где она делает временную остановку. Во время этой паузы к образовавшемуся 5'-концу лидерного транскрипта в области 27—29 стартовою кодона AUG прикрепляется рибосома, происходит трансляция лидерною пептида длиной 14 аминокислот. Начиная с положения 54, в транскрипте последовательно расположены два триптофановых кодона, поэтому для продолжения трансляции необходимо присутствие тРНКТrр. Следует отметить, что триптофан — относительно редкая аминокислота. Еще реже два остатка триптофана располагаются друг за другом в составе полипептидов, поэтому трансляция лидерного пептида является способом «тестирования» уровня тРНКТrр, который в свою очередь зависит от уровня триптофана в клетке. Когда РНК-полимераза возобновляет транскрипцию после сайта остановки (в положении 90), рибосома, транслирующая лидерный пептид, доходит до стоп-кодона (в положении 70) при наличии в достаточных количествах тРНКТrр. При недостатке тРНКТrр рибосома останавливается раньше — на участке, содержащем два тандемных триптофановых кодона. Положение рибосомы на лидерном транскрипте определяет выбор одной из двух альтернативных вторичных структур, образуемых РНК-транскриптом.
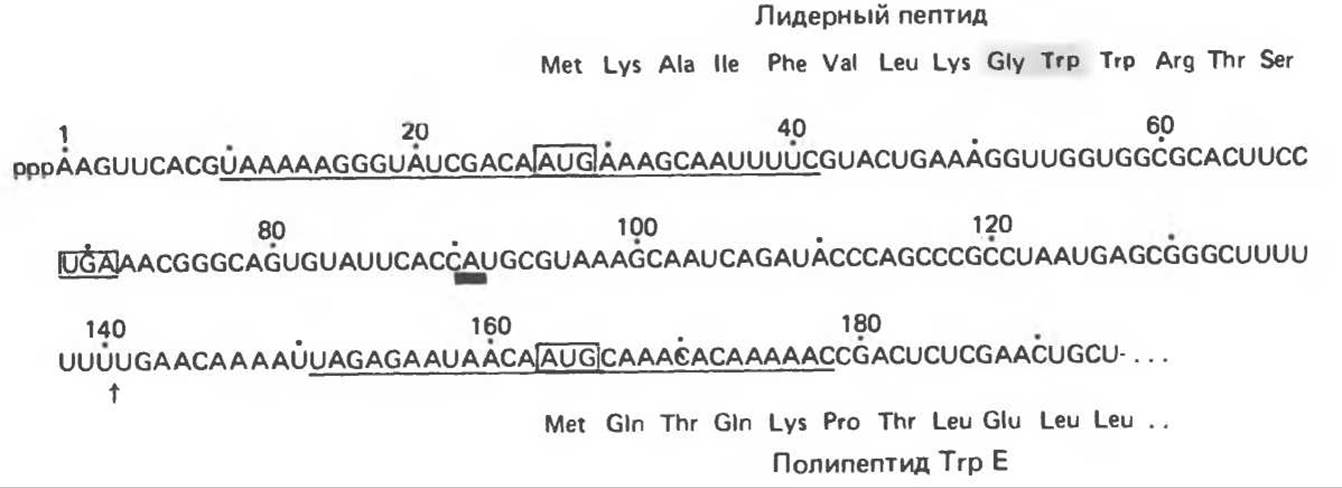
Рис. 41.10. Нуклеотидная последовательность 5'-конца Trp-мРНК. Показан нетерминированный транскрипт. При терминации транскрипции на аттенуаторе образуется 140-нуклеотидный транскрипт. Его 3'-конец обозначен стрелкой. 3'-Конец 90-членного транскрипта, образованного при остановке в сайте паузы транскрипции, показан жирной чертой. Два сайта связывания рибосомы с триплетами AUG в центре подчеркнуты. Заключены в квадраты кодоны начала (AUG) и конца (UGA) трансляции. Показаны предполагаемые аминокислотные последовательности лидерного пептида и начала белка Trp Е. (Reproduced with permisson from Yanofsky C. Attenuation in the control of expression of bacterial operons. Nature 1981. 289, 751.)
Нуклеотидная последовательность лидерного транскрипта такова, что между областями, обозначенными цифрами 1 и 2, 3 и 4, возможно формирование шпилечных структур (рис. 41.11) в соответствии с правилами образования комплементарных пар (А: U, G: С). Шпилька между областями 3 и 4 служит сигналом терминации транскрипции. В этом случае транскрипция завершается примерно за 140-м нуклеотидом с образованием преждевременно терминированного транскрипта длиной 140 нуклеотидов.
Области 2 и 3 транскрипта также способны образовать шпильку. Это приводит к образованию альтернативной вторичной структуры, препятствующей формированию терминирующего сигнала шпильки 3:4. Когда рибосома временно останавливается на двух Trp-кодонах (рис. 41.11, Б), область 1 оказывается «защищена», а области 2 и 3 образуют шпилечную структуру. Тем самым исключается преждевременная терминация и РНК-полимераза может продолжить транскрипцию за 140-й нуклеотид с образованием полицистронной мРНК, которая кодирует ферменты биосинтеза триптофана.
Если в клетке имеется достаточное количество Тrр—тРНКТгр, рибосома проходит Trp-кодоны в лидерной последовательности и доходит до сигнала остановки трансляции (UGA) в области 2, экранируя таким образом обе области — 1 и 2. При этом сегменты 3 и 4 могут образовать шпильку — сигнал преждевременной терминации транскрипции, далее которого РНК-полимераза не сможет вести транскрипцию оперона. Вместо полицистронной мРНК, кодирующей ферменты триптофанового оперона, образуется преждевременно терминированный транскрипт длиной 140 нуклеотидов. Образование взаимоисключающих вторичных структур (между областями 2 и 3 или 3 и 4) и является внутриклеточным сигналом, информирующим РНК-полимеразу о способности клетки транслировать триптофановые кодоны.
На рис. 41.12 представлены аминокислотные последовательности лидерных пептидов, предсказанные по соответствующим нуклеотидным последовательностям, для нескольких других оперонов Е. coli и Salmonella typhimurium. Из рисунка видно, что в лидирующей последовательности существенно превалирует именно та аминокислота, ферменты биосинтеза которой кодируются данным опероном.
Недавно феномен аттенуации был описан и для клеток млекопитающих. Механизм аттенуации для них неизвестен, однако очевидно, что он должен сильно отличаться от вышеописанного, поскольку транскрипция и трансляция у эукариот происходят в разных внутриклеточных компартментах.
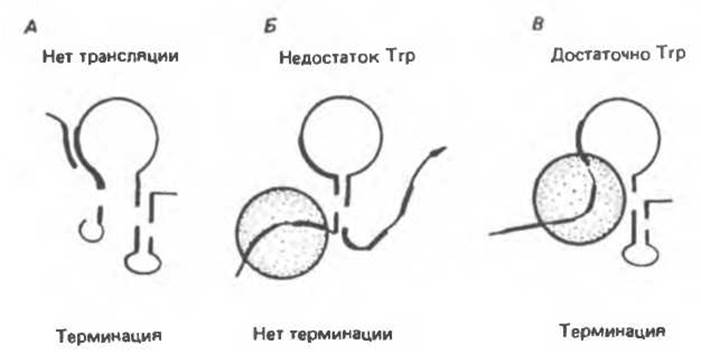
Рис. 41.11. Модель процесса аттенуации для Trp-оперона E.coli. При избытке триптофана рибосома, транслирует лидерную РНК, в результате синтезируется полный лидерный пептид. Рибосома маскирует области I и 2 цепи мРНК и препятствует таким образом образованию шпилек из последовательностей 1:2 и 2:3. В этих условиях свободно образуется только шпилька 3:4, РНК-полимераза (не показана) транскрибирует лидерный пептид до полной остановки транскрипции. При недостатке триптофана заряженная тРНКТrр будет лимитирующим фактором и рибосома задержится на тандемных триптофановых кодонах лидерного пептида. В данном случае рибосома маскирует только область, поэтому может образоваться шпилька 2:3, что исключает возможность образования терминирующей шпильки 3:4. В связи с этим РНК-полимераза продолжает транскрипцию области структурных генов. Когда лидерный транскрипт не транслируется, становится возможным образование шпильки 1:2 непосредственно после синтеза соответствующих участков в ходе транскрипции, что в свою очередь создает благоприятные условия для формирования терминирующей шпильки 3:4. (Reproduced with permission from Oxender D., Zurawski G., Yanofsky C. Attenuration of the Escherichia coli tryptophan operon: Role of RNA secondary structure involving trytophan codon region. Proc. Natl. Acad. Sсi. USA 1979. 76, 5524.)