Биохимия человека Том 2 - Марри Р. 1993
Структура, функция и репликация информационных макромолекул
Регуляция экспрессии генов
Регуляция экспрессии генов у эукариот
В эукариотических клетках ядерная мембрана физически разделяет процессы транскрипции и трансляции, поскольку рибосомы присутствуют только в цитоплазме. Экспрессия генов у эукариот включает гораздо большее число этапов, нежели у прокариот, особенно это относится к процессингу РНК. Соответственно у эукариот существует ряд точек приложения регуляторных воздействий, полностью отсутствующих в прокариотических системах. Так, процессинг РНК у эукариот включает кэпирование 5'-конца первичного транскрипта, добавление полиаденилатного «хвоста» к 3'-концу транскрипта и вырезание интронов. Полученные к настоящему времени данные свидетельствуют, что экспрессия генов эукариот регулируется на уровне транскрипции, процессинга РНК в ядре и стабильности мРНК. Кроме того, было показано, что на экспрессию эукариотических генов оказывают влияние амплификация и перестройка генов.

Рис. 41.12. Установленные по нуклеотидной последовательности первичные структуры лидерных пептидов Phe А-. His-. Leu-, Thr- и Ilv (изолейцин, лейцин, валин)-оперонов E.coli или S typhimurium. Аминокислоты, регулирующие данный оперон, выделены шрифтом и подчеркнуты (Reproduced with permission from Yanofsky C. Attenuation in control of expression of bacterial operons. Nature 1981, 289, 751)
Благодаря достижениям генной инженерии за последние годы достигнут значительный прогресс в понимании процесса экспрессии эукариотических генов. Однако, поскольку большинство эукариот содержит значительно больше генетической информации, чем прокариоты, а возможности манипуляций с генами эукариот существенно ограничены, молекулярные аспекты регуляции эукариотических генов изучены гораздо хуже. В этой части главы очень кратко представлено несколько типов регуляции эукариотических генов.
Амплификация генов в ходе развития
На ранних этапах развития многоклеточных возникла необходимость в резком увеличении числа определенных молекул, например рибосомных РНК или мРНК белков, формирующих такие специфические образования, как, например, яичная скорлупа. Одним из путей интенсификации синтеза таких молекул может служить увеличение числа копий соответствующих генов. Так, например, повторяющиеся последовательности ДНК включают сотни копий генов рРНК и тРНК. Многокопийность этих генов заложена в геномном материале гамет изначально и, следовательно, передается от поколения к поколению. У некоторых организмов, таких, как плодовая мушка (Drosophila), амплификация нескольких определенных генов, например генов белков хориона, происходит в ходе оогенеза. В этом случае увеличение числа копий данного гена, вероятно, достигается путем многократной инициации синтеза ДНК в одном и том же репликационном пузыре, благодаря чему возникают множественные сайты инициации транскрипции соответствующих генов (рис. 38.16 и 41.13).
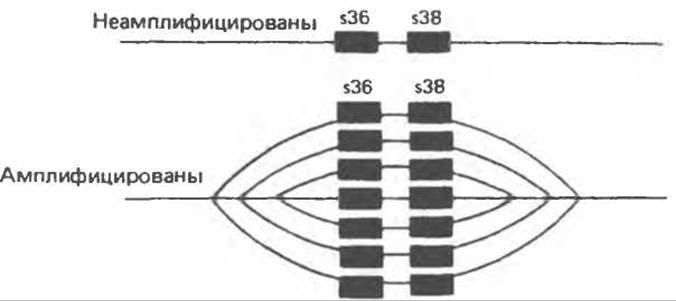
Рис. 41.13. Схема процесса амплификации генов хорионических белков s36 и s38. (Reproduced with permission from Chisholm R. Gene amplification during development. Trends Biochem. Sсi. 1982, 7, 161.)
В последние годы появилась возможность вызывать амплификацию специфических областей генома культивируемых клеток млекопитающих. В некоторых случаях последовательное применение увеличивающихся доз селективного агента приводит к амплификации специфического гена в несколько тысяч раз. Так, у онкологических больных, получавших метотрексат (противораковый препарат), развивалась устойчивость опухолевых клеток к этому лекарству. В основе этой лекарственной резистентности лежит амплификация гена дигидрофолатредуктазы, которая сама по себе является точкой приложения в терапевтическом действии метотрексата. Спонтанно произошедшая амплификация генов in vivo, т. е. в отсутствие экзогенных селективных агентов, может закрепиться в геноме при соответствующем давлении отбора.
Перестройка генов иммуноглобулинов
Один из наиболее интересных и сложных вопросов, вставших перед биологами в последние десятилетия, был связан с генетическими и молекулярными основами множественности антител (см. гл. 55). Кроме того, благодаря достижениям в области иммунологии было показано, что клетки иммунной системы человека, дифференцируясь, производят антитела с одной и той же специфичностью, но с различными эффекторными функциями. В последние несколько лет исследования ряда лабораторий внесли весомый вклад в понимание генетической основы множественности антител и регуляции экспрессии генов иммуноглобулинов в ходе развития и клеточной дифференцировки.
Как описано в гл. 39, нуклеотидные последовательности, кодирующие ту или иную белковую молекулу, в геноме млекопитающих часто оказываются разделенными на отдельные сегменты, непосредственно не связанные между собой. Впервые раздельная локализация фрагментов одного и того же гена была продемонстрирована на примере сегментов ДНК, кодирующих вариабельный и константный домены легкой цепи молекулы иммуноглобулинов (антител). Иммуноглобулины, как описано в гл. 55, состоят из двух различных полипептидных цепей — легкой (L) и тяжелой (Н) (рис. 55.3). Как L-, так и Н- цепи имеют на N-конце вариабельные (V) и на С-конце константные (С) участки. Вариабельные области ответственны за распознавание антигенов (чужеродных молекул), а константные — за эффекторные функции, определяющие дальнейшую судьбу комплекса антиген - антитело.
За формирование молекулярной структуры иммуноглобулинов отвечают три несцепленных семейства генов. Два из них кодируют легкие λ- и к- цепи и одно — тяжелые цепи иммуноглобулинов.
Каждая легкая цепь детерминирована тремя отдельными сегментами — вариабельным (VL), соединительным (JL) и константным (CL). Гаплоидный геном млекопитающих содержит около 500 различных VL-сегментов, 5—6 JL-сєгмєнтов и, вероятно, 10 или 20 CL-сегментов. При дифференцировке лимфоидных В-клеток VL-сегмент переносится с дистального участка данной хромосомы ближе к JL- и CL-сегментам. Такая перестройка хромосомной ДНК позволяет осуществить транскрипцию всех трех сегментов в виде единого первичного транскрипта РНК-предшественника, образующего после процессинга зрелую молекулу мРНК легкой цепи иммуноглобулинов данного вида. Перестановка различных VL-, JL- и СL-сегментов в геноме позволяет иммунной системе организма создать чрезвычайно разнообразную библиотеку антигенспецифических молекул иммуноглобулинов. Такие перестановки при образовании генов легких цепей называют V—J-соединением.
Тяжелая цепь кодируется четырьмя сегментами: VH, D (от англ. diversity — разнообразие), JH и СH. Вариабельная область тяжелой цепи образуется при соединении VH-, JH- и D-сегментов. Образовавшая VH—D—JH-область ДНК в свою очередь соединяется с одним из восьми СH-генов. Эти СH-гены (Сμ, Сδ, Сy3, Су1, Cy2b, Сa2а, Сa и Сε) определяют классы и подклассы — IgM, IgG, IgA и т.д. — иммуноглобулиновых молекул (см. гл. 55). Пример перестроек и процессинга, приводящих к образованию тяжелой цепи Сy2b, представлен на рис. 41.14.
В результате дифференцировки В-клетки, секретирующие антитела против определенного антигена, получают возможность секретировать антитела различных классов, характеризующихся одинаковой антигенной специфичностью, но различной биологической функцией. Различные классы иммуноглобулинов построены из одинаковых легких цепей и VH- областей тяжелых цепей, но содержат различные СH-области тяжелых цепей. Следовательно, единичная В-клетка и ее клоновые производные способны претерпевать «переключение классов» продуцируемых иммуноглобулинов. Переключение классов вызывается перестройкой ДНК другого типа, происходящей при дифференциации иммунной системы. Следует подчеркнуть, что соединение V- и J-сегментов для экспрессии легкой цепи и соединение сегментов V—D—J тяжелой цепи по стадии развития и по времени предшествуют перестройкам ДНК, вызывающим переключение классов синтезируемых иммуноглобулинов.
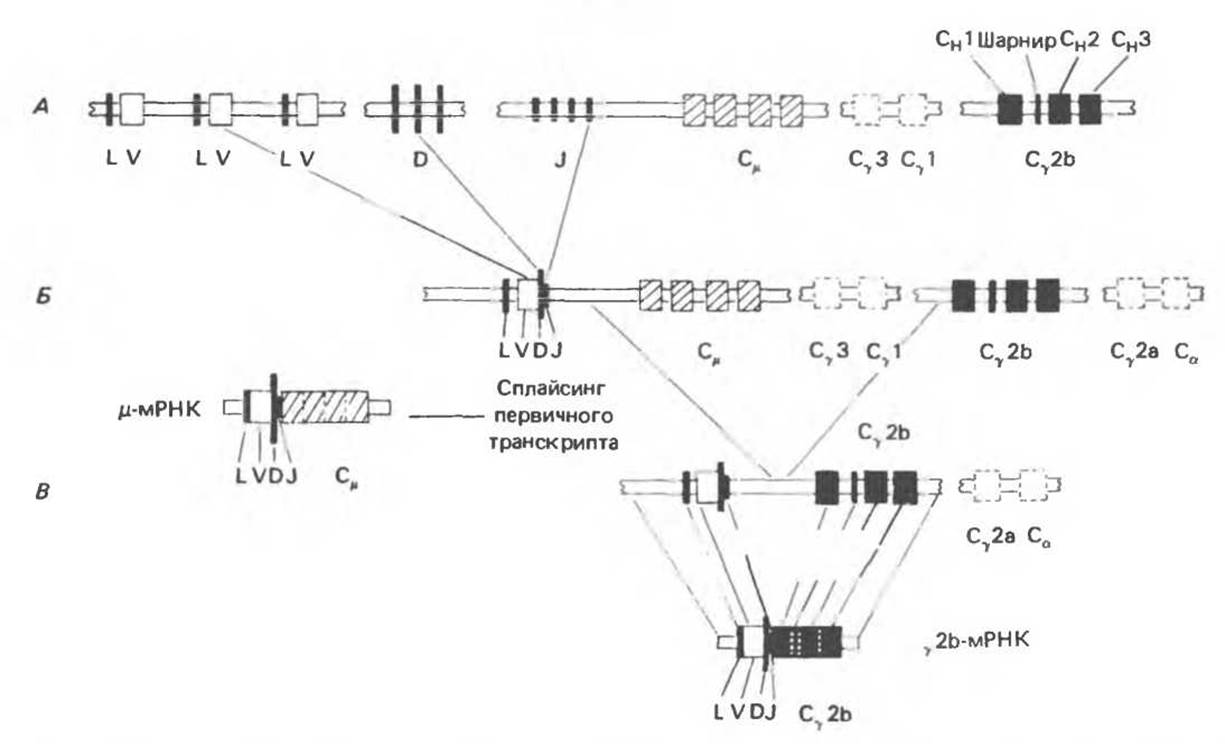
Рис. 41.14. Рекомбинационные события, ведущие к образованию полноценного гена у2b-иммуноглобулиновой тяжелой цепи. А. ДНК клеток зародышевой линии до перестроек. В геноме клеток зародышевой линии часть вариабельной области (V) молекулы кодируется кластером из по крайней мере 50 генов, каждый из которых обладает собственной короткой лидерной последовательностью (L). Кластер D-генов кодирует большую часть третьей гипервариабельной области. На некотором расстоянии расположены четыре J-сегмента, завершающие кодирующую V-область. На расстоянии около 8000 п. о. от J-сегментов расположен ген СH — первый из кластера генов С-области. Гeны в С-области прерываются некодирующими последовательностями. Экзоны этой области структурно совпадают с доменами и шарнирным участком соответствующей аминокислотной последовательности. Б. При первой перестановке по одному сегменту каждого кластера (V, D, J) объединяются в единую структуру, формируя полноценную транскрипционную единицу μ-цепи. Транскрипт представляет собой копию показанного на рисунке гена. При удалении интронов образуется р-мРНК, содержащая непрерывную кодирующую последовательность. В. При второй перестановке, отвечающей этапу переключения типа тяжелой цепи, делегируются сегменты Сμ, Су3 и Су1, а V—D—J-сегмент вместе с частью J—СH-интрона переносится к Су 2b-гену. После завершения транскрипции интроны удаляются и формируется у 2b-мРНК. содержащая непрерывную кодирующую последовательность. (Reproduced, with permission, from Molgaard N.V. Assembly of immunoglobulin heavy chain genes. Nature 1980, 286, 659.)
Переключение классов
В онтогенезе иммуноглобулин-секретирующих В-клеток и их клональных производных, включая окончательно дифференцированные клетки плазмы, последовательность синтеза и секреции иммуноглобулинов начинается с IgM, затем переключается на синтез IgA или IgG и т. д. В геноме клеток зародышевой линии JH-сегменты непосредственно соседствуют с СH-генами и, таким образом, при произошедшей перестройке VH—D—JH-сегментов возможна прямая транскрипция предшественника мРНК для μ-цепи, не требующая каких-либо дополнительных перестроек. Однако при последующей дифференцировке для переключения синтеза IgM на IgA V—D—J-область должна быть подвергнута перестановке для соединения с Са-геном. Только после этого становится возможным синтез предшественника мРНК a-цепи, содержащей тот же самый антигенспецифичный вариабельный участок.
Порядок расположения восьми тесно сцепленных СH-генов следующий: Сμ, Сa, Сy3, Су1, Сy2b, Су2а, Са и Сε. Порядок переключения синтеза классов во времени повторяет физический порядок расположения Сн-генов — слева направо. В большинстве изученных на сегодняшний день случаев перестройки, связанные с переключением классов иммуноглобулинов, судя по всему, представляют собой делеции СH-генов, расположенных между V—D—J-областью и 5'-концом присоединяемого СH-гена.
Пример рекомбинационных событий или перестановок, приводящих к образованию полного Су2b-гена, приведен на рис. 41.14. Вначале происходят перестановки, связанные с образованием V—D—J-области, а затем перестройка или делеция соответствующих СH-генов. Последовательности С-участков гена соответствуют доменам, расположенным в области «шарнира» (гл. 55). Промежуточные последовательности или интроны удаляются из первичного транскрип га при сплайсинге, механизм которого рассмотрен в гл. 39.
Описанная комбинаторика сочетаний отдельных сегментов со всей очевидностью значительно увеличивает закодированный в геноме объем информации. Этот механизм не только обеспечивает множественность вариантов структур вариабельных областей, но позволяет закрепить полезные перестройки при изменении функции клеточной линии в ходе клеточной дифференцировки.
Кажущийся сложным процесс перестройки ДНК при развитии и дифференцировке клеток может быть объектом достаточно простой регуляции, основанной на своевременной индукции и репрессии специфических сшивающих белков, узнающих высококонсервативные последовательности, фланкирующие соответствующие кодирующие последовательности.
Транскрипционный контроль
В гл. 39 дано определение промотора как такого участка последовательности гена, с которым должна связываться РНК-полимераза, чтобы начать транскрипцию с соответствующего сайта. Промоторные последовательности точно определяют, где РНК-полимераза начнет транскрипцию. Решение вопроса о том, котла (или как часто) такая транскрипция должна происходить, представляет собой более сложную и значительно менее понятную проблему. Как показано в гл. 39, два отдельных фрагмента ДНК в комплексе со специфическими связывающимися белками определяют именно эти «где» и «когда». В предельном случае, когда транскрипция находится на нулевом уровне, вопросы «где» и «когда» не имеют особого смысла, поскольку транскрипция не начинается вовсе. Поэтому сигнал типа «где» является потенциальным сигналом, не имеющим смысла в том случае, если сигнал «когда» принимает значение «не сейчас». Как показано в гл. 38, в хроматине ядра можно выделить как достаточно обширные транскрипционно-неактивные области (конститутивно или факультативно), так и области потенциальноактивного хроматина. Кроме того, как отмечалось в гл. 38, метилирование дезоксицитидиновых остатков ДНК может приводить к значительным изменениям хроматина, препятствующим его транскрипции. Например, в клетках печени мыши экспрессируются только неметилированные рибосомные гены. Ряд данных указывает на то, что при метилировании ДНК вирусов животных она утрачивает транскрипционную активность. Однако из всего сказанного нельзя делать выводов общего характера о том, что вся метилированная ДНК транскрипционно-неактивна, или, что весь неактивный хроматин метилирован, или, что транскрипционноактивная ДНК обязательно не метилирована.
Роль энхансеров
В дополнение к крупным изменениям структуры хроматина, влияющим на транскрипционную активность, в молекуле ДНК существуют специфические сигналы-усилители, способствующие повышению эффективности транскрипции. Например, у вируса обезьян SV40 промотору ранних генов предшествуют (на расстоянии около 200 пар оснований) две идентичные тандемные последовательности длинной 72 пары оснований, способные значительно усиливать экспрессию генов in vivo. Эти так называемые энхансерные элементы (от англ. to enhance — усиливать) отличаются от промоторов двумя основными чертами. Они могут влиять на транскрипцию генов, даже будучи удалены от промоторов на тысячи пар оснований, и второе — их усиливающий эффект не зависит от ориентации. Действие энхансеров имеет неспецифический характер — они могут усиливать транскрипцию с любых доступных промоторов. Так, введение энхансерного элемента вируса SV40 в плазмиду, несущую клонированный ген ß-глобина, может привести к 200-кратному усилению транскрипции этого гена. Энхансерный элемент, судя по всему, не кодирует какого-либо специфического эффектора, непосредственно воздействующего на промотор, поскольку его действие проявляется только по отношению к промоторам, находящимся на той же молекуле ДНК, что и сам энхансер (цис-эффект). В настоящее время уже выделены белки, связывающиеся с энхансерами. Изучение их функций, вероятно, поможет понять механизм действия этих регуляторных элементов. Энхансеры придают тем областям ДНК, где они расположены, гиперчувствительность к действию нуклеаз (см. гл. 38).
Уже выявлено много генов, обладающих энхансерами, расположенными самым различным образом относительно кодирующих участков. В дополнение к простому усилению транскрипции некоторые энхансерные элементы обладают тканевой специфичностью. Так, энхансер, расположенный между J- и С-областями генов иммуноглобулинов, усиливает экспрессию этих генов преимущественно в лимфоидных клетках. Энхансерные элементы генов панкреатических ферментов способны избирательно усиливать экспрессию сцепленных с ними чужеродных генов в клетках поджелудочной железы мыши (введенных в составе генно-инженерной конструкции на стадии одноклеточного эмбриона методом микрохирургии). Таким образом, тканеспецифичная экспрессия генов может быть опосредована действием энхансеров или энхансероподобных элементов.
Другие регуляторные элементы
С помощью лигирования определенных областей ДНК. несущих предполагаемые регуляторные последовательности, с различными репортерными генами (метод слияния или конструирования химерных генов, рассмотренный в гл. 36) можно определить, какой именно из участков ДНК, расположенных вблизи структурного гена, оказывает влияние на его экспрессию. Во многих случаях было показано, что последовательности, расположенные в 5'-области по отношению к старту транскрипции, оказывают весьма существенное влияние на частоту инициации транскрипции. Рассмотрим в качестве примера металлотионеин — белок, связывающий тяжелые металлы и содержащий много остатков цистеина, который присутствует в большинстве органов млекопитающих. Если организм или культивируемая клеточная линия подвергаются обработке ионами металлов, таких, как цинк или кадмий, то наблюдается усиление транскрипции металлотионеинового гена и соответствующее повышение уровня белка метал- лотионеина, способного связывать потенциально токсичные ионы. С использованием методов генной инженерии стало возможным выделение области ДНК размером в несколько сот пар оснований, расположенной вблизи сайта инициации транскрипции гена металлотионеина. К этому металлотионеиновому регуляторному элементу можно присоединить другой структурный ген, например ген тимидинкиназы. Полученную химерную конструкцию можно ввести в культивируемые клетки, при этом в некой небольшой доли клеток реализуется встраивание чужеродной ДНК в геном. При обработке трансформированных таким образом клеток ионами тяжелых металлов наблюдается индукция тимидинкиназы с металлотионенинового промотора. Используя все более короткие участки исследуемой ДНК, можно точно определить положение искомого регуляторного элемента. Недавно подобный эксперимент был проведен на мышах. Металлотионеиновый промотор присоединяли к структурным генам тимидинкиназы или гормона роста. Генно-инженерные конструкции были введены в пронуклеус одноклеточного эмбриона самца, а эмбрион в свою очередь был введен в матку мыши для последующего развития. Мыши из полученного таким образом потомства отвечали на присутствие цинка в питьевой воде усилением экспрессии тимидинкиназы или гормона роста. В последнем случае трансгенные животные достигали вдвое большего размера, чем контрольные нормальные особи.
Глюкокортикоиды — это класс стероидных гормонов, регулирующих экспрессию генов (см. гл. 44). При попадании молекул глюкокортикоидов в клетку млекопитающих они связываются со стероид-специфичным рецептором, который претерпевает при этом конформационные изменения в цитоплазме и проникает в ядро. Комплекс глюкокортикоид— рецептор взаимодействует со специфическим рецептор-связывающим сайтом ДНК в 5'-регуляторной области стероид-зависимых генов, например гена вируса рака молочной железы мыши, на расстоянии в несколько сот пар оснований от сайта инициации транскрипции. Посадка комплекса на рецептор-связывающий сайт, судя по всему, приводит к более эффективному использованию промотора РНК-полимеразой, усиливая таким образом экспрессию стероид-зависимых генов. Область ДНК, связывающаяся с гормон-рецепторным комплексом, также может быть клонирована и присоединена к другому структурному гену. После встраивания таких химерных конструкций в геном культивируемых клеток млекопитающих репортерные структурные гены приобретают способность контролироваться содержанием глюкокортикоидов в среде, т.е. становятся стероид-индуцибельными генами. Постепенно укорачивая нуклеазной обработкой концы клонируемого фрагмента и вводя в него мутации, можно идентифицировать районы ДНК, которые непосредственно участвуют в связывании с гормон-рецепторным комплексом. Создается впечатление, что связывание гормон-рецепторного комплекса с определенным участком ДНК превращает его в активный энхансерный элемент. В ближайшем будущем мы, вероятно, сможем разобраться в молекулярном механизме точной регуляции экспрессии эукариотических генов, в частности на примере стероид-зависимых генов.
Процессинг РНК как механизм регуляции экспрессии
Помимо регуляции экспрессии генов путем воздействия на эффективность использования промотора эукариотические клетки обладают дополнительным механизмом контроля экспрессии генов, основанным на альтернативном процессинге РНК. Существуют два общих типа контроля процессинга РНК: первый тип контроля основан на принятии решения о том, какие именно из первичных транскриптов вообще подлежат процессингу. Второй тип — дифференциальный процессинг. В отношении первого механизма очевидно, что первичные транскрипты, содержащие интроны, прежде, чем попасть в цитоплазму в виде зрелых экспрессирующихся мРНК, должны обязательно подвергнуться сплайсингу, в ходе которого происходит удаление интронов. В ядре содержится значительно больший набор первичных транскриптов, чем соответствующих мРНК в цитоплазме. Таким образом, на каком-то уровне обязательно должно приниматься решение о том, какие транскрипты подлежат, а какие не подлежат процессингу. Что касается выбора первичных транскриптов, подлежащих процессингу, то механизм этого процесса неизвестен так же, как нет и прямого доказательства того, что выбор этот может меняться в ходе развития или в ответ на факторы окружающей среды.
Прямое доказательство дифференциального процессинга первичных транскриптов получено при изучении регуляции синтеза иммуноглобулинов.
Дифференциальный процессинг РНК
Выше уже говорилось о том, что первым иммуноглобулином, синтезирующимся при дифференцировке В-клеток, является IgM. Однако на самых ранних стадиях развития В-клеток IgM при секреции не проходит полностью через клеточную мембрану. С-концевая область μ-цепи, подобно мембранным белкам, остается встроенной в мембрану (см. гл. 42). μ-Цепь нормально секретируемого IgM обозначают μs, а μ-цепь IgM, остающегося связанным с мембраной, — μm. Аминокислотные последовательности μ5- и μm-цепей единичной В-клетки или клеточной линии идентичны вплоть до домена Сμ4 С-концевой области (см. рис. 55.3). Вслед за доменом Сμ4 в цепи μs расположен гидрофильный 20-звенный сегмент, в то время как С-конец μm-цепи содержит гидрофобный 38-звенный сегмент, заканчивающийся последовательностью -Lys-Val-Lys. Этот гидрофобный сегмент вплоть до первого заряженного остатка Lys может встраиваться в двуслойную клеточную мембрану. Очевидно, что μs- и μm-цепи должны быть транскрибированы с различных молекул мРНК.
Такие различные молекулы мРНК были выделены, их нуклеотидные последовательности удалось определить по последовательности полученных с них кДНК-копий. Выяснилось, что μm-мРНК состоит из 2700 оснований, а μs-мРНК из 2400 оснований. Анализ нуклеотидной последовательности клонированного геномного участка, кодирующего молекулы μ-мРНК, показал, что оба вида μ-мРНК образуются из общего транскрипта-предшественника в результате альтернативного процессинга РНК в ядре. На рис. 41.15 представлены два возможных пути сплайсинга для образования μs- и μm-мРНК молекул, транскрибированных с единичного μ-гена.
Общий мРНК-предшественник содержит два потенциальных сайта полиаденилирования (см. гл. 39): один — между экзонами Сμ4 и М и второй — со стороны 3'-конца от экзона М. В зависимости от того, какой из двух возможных сайтов полиаденилирования подвергается эндонуклеазной атаке в ходе подготовки к полиаденилированию, образуется тот или иной из двух типов μ-мРНК (μm- или μs-) тяжелых цепей с различными 3'-концами. Возможно, что именно выбор сайта полиаденилирования и определяет один из двух альтернативных вариантов сплайсинга экзонов первичного транскрипта.
Стабильность мРНК
Стабильность молекул матричной РНК в цитоплазме представляет собой фактор, изменение котоporo может влиять как положительно, так и отрицательно на уровень экспрессии данного гена. Стабилизация мРНК при фиксированной скорости транскрипции будет приводить к ее накоплению, и наоборот. О механизмах, вовлеченных в систему деградации мРНК, известно немного, и все же можно привести несколько описанных примеров контроля этого процесса. Эстрадиол продлевает время полужизни мРНК вителлогенина с нескольких до более чем 200 часов. Кроме того, известно, что эстрогены усиливают транскрипцию данного гена в 4—6 раз. Все это вместе приводит к значительному накоплению вителлогениновоймРНК. Время полужизни мРНК основного молочного белка — казеина — также значительно увеличивается при инкубации клеток молочной железы с гормоном пролактином.
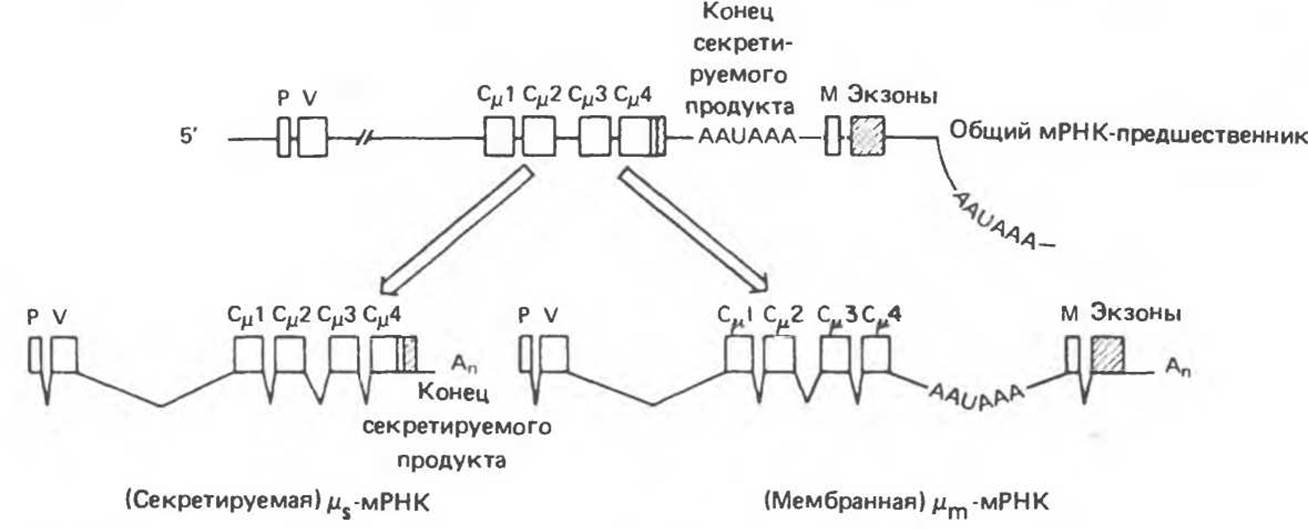
Рис. 41.15. Предполагаемый путь альтернативного сплайсинга μs- и μm-мРНК. На 5'-концах обеих молекул находится последовательность Сμ4. Пустыми квадратами обозначены экзоны. 3'-Нетранслируемыe последовательности заштрихованы. Р — экзон сигнального пептида, V — перестроенный VH-экзон. Ломаными линиями обозначен путь сплайсинга. Аn — альтернативные сайты полиаденилирования (AAUAA) в транскриптах. (Reproduced, with permission, from Early et al. Two mRNAs can be produced from single immunoglobulin μ-gene by alternative RNA processing pathways. Cell 1980, 20, 313.)
Таблица 41.2. Частоты встречаемости различных типов контроля (с разрешения Darnell J. Е. Variety in the level of gene control in eukariotic cells. Nature 1982, 297, 359 Copyright 1982 by Macmillan Journals Ltd).
|
Доказанные или строго обоснованные примеры |
Возможные |
|
|
Ядро Транскрипция: Инициация |
Множество (>100) |
|
|
Терминация Преждевременная остановка считывания (аттенуация) |
1 |
+ |
|
Процессинг РНК Полиаденилирование Альтернативный сплайсинг |
∼3 1 |
|
|
Цитоплазма Стабильность мРНК |
~ 5 конкретных и множество общего характера |
|
|
Эффективность трансляции мРНК |
~ 10 конкретных и множество общего характера |
Предполагается, что количество примеров будет расти для тех вариантов контроля, которые пока представлены лишь одним или несколькими примерами. На сегодняшний день бессмысленно даже предполагать, каковы же истинные частоты использования различных типов контроля экспрессии генов.
Дифференциальная трансляция мРНК
Известны примеры определенных организмов или культивируемых клеточных линий, способных к дифференциальной трансляции зрелых мРНК, эффективность трансляции которых не удается достаточно четко различить in vitro. Это предполагает существование неких факторов, способных распознавать специфические зрелые молекулы мРНК и избирательно изменять скорость их трансляции по сравнению с другими молекулами мРНК.
В табл. 41.2 сравнивается частота различных типов контроля экспрессии эукариотических генов.
Литература
Compere S. J., Palmiter R. D. DNA methylation controls the in- ducibility of the mouse metallothioncin-I gene in lymphoid cells, Cell, 1981, 25, 233.
Darnell J. E. Variety in the level of gene control in eukaryotic cells, Nature, 1982, 297, 365.
Jacob F., Monod J. Genetic regulatory mechanisms in protein synthesis, J. Mol. Biol., 1961, 3, 318.
McKnight S., Tjian R. Transcriptional selectivity of viral genes in mammalian cells, Cell, 1986, 46, 795.
Ptashne M., Johnson A.D., Pabo C.O. A genetic switch in a bacterial virus. Sci. Am. (Nov.), 1982, 247, 128.
Shimizu A., Honjo T. Immunoglobulin class switching, Cell, 1984, 36, 801.
Swift G. H. et at. Tissue-specific expression of the rat pancreatic elastase I gene in transgenic mice. Cell, 1984, 38, 639.
Wu R., Bald C. R., Narang S. A. Lactose operator-repressor interaction, Curr. Top. Cell. Regul., 1978, 13, 137.
Yamamoto K. Steroid receptor regulated transcription of specific gene and gene networks. Annu. Rev. Genet., 1985, 19, 209.
Yanofsky C. Attenuation in the control of expression of bacterial operons, Nature, 1981, 289, 751.