Биохимия человека Том 2 - Марри Р. 1993
Биохимия внутри- и межклеточных коммуникаций
Мембраны: структура, сборка и функции
Сборка мембран
Как мы уже говорили, ферменты, ответственные за синтез фосфолипидов, располагаются на цитоплазматической стороне везикул эндоплазматического ретикулума. По мере синтеза фосфолипидов происходит их самосборка с образованием термодинамически стабильных бимолекулярных слоев, которые включаются в мембрану везикул. Липидные везикулы, происходящие от эндоплазматического ретикулума, по-видимому, перемещаются к аппарату Гольджи, фрагменты которого в свою очередь сливаются с плазматической мембраной. Мембраны аппарата Гольджи и везикул эндоплазматического ретикулума асимметричны в поперечном направлении как по фосфолипидам, так и по белкам, и эта асимметрия сохраняется до слияния с плазматической мембраной. Внутренняя поверхность везикулярных мембран оказывается с наружной стороны плазматической мембраны, а цитоплазматическая остается на ее цитоплазматической стороне (рис. 42.10). Поскольку поперечная асимметрия в мембранах везикул, происходящих из эндоплазматического ретикулума, существует еще до слияния с плазматической мембраной, основной проблемой сборки мембран становится вопрос о том, каким образом интегральные белки асимметрично включаются в липидный бислой эндоплазматического ретикулума.
Интегральные и секретируемые белки сразу после их синтеза содержат гидрофобную лидерную последовательность длиной 15—30 аминокислот на N-конце. Внутренней гидрофобная лидерная последовательность бывает очень редко. N-концевая лидерная последовательность обычно отщепляется от белка при его встраивании в мембрану или сразу после него, при этом получается зрелый секретируемый или интегральный белок.
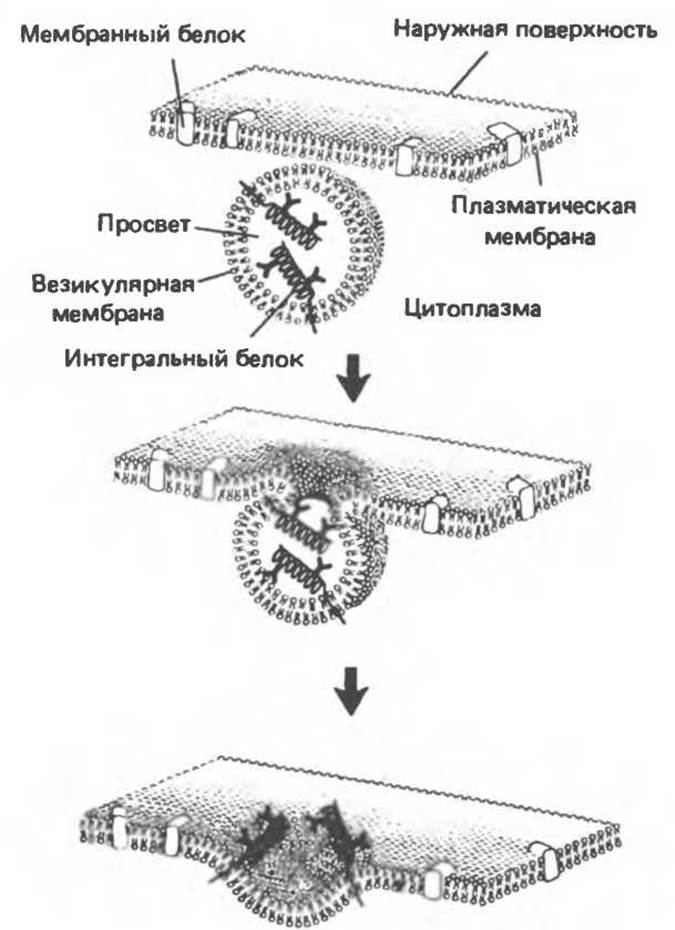
Рис. 42.10. При слиянии везикул с плазматической мембраной сохраняется ориентация всех интегральных белков, включенных в бислой везикулы. Исходно N-конец белка смотрит внутрь везикулы. После слияния N-конец оказывается на наружной поверхности плазматической мембраны. Неизменность ориентации белка становится еще более очевидной, если проследить за расположением другого конца молекулы С-конца, который всегда обращен в цитоплазму. Внутренняя поверхность везикулы и наружная — клетки топологически эквивалентны. (Из работы Ladish Н. F., Rothman J. Е.: The assembly of cell membranes. Sсi. Am. [Jan.] 1979, 240, 43, с изменениями.)
Существуют убедительные данные о том, что лидерная последовательность участвует в процессе встраивания белка. Мутантные белки, содержащие модифицированную лидерную последовательность, в которой какая-либо гидрофобная аминокислота заменена на гидрофильную, не включаются в мембраны. В то же время немембранные белки с присоединенной к ним лидерной последовательностью (для этого используются методы генной инженерии) способны включаться в мембрану и даже секретироваться.
Сигнальная гипотеза
Белки встраиваются в мембрану разными способами (рис. 42.11); детали этого процесса во многих случаях еще не установлены. Для объяснения механизма встраивания предложены две модели: сигнальная гипотеза и мембранная триггерная гипотеза. В сигнальной гипотезе предполагается, что белок включается в мембрану параллельно его трансляции на мРНК в полирибосомах; это так называемое котрансляционное включение. Когда лидерная последовательность выходит из рибосомы, она выявляется некой сигнал-распознающей частицей (СРЧ), которая блокирует дальнейшую трансляцию на уровне примерно 70 аминокислот, 40 из которых остаются в большом рибосомном комплексе, а 30 экспонированы в среду (рис. 42.12). СРЧ содержит шесть белков, с ней ассоциирована 7S-PHK, близкородственная «Alu-семейству» последовательностей ДНК с большим числом повторов (см. гл. 38). Блокирование трансляции не снимается до тех пор, пока комплекс СРЧ-лидерная последовательность — рибосома не свяжется с так называемым «отстригающим» белком (рецептором для СРЧ) эндоплазматического ретикулума. В этот момент начинается котрансляционное встраивание белка в эндоплазматический ретикулум. В процессе элонгации оставшейся части белка он перемещается через липидный бислой, поскольку рибосома остается присоединенной к эндоплазматическому ретикулуму. Таким образом образуется шероховатый (усеянный рибосомами) эндоплазматический ретикулум. Рибосомы остаются прикрепленными к эндоплазматическому ретикулуму в течение всего времени синтеза мембранного белка и освобождаются и диссоциируют на соответствующие субъединицы только после его завершения. Когда ранее синтезированная часть белка выходит в просвет эндоплазматического ретикулума, отщепляется лидерная последовательность и присоединяются углеводы.
Интегральные мембранные белки не пересекают мембрану целиком; по-видимому, этому препятствует гидрофильная якорная последовательность на С-конце. Секретируемые же белки проходят сквозь мембранный бислой полностью и высвобождаются в просвет эндоплазматического ретикулума. К моменту их поступления внутрь везикулы углеводные остатки уже оказываются связанными с ними. Впоследствии секретируемые белки обнаруживаются в просвете аппарата Гольджи, где происходит модификация их углеводных цепочек, а затем они перемещаются к специфическим внутриклеточным органеллам или клеточным мембранам либо секретируются. Некоторые белки пересекают одну мембрану, а затем заякориваются в другой, соседней мембране, например внутренней мембране митохондрий.
Мембранная триггерная гипотеза
В этой гипотезе особое значение придается роли лидерной последовательности в изменении третичной структуры самого белка. Согласно этой гипотезе, лидерная последовательность индуцирует такую упаковку обычно гидрофобного интегрального белка, что последний может оставаться солюбилизированным в водной среде цитоплазмы, где он синтезирован. Мембранный липидный бислой является как бы триггером по отношению к третичной структуре белка — последний переходит в такую конформацию, которая обеспечивает его предпочтительное включение в бислой. Таким образом, белок претерпевает некий переход и сам встраивается в мембрану таким способом, чтобы установить необходимую поперечную асимметрию. Сразу после встраивания белка или его интеграции лидерная последовательность отщепляется. Триггерная гипотеза не предполагает специфического взаимодействия между рибосомой и мембраной, но это еще не означает, что синтез белка не может происходить на мембранах.
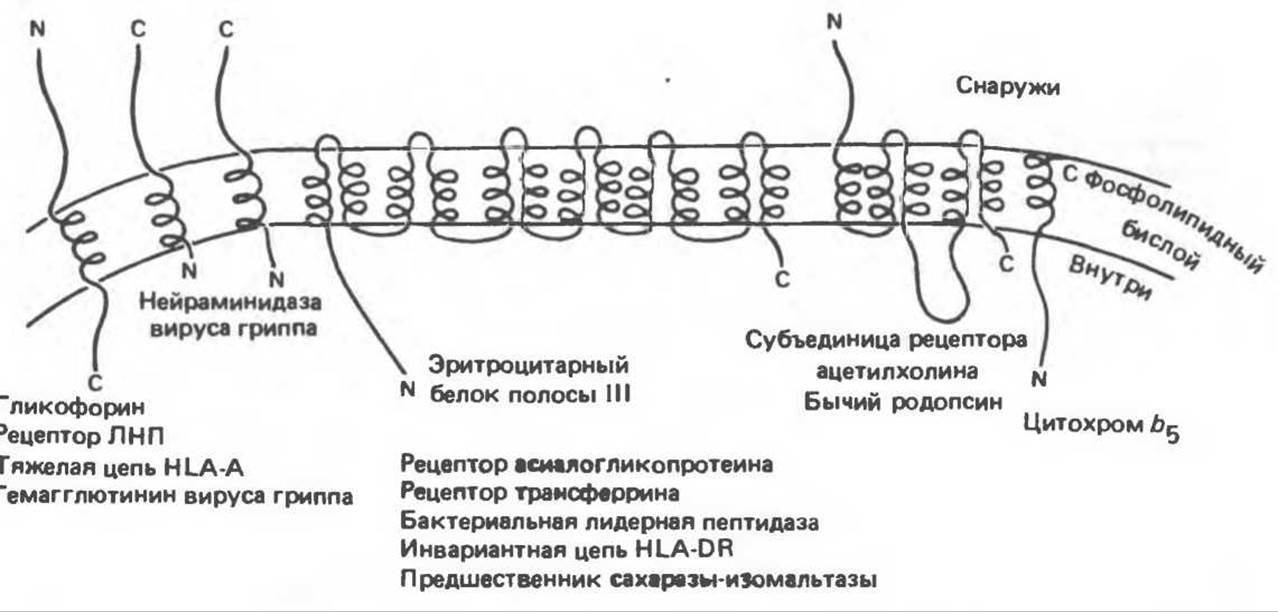
Рис. 42.11. Различные способы включения белков в мембраны. Те участки белковой молекулы, которые находятся внутри мембраны, имеют форму а-спиралей, а остальные фрагменты линейны. N—NН2-конец; С- СООН-конец. (Из работы Wickner W. Т, Lodish Н. F.: Multiple mechanisms of protein insertion into and across membranes. Science, 1985, 230. 400, с разрешения.)
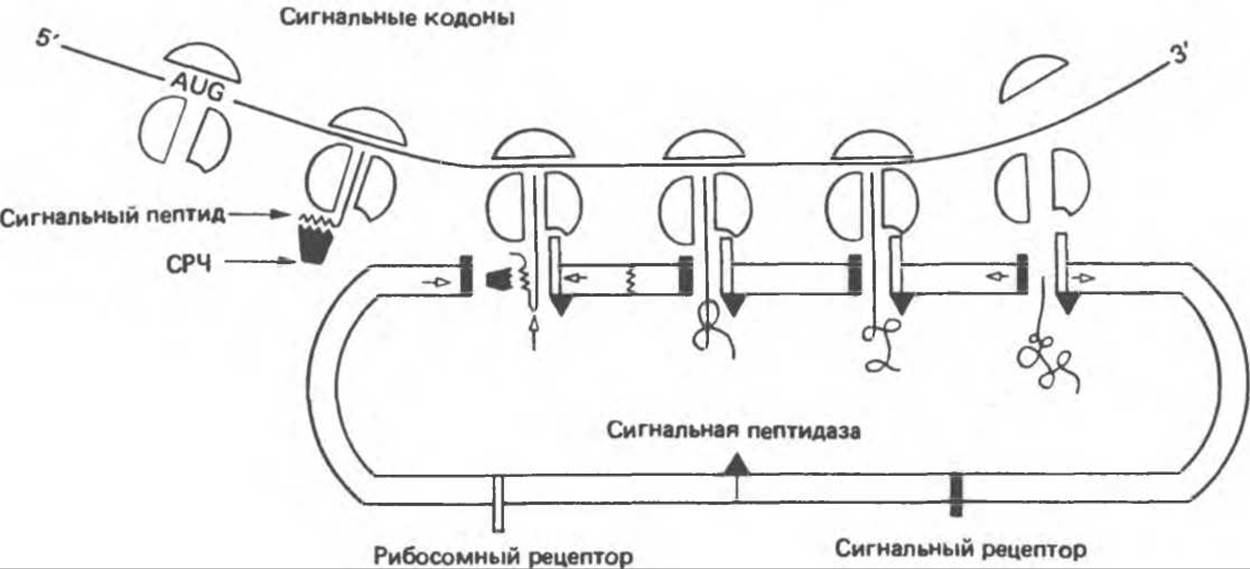
Рис. 42. 12. Транспорт секретируемых белков через мембрану эндоплазматического ретикулума согласно сигнальной гипотезе. Синтезирующие белок рибосомы движутся вдоль мРНК, детерминирующей аминокислотную последовательность белка (мРНК изображена в виде линии 5'—3’). Кодон AUG — начало синтеза белка; участок линии, который следует за AUG, соответствует кодонам сигнальной последовательности. Когда конец белковой молекулы выходит из большой рибосомной субчастицы, сигнальная последовательность оказывается экспонированной в среду и связывается с сигнал-распознающей частицей (СРЧ). Дальнейшая транскрипция блокируется до тех пор, пока комплекс не свяжется с «отстригающим» белком (черный прямоугольник), расположенным на мембране эндоплазматического ретикулума. Для самой рибосомы на мембране также имеется рецептор (светлый прямоугольник). Взаимодействие рибосомы и растущей пептидной цепи с мембраной эндоплазматического ретикулума приводит к открыванию поры, через которую белок вводится во внутреннее пространство эндоплазматического ретикулума. В процессе транспорта сигнальная последовательность большинства белков отщепляется ферментом, называемым сигнальной пептидазой. Синтезированный белок высвобождается из рибосомы, которая распадается на большую и малую субчастицы, и. наконец, оказывается внутри эндоплазматического ретикулума (Из работы Newly made proteins rip through the cell, Science, 1980, 207, 154, с изменениями.)
Основные особенности сигнальной и триггерной гипотез сопоставляются в табл. 42.3. Возможно, в одной и той же клетке действуют оба механизма. Некоторые аспекты мембранного биосинтеза остаются неясными, поскольку одни мембранные и секретируемые белки синтезируются на мембраносвязанных полисомах, тогда как другие — на свободных цитоплазматических полисомах. Сборка некоторых секретируемых или встраиваемых в мембрану белков не осуществляется до тех пор, пока эти белки не вступают во взаимодействие с мембранным бислоем на ранних этапах своего биосинтеза на рибосомах. Другие белки, например цитохром b5, встраиваются сами, сохраняя определенную ориентацию в мембране после того, как их синтез завершен, но все же их внедрение в мембрану требует присутствия нормальной лидерной последовательности. Некоторые одноцепочечные пептиды или белки, такие, как бактериородопсин, пересекают мембрану несколько раз, и этот феномен трудно объяснить в рамках сигнальной гипотезы.