Биохимия аминокислот - А. Майстер 1961
Промежуточный обмен аминокислот
Треонин
Превращения треонина
Пути распада треонина изучали у животных и микроорганизмов. У крыс процесс распада треонина, по-видимому, необратим; треонин не принимает участия в общем кругообороте азота аминокислот в организме млекопитающего. Так, при введении крысам N15-аминокислот не наблюдали появления метки в треонине [255, 256]. Имеющиеся данные свидетельствуют о наличии двух путей распада треонина. Один из них сходен с реакцией дегидратирования и дезаминирования серина (стр. 331) и, возможно, катализируется тем же ферментом:
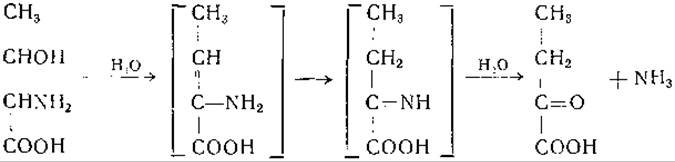
1 В настоящее время известно, что в процессе этого превращения гомосерин сперва фосфорилируется (за счет АТФ) с образованием О-фосфогомосерина; это соединение под действием пиридоксалевого фермента, треонин-синтетазы, переходит в треонин в результате отщепления молекулы фосфорной кислоты и последующего присоединения молекулы воды. — Прим. ред.
С этим механизмом согласуются данные о том, что в препаратах печени крысы DL-треонин, меченный N15 и С14, превращается в L-a-аминомасляную кислоту [257]. Вероятно, из треонина образуется a-кетомасляная кислота, которая в результате стереоспецифической реакции переаминирования превращается в L-a-аминомасляную кислоту. К этому же продукту может привести и окислительное дезаминирование D-треонина.
Другой путь распада треонина открыли Браунштейн и Виленкина. Эти авторы наблюдали -образование глицина и ацетальдегида из треонина в препаратах печени и почек различных животных [258]:
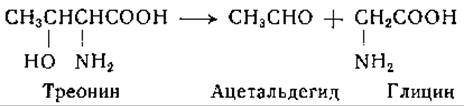
Любопытно, что в этой системе алло-треонин является более активным субстратом, чем треонин [185, 258, 259]. По-видимому, ферментативная реакция в слабой степени обратима, однако стерическая конфигурация продукта, образующегося при обратной реакции, не установлена [261]. Для фермента, катализирующего расщепление треонина на глицин и ацетальдегид, были предложены названия «глициногеназа» [258] и «альдолаза оксиаминокислот» [262]. Механизм реакции расщепления треонина изучали Снелл и сотрудники [260, 263]; они описали неферментативное обратимое расщепление треонина в присутствии пиридоксаля и солей металлов [260, 263]. Оказалось, что при ферментативной реакции коферментом является пиридоксальфосфат [238]1.
Описано ферментативное расщепление изомеров ß-фенилсерина очищенной белковой фракцией печени крысы [264]. Эритро-L-изомер расщепляется в 9 раз быстрее, чем трео-изомер, и в 7 раз быстрее, чем алло-треонин. Продуктами ферментативного расщепления эритро-β-фенил-L-серина являются бензальдегид и глицин. Интересно, что Кнооп [265] еще в 1914 г. наблюдал при скармливании собакам ß-фенилсерина повышенное выделение гиппуровой кислоты с мочой. Кнооп предполагал, что ß-фенилсерин расщепляется на глицин и бензойную кислоту.
В опытах на крысах с применением треонина, меченного N15 и С14 в метальной группе, было найдено, что примерно от 1/5 до 1/3 треонина, введенного с пищей, расщепляется на глицин и уксусную кислоту [256]. Последняя, очевидно, образуется путем окисления ацетальдегида. В той же работе отмечено, что после введения N15-лейцина в треонин переходит лишь незначительное количество N15, что согласуется с данными более ранних исследований. Однако тот факт, что некоторое количество азота лейцина все же было обнаружено в молекуле треонина, указывает на наличие в организме животного незначительного синтеза треонина или на частичную обратимость реакций его расщепления. Возможно, однако, что отмеченное включение изотопного азота в треонин обусловлено действием микрофлоры кишечника.
1 Участие пиридоксальфосфата в ферментативном расщеплении треонина на глицин и ацетальдегид было установлено в 1953 г. Браунштейном и Виленкиной (Усп. соврем, биол., 36, 275, 1953).—Прим. ред.
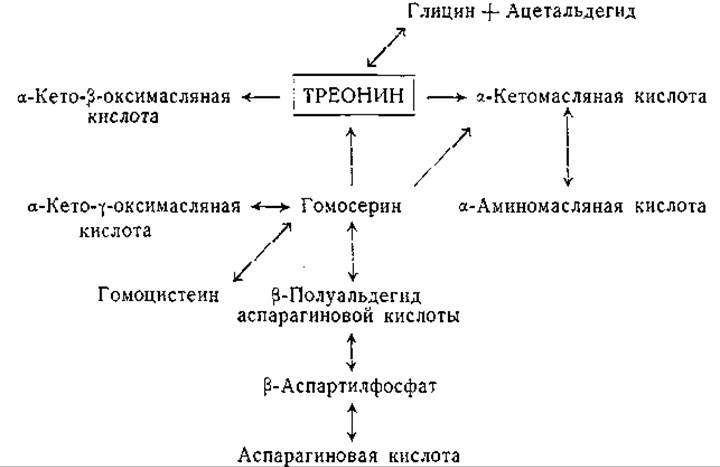
Фиг. 11. Сводная схема превращений треонина.
Данных, доказывающих, что в организме млекопитающих возможно образование треонина из гомосерина, не имеется. В связи с этим интересно отметить, что в опытах с препаратами печени было установлено образование соответствующей гомосерину кетокислоты (а-кето-y-оксимасляной кислоты) из пировиноградной кислоты и формальдегида [266]:
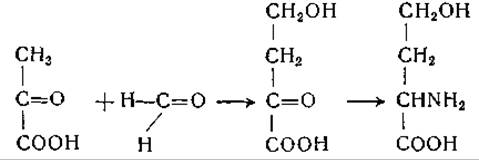
Обнаружено также переаминирование этой кетокислоты [267].