Биохимия аминокислот - А. Майстер 1961
Промежуточный обмен аминокислот
Гистидин
Биосинтез
Многие экспериментальные животные нуждаются для роста и обеспечения азотистого равновесия в введении гистидина с пищей (табл. 10). Однако имеются данные, показывающие, что у молодых здоровых людей азотистое равновесие может сохраняться и при диете, не содержащей гистидина. Эти данные указывают на возможность синтеза гистидина в тканях человека, но их можно толковать и иначе, например предположить, что гистидин синтезируется при участии микрофлоры кишечника или образуется при распаде гемоглобина (стр. 124). Данные, относящиеся к синтезу гистидина у человека, немногочисленны. У крысы возможно обеспечение роста при такой диете, в которой L-гистидин заменен его а-кето- или а-окси-аналогом или D-гистидином [626—629]. Интересно, что у мыши D-гистидин и имидазолмолочная кислота оказались активными лишь при наличии в рационе небольших количеств L-гистидина [630].
Все сведения о биосинтезе гистидина почерпнуты из опытов на микроорганизмах. Броквист и Снелл [631] нашли, что различные бактерии могут превращать ß-имидазолпировиноградную кислоту в гистидин при наличии в среде пиридоксальфосфата. По данным этих авторов, Lactobacillus arabinosus проявляет потребность в гистидине только в отсутствие витамина В6. Эти данные показывают, что имидазолпировиноградная кислота является предшественником гистидина, но в настоящее время при истолковании этих наблюдений следует учитывать и другие возможности. Взаимная связь между пуринами и гистидином, отмеченная в ранних исследованиях, теперь выяснена, по крайней мере частично, в результате изотопных исследований; они показали, что атом С-2 имидазольного ядра имеет источником муравьиную кислоту. Последняя может возникать в процессе обмена пуринов [632, 633] (ср., однако, [481, 482]).
Эймс и сотрудники [634—637, 1120], используя мутантные штаммы Neurospora, получили существенные данные по вопросу о происхождении углеродной цепи гистидина. Эти авторы выделили из культур грибов имидазолглицерин, имидазолацетол и L-гистидинол, а также фосфорные эфиры этих соединений. На основании химических и генетических соображений они предложили следующую схему биосинтеза гистидина:
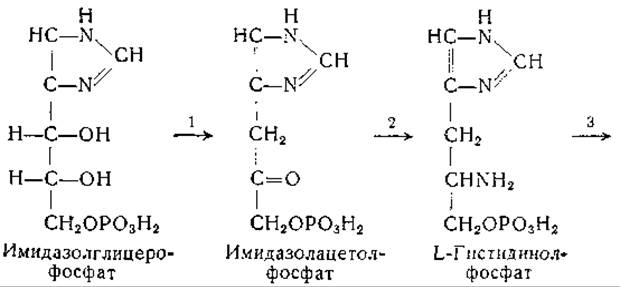
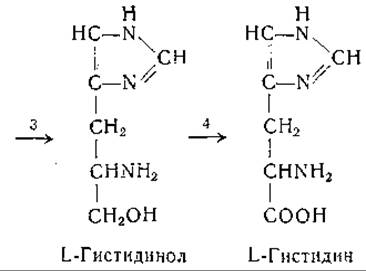
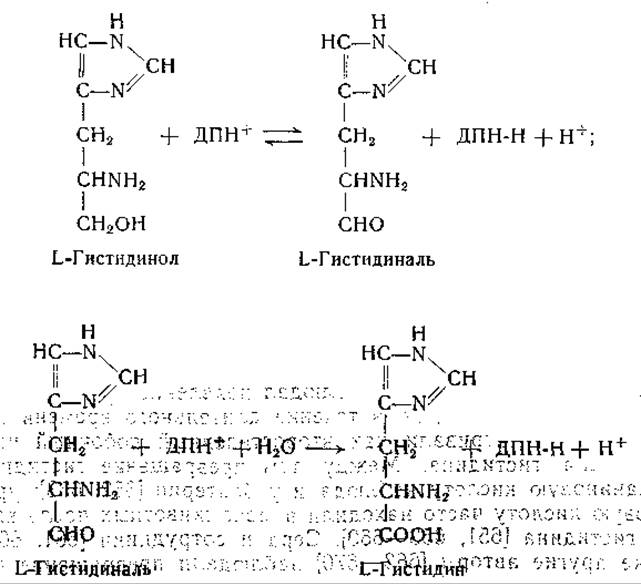
Еще до этого Фогель и. сотрудники выделили L-гистидинол из культур мутанта Escherichia coli, нуждающегося в гистидине [638]. Адамс изучил ферментативное превращение гистидинола в гистидин; для этой реакции необходимо присутствие дифосфопиридиннуклеотида [639—641]. Промежуточным звеном в этом превращении является образование гистидиналя [641]:
Превращение имидазолацетолфосфата в гистидинолфосфат происходит путем реакции переаминирования. Фермент, катализирующий эту реакцию, получен в очищенном виде; показано, что он действует при участии пиридоксальфосфата (стр. 232).
Происхождение пятичленной углеродной цепи гистидина в точности не известно. Оказалось, что глутаминовая и уксусная кислоты в этом процессе не являются промежуточными соединениями [642]; возможными источниками углерода гистидина можно считать производные пентоз или гексоз. Установлено, что у Е. coli в синтезе гистидина участвует амидный азот глутамина. Амидная группа глутамина оказалась более эффективным источником атома N-1 молекулы гистидина, чем азот глутаминовой кислоты, аспарагина или ионов аммония [1121].
Недавно найдено, что механизмы биосинтеза гистидина у Е. coli и у Neurospora сходны. В обоих организмах путь биосинтеза гистидина включает образование имидазолацетола и L-гистидинола, причем образование пятичленной углеродной цепи гистидина предшествует синтезу имидазольного кольца [643].