Биохимия аминокислот - А. Майстер 1961
Промежуточный обмен аминокислот
Триптофан
Превращение триптофана в кинуренин и в никотиновую кислоту
Кинуренин был открыт Матсуока и Иосиматсу в моче кроликов, которым скармливали большие количества триптофана [732]. В настоящее время известно, что кинуренин может превращаться в кинуреновую кислоту (она фактически была открыта раньше кинуренина [733—735]), ксантуреновую кислоту, никотиновую кислоту и в некоторые пигменты. Эти превращения триптофана установлены в результате опытов по биохимии питания, изотопных и энзимологических исследований, а также опытов над мутантами микроорганизмов.
Нокс и Мелер [736] изучали превращение триптофана в кинуренин в опытах in vitro [736]. Они получили из печени крысы растворимую ферментную систему, катализирующую следующие реакции:
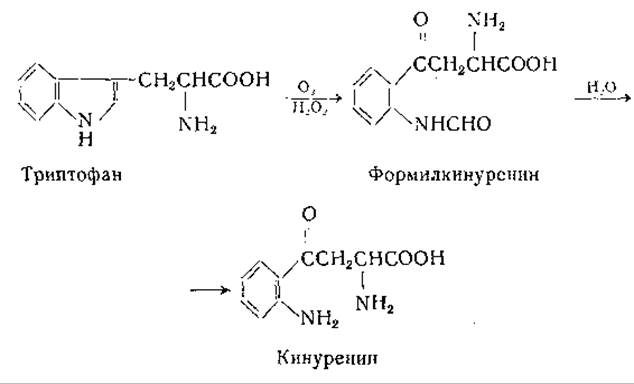
Окисление триптофана в формилкинуренин происходит с участием О2 и Н2О21; каталаза [737—739] тормозит этот процесс. Триптофанпероксидазная активность обнаружена также у бактерий [740]. Вторая из приведенных выше реакций представляет собой гидролиз формилкинуренина до кинуренина при участии фермента формилазы (кинуренинформамидазы); этот фермент найден в печени и у микроорганизмов [736—741].
Известно, что у млекопитающих триптофанпероксидаза подвержена адаптивным изменениям [742]. Так, введение крысам триптофана значительно повышает на несколько часов активность триптофанпероксидазы в печени, после чего активность снижается до нормального уровня2. Удаление надпочечников понижает активность этого фермента в печени крыс, а введение оперированным крысам кортизона вызывает повышение активности. Высказано предположение, что на активность фермента (вероятно, на синтез самого фермента) оказывают влияние гормональные факторы гипофиза и надпочечников [742—746].
1 Танака и Нокс [J. Biol. Chem., 234, 1163 (1959)] позднее установили, что в окислении триптофана в формилкинуренин участвует только O2; активирующее действие перекиси водорода объясняется тем, что она регенерирует активную ферро-форму железопорфириновой простетической группы фермента из неактивной ферри-формы; поскольку фермент не обладает пероксидазным действием, его следует обозначать наименованием «триптофанпирролаза», согласно предложению Котаке, впервые описавшего действие этого фермента в 1934 г.— Прим. ред.
2 Индуцированное образование «триптофанпероксидазы» наблюдается и в опытах со срезами печени in vitro при добавлении к инкубированным пробам триптофана; в отсутствие субстрата фермент в тканевых срезах и гомогенатах быстро инактивируется [743]. — Прим. ред.
Предполагают, что процесс окисления триптофана триптофанпероксидазой протекает с образованием промежуточного соединения, природа которого еще не известна. Установлено, что оксиндолаланин не является этим промежуточным соединением [747—749]:
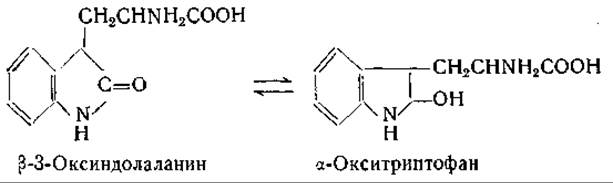
Рассматривались другие возможные промежуточные продукты в этом процессе [748, 750, 751]. Высказано предположение, что в реакции участвует тиамин [752].
В 1945 г. Крэль и сотрудники [753] нашли что крысы, получающие диету с недостаточным содержанием никотиновой кислоты, растут нормально, когда к их рациону добавляется триптофан. За этим последовал ряд работ, в которых было доказано превращение триптофана в никотиновую кислоту (см., например, [724, 725, 754—768, 787]). Представляют интерес ранние исследования Гольдбергера и Таннера [769] о целебном действии триптофана при заболевании пеллагрой. Весьма вероятно, что описанное Гольдбергером клиническое действие триптофана обусловлено превращением его в никотиновую кислоту. Превращение кинуренина в никотиновую кислоту было показано в многочисленных исследованиях с применением мутантов Neurospora [724, 725, 758, 759, 761—764, 766—768]. Ниже (см. стр. 400) приведены вероятные промежуточные этапы этого превращения.
Хайдельбергер и сотрудники [770, 771], используя меченые соединения, установили, что в организме крысы углеродный атом в положении 3 индольного ядра триптофана становится углеродным атомом карбоксила никотиновой кислоты. Эти авторы показали также, что при превращении триптофана в кинуренин в организме кролика и в кинуреновую кислоту в организме собаки ß-углеродный атом триптофана переходит в ß-углеродный атом кинуренина и в атом С-3 в молекуле кинуреновой кислоты. Боковая цепь триптофана не участвует в образовании молекулы никотиновой кислоты [770, 772]. В опытах на крысах и кроликах превращение триптофана в кинуренин, кинуреновую и ксантуреновую кислоты исследовали также при помощи триптофана, содержащего N15в пиррольном ядре [773]. В той же работе было показано, что у крысы азот ядра триптофана не переходит в гемин и что N15-индол в организме крысы не используется для синтеза триптофана.
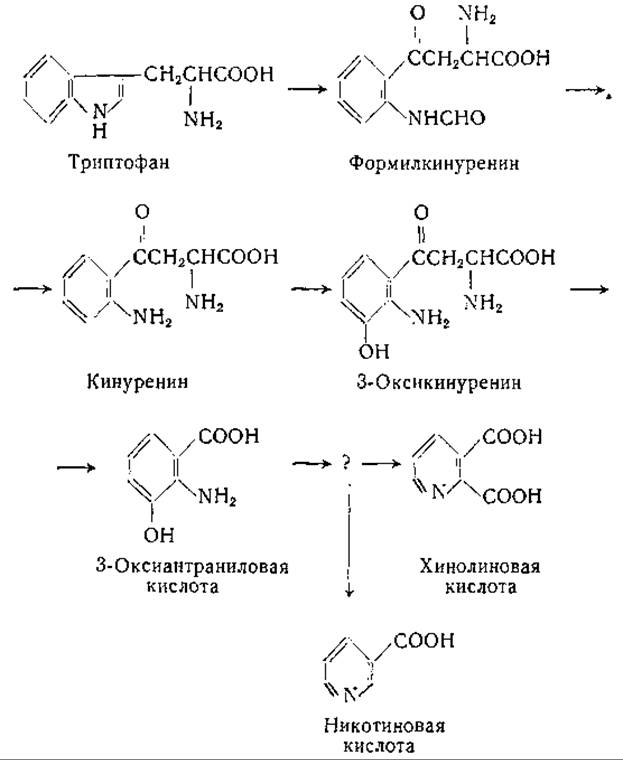
Кинуренин может окисляться в 3-оксикинуренин и превращаться в антраниловую и в кинуреновую кислоты. Механизм окисления кинуренина в 3-оксикинуренин еще точно не выяснен, однако можно считать доказанным само наличие этой реакции [774, 775] и вероятным — участие в ней рибофлавина [776—778].
Возможно, что это превращение связано с фосфорилированием гидроксильной группы, поскольку в препаратах печени было обнаружено образование фосфорилированного производного 3-оксиантраниловой кислоты (779, 780]. 3-Оксикинуренин накапливается как промежуточный продукт при образовании пигментов глаз у насекомых [781]; он найден в личинках насекомых [782, 783], в растениях [784] и в моче человека при некоторых патологических состояниях [785].
Возможно, что при окислении 3-оксикинуренина промежуточным продуктом является a-N-ацетилкинуренин. Имеются данные о наличии a-N-ацетил-3-оксикинуренина у Neurospora [786]; a-N-ацетилкинуренин и соответствующее ацетильное производное 3-оксикинуренина обнаружены в моче В6-авитаминозных крыс, получавших большие количества триптофана [748].
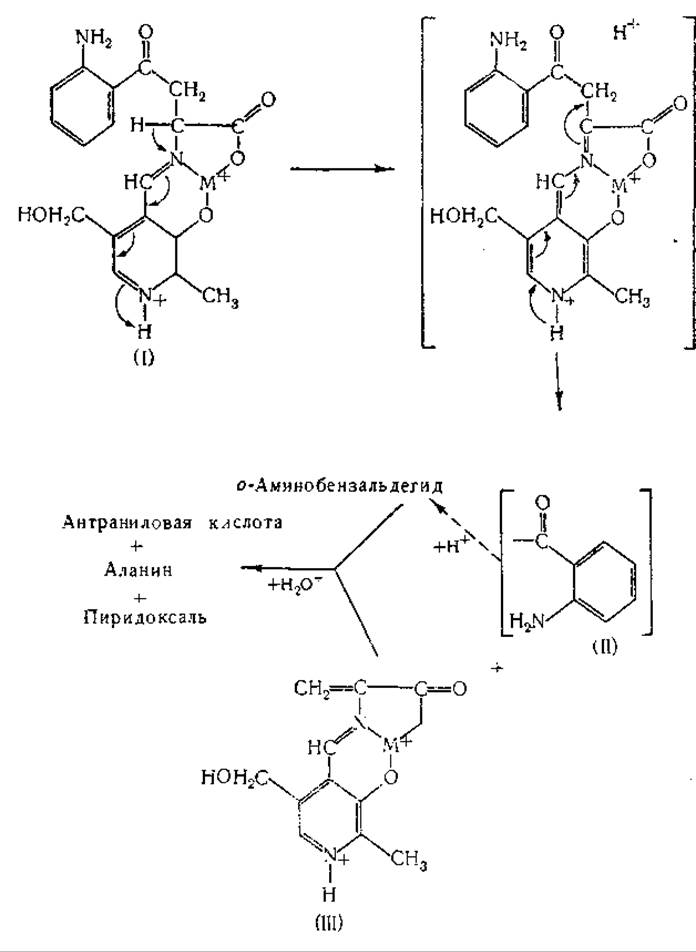
Как кинуренин, так и 3-оксикинуренин расщепляются кинурениназой с образованием аланина и антраниловой или 3-оксиантраниловой кислоты. Кинурениназа [748, 788—794] найдена в печени и почках млекопитающих и у различных микроорганизмов; в ее действии участвует в качестве кофермента пиридоксальфосфат [791]. Различные исследователи рассматривали механизм кинурениназной реакции [795—797]. Лонгенеккер и Снелл [797] предполагали, что при этой реакции шиффово основание (I), образующееся из кинуренина и пиридоксальфосфатэнзима (см. схему на стр. 402), превращается в шиффово основание a-аминоакриловой кислоты (III). Промежуточное соединение (II) (см. ниже) вступает в окислительно-восстановительную реакцию с продуктом (III), в результате чего образуются антраниловая кислота и шиффово основание аланина. Кроме кинуренина и 3-оксикинуренина, кинурениназа расщепляет также формилкинуренин (на формилантраниловую кислоту и аланин) и 5-оксикинуренин (с образованием 5-оксиантраниловой кислоты) [798, 799].
3-Оксиантраниловая кислота превращается в никотиновую кислоту; путь этого превращения требует дальнейшего изучения. Значительное внимание было уделено вопросу о том, является ли хинолиновая кислота промежуточным звеном при этом превращении [739, 761, 801—804, 806, 807]. Хотя установлено, что 3-оксиантраниловая кислота переходит в хинолиновую кислоту и никотиновая кислота может образоваться из хинолиновой кислоты, имеются данные, свидетельствующие о том, что хинолиновая кислота не лежит на главном пути, ведущем к образованию никотиновой кислоты. Вполне вероятно, что предшественником как хинолиновой, так и никотиновой кислоты является промежуточный продукт, образующийся при расщеплении 3-оксиантраниловой кислоты. Недавно Мелер [808] установил, что в печени окисление 3-оксиантраниловой кислоты сопровождается потреблением двух атомов кислорода и приводит к образованию промежуточного продукта, который может спонтанно переходить в хинолиновую кислоту или ферментативным путем превращаться в пиколиновую кислоту:
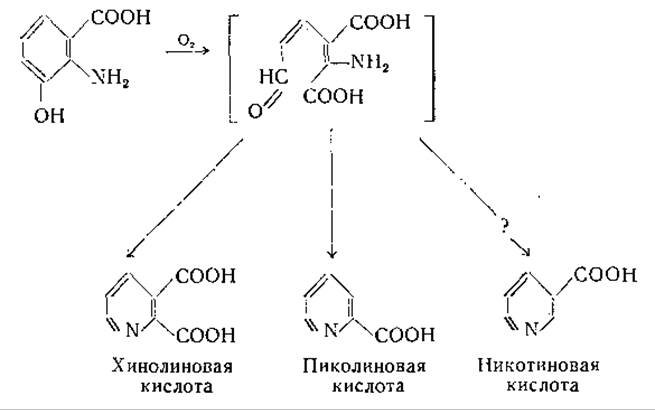
Возможно, что под действием другого фермента из этого промежуточного продукта образуется никотиновая кислота. Свободная пиколиновая кислота в природе не найдена, но соответствующее ей N-метилпроизводное, омарин, обнаружено у некоторых видов морских беспозвоночных [809]. Проблема образования никотиновой кислоты подробно изложена Далглишем [806] и Мелером [739].
Любопытно, что у Е. coli и у Bacillus subtiiis, по-видимому, отсутствует фермент (кинурениназа), способный превращать кинуренин в антраниловую кислоту. Опыты, в которых изучались превращения меченых препаратов индола и триптофана у некоторых мутантов этих организмов, показали, что указанные соединения не принимают существенного участия в образовании никотиновой кислоты. Возможно, что у Е. coli и В. subtiiis синтез никотиновой кислоты происходит другим путем [810].
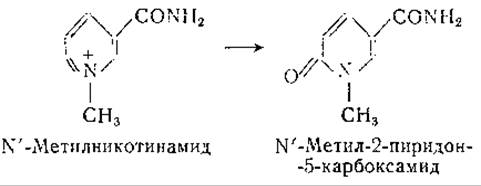
У животных некоторых видов никотиновая кислота выделяется в неизмененном виде, тогда как у других видов она подвергается амидированию и метилированию или выводится в виде парных соединений. Большинство плотоядных и всеядных животных выделяют N'-метилникотинамид [811, 812]; травоядные животные выделяют свободную никотиновую кислоту или ее парные соединения [813]. Птицы некоторых видов выделяют никотинуровую кислоту — продукт соединения никотиновой кислоты с орнитином [814, 815]. У человека [800, 816, 817] и у некоторых животных N'-метилникотинамид подвергается окислению в N'-метил-2-пиридон-5-карбоксамид [818—820].