Биохимия аминокислот - А. Майстер 1961
Роль аминокислот в питании
Антагонисты аминокислот
Антагонисты других аминокислот
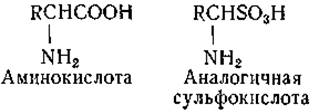
Одними из первых синтетических антагонистов аминокислот явились аналогичные им сульфоновые кислоты. Многие из этих производных, в том числе сульфозамещенные аналоги глицина, валина, лейцина, фенилаланина и аланина, обладают бактериостатическим действием. Оно, как правило, снимается природным аналогом и нередко другими аминокислотами [167].
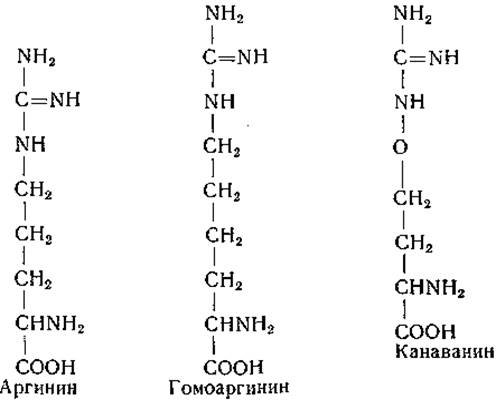
Канаванин, встречающийся в различных растениях (стр. 49), оказывает тормозящее действие на рост бактерий и животных. Эта аминокислота расщепляется аргиназой на каналин и мочевину [280] и при взаимодействии с фумаратом превращается в канаваноянтарную кислоту [281] (стр. 49); вместе с тем она может конкурентно тормозить отщепление имидогруппы от аргинина [282] (стр. 342). Торможение роста, вызванное канаванином, может быть снято аргинином и в некоторых случаях лизином, цитруллином или орнитином. Любопытно, что торможению роста Torula utilis канаванином противодействует также а-амино-ε-гуанидинокапроновая кислота (гомоаргинин) — соединение, которое до сих пор не найдено в природе и не является продуктом обмена [178]. Гомоаргинин, который, по литературным данным, оказывает слабое, но явно положительное действие на рост крыс при недостаточности лизина в рационе [283], вызывает конкурентное торможение роста у Chlorella vulgaris и Escherichia coli В [178, 184].
Помимо отмеченных выше (стр. 150) галоидзамещенных антагонистов фенилаланина, были синтезированы аналоги тирозина [240, 272], валина, изолейцина и лейцина, содержащие атомы галоидов. В аналогах последних трех аминокислот метильную группу заменял атом хлора [170]:
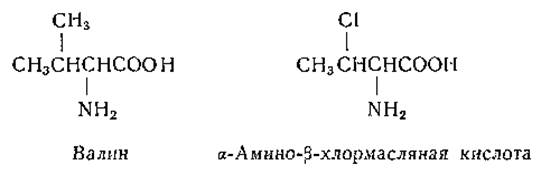
Одно из изменений структуры, во многих случаях приводящее к образованию антагонистов, состоит в введении ненасыщенных групп в молекулы аминокислот. Примером полученных этим путем производных может служить металлилглицин — антагонист валина, лейцина и изолейцина [170]:
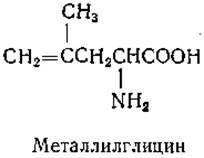
Иногда торможение вызывается оптическими антиподами, хотя это явление наблюдается нечасто. Так, например, найдено, что у Lactobacillus arabinosus D-лейцин конкурентно тормозит усвоение L-лейцина [206].
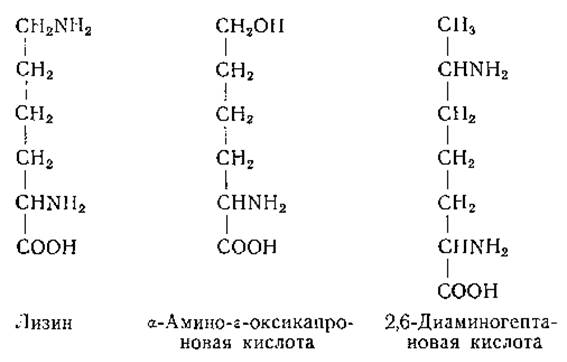
При замене s-аминогруппы лизина гидроксильной группой образуется соединение, токсичное для крыс. При скармливании крысам а-амино-ε-оксикапроновой кислоты или казеина, обработанного азотистой кислотой (при действии которой s-аминогруппа лизина превращается в оксигруппу), у животных развивается анемия, устранимая путем введения лизина [213] (стр. 426). Другим соединением, действующим как конкурентный антиметаболит лизина (по крайней мере у бактерий), является высший гомолог лизина, 2,6-диаминогептановая кислота [215].
Опубликован ряд наблюдений, свидетельствующих о стимулировании роста различных организмов пептидами, причем в ряде случаев установлено, что определенные пептиды оказывают на рост более благоприятное действие, чем входящие в их состав аминокислоты (стр. 261). Эти наблюдения привлекли к себе особое внимание в связи с возможной ролью пептидов как промежуточных продуктов при биосинтезе белка. Однако имеются и другие возможности для объяснения отмеченного превосходства пептидов как стимуляторов роста по сравнению с соответствующими аминокислотами. Так, аминокислоты, соединенные пептидной связью, могут оказаться защищенными от побочных реакций распада; поэтому постепенный гидролиз пептида может лучше обеспечивать снабжение клеток данной аминокислотой, чем внесение эквивалентного количества свободной аминокислоты. Некоторые пептиды более активно противодействуют влиянию антагонистов аминокислот, чем свободные аминокислоты. Так, например, глицилфенилаланин лучше снимает торможение роста Escherichia coli и Lactobacillus arabinosus ß-2-тиенилаланином, чем фенилаланин. Подобным же образом глицил- и аланилпептиды метионина оказались активнее самого метионина при снятии токсического действия этионина у тех же микроорганизмов [249]. Причина большей активности пептидов еще не ясна.
Среди найденных в природных объектах антиметаболитов, имеется, вероятно, немало таких, которые нарушают обмен аминокислот. За увядание листьев томата, вызываемое Fusarium lycopersici, по-видимому, ответствен вырабатываемый этим грибом ликомаразмин (стр. 74) — пептидное производное аспарагина, глицина и а-оксиаланина. Действие этого токсина на листья томата можно предотвратить при помощи пептидов типа стрепогенина [284] (стр. 75). Это интересное наблюдение дает основание предполагать существование других антиметаболитов пептидной природы, действие которых направлено на аналогичные им нормальные продукты обмена.
Вполне очевидно, что факты, рассмотренные выше и приведенные в табл. 19, представляют лишь-«первую разведку» в области изучения антагонистов аминокислот. Найдены многие мощные антагонисты и намечаются некоторые выводы относительно роли определенных изменений в строении молекул аминокислот. Ряд антагонистов, очевидно, подвергается обмену, однако пути превращения большинства из них, равно как механизм их действия, не выяснены. Изучение антиметаболитов вознаграждается иногда созданием новых лекарственных препаратов, но чаще такие исследования позволяют найти ключ к пониманию тех или иных процессов обмена (ср. [285, 286]). Для получения более исчерпывающих данных об этих процессах требуется, однако, применение других экспериментальных методов (гл. III и IV). Наличие антагонистов аминокислот в природных объектах заставляет считаться с возможным их значением как патогенных факторов. Вместе с тем они могут (например, в виде некоторых антибиотиков) играть роль терапевтических средств. Наконец, взаимный антагонизм между различными природными аминокислотами может представлять собой один из физиологических механизмов управления процессами роста и обмена веществ.