Биохимия аминокислот - А. Майстер 1961
Общая биохимия и физиология аминокислотного обмена
Обмен аминогруппы
Использование аммиака
Весьма низкие концентрации аммиака в большей части тканей и жидкостей тела млекопитающих указывают на существование в организме эффективных механизмов его устранения. Известно, что аммиак обладает высокой токсичностью: так, например, в классических исследованиях Самнера [61] было показано, что введение уреазы в организм животных приводит к их гибели вследствие отравления аммиаком. Как указано выше, удаление аммиака из тела некоторых низших водных организмов происходит путем простой диффузии его в окружающую среду. Животных, экскретирующих аммиак в качестве главного конечного продукта азотистого обмена, относят к аммониотелическому типу, а тех, которые выделяют преимущественно мочевую кислоту (птицы, пресмыкающиеся), — к урикотелическому. У млекопитающих большая часть аммиака обезвреживается путем превращения в мочевину (уреотелический тип азотистого обмена); мочевина и другие азотистые продукты, в том числе аммиак, выводятся с мочой. Высшим растениям не свойственны специальные экскреторные механизмы; у некоторых из них аммиак присоединяется к ω-карбоксильным группам аспарагиновой и глутаминовой кислот, причем во многих случаях наблюдается накопление амидов одной или обеих дикарбоновых аминокислот в значительных количествах.
Образование аспарагина и глутамина имеет место и у животных; получены убедительные доказательства важной роли глутамина в качестве резервной и транспортной форм аммиака в интактном организме животных [62]. Глутамин является одним из главных небелковых азотистых веществ крови у млекопитающих; у человека на его долю приходится около 20% аминного азота крови. В жидкостях тела концентрация глутамина, как правило, выше концентрации глутаминовой кислоты; в тканях наблюдаются обратные соотношения. Найдено, что глутамин переходит в клетки значительно легче, чем глутаминовая кислота. Так, например, при внутривенном введении экспериментальным животным глутамин (но не глутаминовая кислота) может проникать в мозг [63]. Установлено также, что глутамин всасывается в желудочно-кишечном тракте как таковой; заметного гидролиза глутамина в процессе всасывания не происходит [18, 64]. Амидный азот глутамина подвергается в печени ряду превращений, в том числе превращениям, в итоге которых образуется мочевина. Амидная группа глутамина служит, кроме того, главным источником аммиака мочи.
Ван-Слайк и его сотрудники [65] в опытах на собаках с выведенными под кожу почками показали, что большая часть аммиака мочи образуется за счет амидного азота глутамина. Эти авторы параллельно определяли концентрацию глутамина в крови почечных сосудов и образование аммиака мочи. В ряде опытов было отмечено, что то количество амидного азота глутамина, которое удалялось из крови, не покрывает всего аммиака мочи; появление остального аммиака может быть отнесено за счет исчезновения из крови небольших количеств а-аминоазота. Мысль о том, что источником части аммиака мочи может служить азот других аминокислот, в дальнейшем нашла подтверждение [66, 67]. Было найдено, что у собак с экспериментальным ацидозом внутривенное введение некоторых аминокислот увеличивает количество аммиака, выводимого с мочой. Этот эффект наблюдался при введении целого ряда аминокислот, например глицина, L-лейцина, L-аспарагина, L-аланина, L-гистидина; введение других аминокислот — L-лизина, L-глутаминовой кислоты и L-аргинина — не оказывало подобного действия.
Ферментные препараты из почек крыс с экспериментальным ацидозом активнее образуют аммиак из глутамина, глицина и лейцина, чем аналогичные препараты из почек контрольных крыс [68, 69]. Алкалоз, напротив, приводит к снижению интенсивности дезаминирования этих аминокислот. Видовые различия в активности глутаминазы почек хорошо согласуются с различиями в способности к выведению аммиака с мочой [70].
В опытах на крысах было показано, что внутривенно введенный N15-аммоний может выводиться как таковой [71]; однако в физиологических условиях аммиак крови, по-видимому, не имеет существенного значения как источник аммиака мочи. Главную роль в образовании аммиака играют: а) дезамидирование глутамина и б) действие ферментной системы, состоящей из глутамат-трансаминазы и глутаматдегидрогеназы. Следует учитывать также возможность участия в этом процессе глицин-оксидазы, поскольку в моче обнаружена глиоксиловая кислота [62]. Однако значение глициноксидазы в обмене веществ взято под сомнение [72]; возможно, что глиоксиловая кислота мочи представляет продукт других превращений.
После введения глутамина и других аминокислот в организм млекопитающих большая часть введенного азота выводится в виде мочевины. В ранних исследованиях Кребса и Гензелейта было показано, что образование мочевины тесно связано с циклическими превращениями аргинина, орнитина и цитруллина (стр. 338); из этих исследований вытекало, что для превращения орнитина в цитруллин и цитруллина в аргинин необходим аммиак (или донатор аммиака). В настоящее время известно, что непосредственным источником одного из атомов азота амидиновой группы аргинина служит аминогруппа аспарагиновой кислоты. Источником атома азота, необходимого для превращения орнитина в цитруллин, служит карбамилфосфат, который синтезируется из карбаминовой кислоты и аденозин-трифосфата (стр. 341).
Наличие в тканях млекопитающих общей, активной в физиологических условиях, ферментной системы дезаминирования L-аминокислот до сих пор не доказано; в то же время многие экспериментальные факты говорят о существовании активных систем переаминирования. Превращение азота большей части аминокислот в мочевину протекает двумя путями; а) путем реакций переаминирования, приводящих к образованию глутаминовой кислоты, с последующим окислительным дезаминированием последней; освободившийся при этом процессе аммиак используется для синтеза карбамилфосфата; б) путем реакций переаминирования, приводящих к образованию аспарагиновой кислоты. Одна из важных функций глутамат-аспартат-транс- аминазы состоит в образовании аспарагиновой кислоты, используемой для синтеза аргинина. Рассмотренные превращения можно схематически изобразить следующим образом:
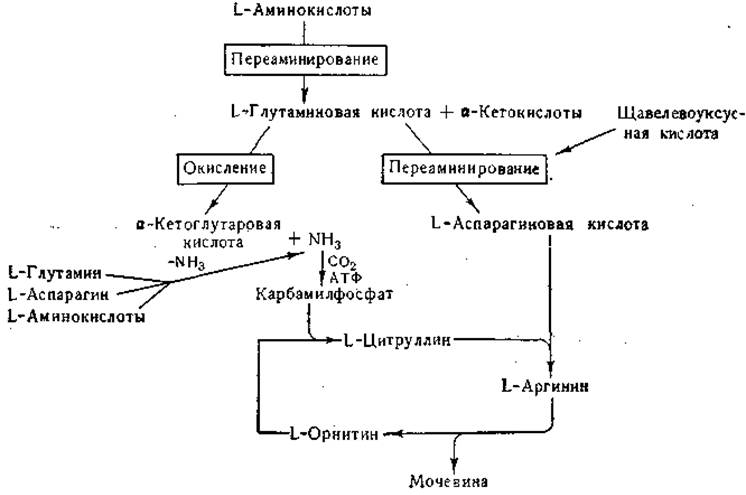
Хотя эта схема дает весьма упрощенную картину процесса превращения аминных групп в мочевину (см. гл. IV), показанный на схеме путь превращения можно считать доказанным.
Щавелевоуксусная и а-кетоглутаровая кислоты образуются в цикле лимонной кислоты. Аммиак образуется при дезамидировании глутамина и аспарагина, а также при действии специфических дезаминаз на некоторые аминокислоты (гистидин, серин, треонин, цистеин). Некоторые из приведенных в схеме реакций обратимы. Так, в результате сочетанного действия глутаматдегидрогеназы и соответствующих трансаминаз происходит аминирование а-кетокислот с образованием аминокислот.
Дезаминирование и реаминирование в тканях млекопитающих может, вероятно, осуществляться и другими путями (стр. 194). Помимо специфических дезаминаз, в дезаминировании аминокислот, возможно, принимают некоторое участие и оксидазы L-аминокислот, однако, по данным новейших исследований, этот процесс не играет в количественном отношения значительной роли.