Биохимия аминокислот - А. Майстер 1961
Общая биохимия и физиология аминокислотного обмена
Окислительное дезаминирование
Оксидаза L-аминокислот
Из тканей млекопитающих был получен только один препарат оксидазы L-аминокислот; он был выделен из почек крысы Бланшаром и сотрудниками [118]. Этот фермент, катализирующий окисление 13 L-аминокислот (см. табл. 18), был подвергнут очистке; найдено, что его «число оборотов» равно примерно 6. Он отличается от остальных общих аминокислотных оксидаз тем, что его коферментом служит рибофлавинфосфат. Примечательное свойство этого фермента состоит в том, что он окисляет L-a-оксикислоты несколько быстрее, чем L-аминокислоты. Субстратная специфичность фермента по отношению к аминокислотам сходна со специфичностью оксидазы D-аминокислот; для обоих ферментов характерно очень медленное окисление дикарбоновых аминокислот и диаминокислот. Помимо почек, оксидаза L-аминокислот в других тканях животных не найдена. Представляется маловероятным, чтобы фермент, столь мало распространенный и обладающий такой низкой активностью, мог играть существенную роль в общем процессе дезаминирования L-аминокислот у млекопитающих.
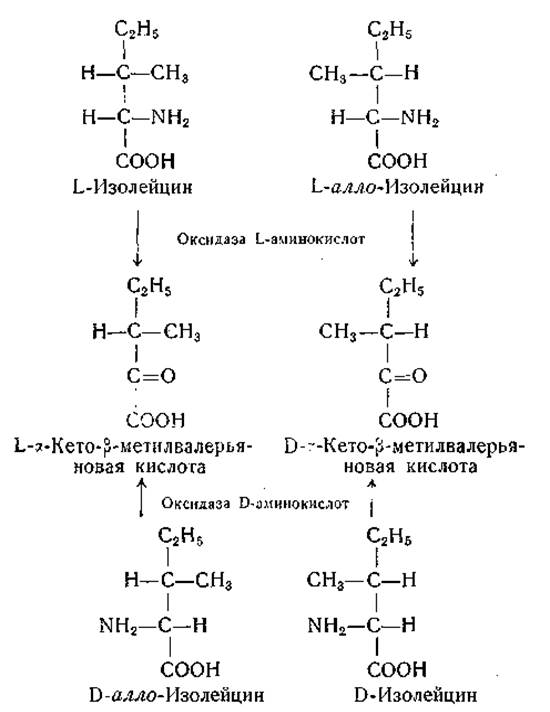
Целлер и сотрудники [145—147] обнаружили оксидазу L-аминокислот (змеиную аминокислотную оксидазу) в ядах и тканях многих змей. Активность многих высушенных змеиных ядов очень высока; Целлер нашел, что наибольшей активностью обладает яд Vipera aspis. В очищенной форме фермент был выделен из яда мокасиновой змеи; установлено, что его коферментом является флавинадениндинуклеотид [119]. Субстратная специфичность змеиной L-аминокислотной оксидазы указана в табл. 18; в относительных скоростях окисления отдельных аминокислот отмечены видовые особенности, хотя общие закономерности субстратной специфичности у разных видов сходны. Подобно D-аминокислотной оксидазе почек, этот фермент окисляет лизин и орнитин очень медленно, тогда как ω-N-ацил-производные этих аминокислот окисляются довольно быстро. Точно так же глутамин и аспарагин в отличие от соответствующих дикарбоновых аминокислот относительно быстро окисляются змеиной L-аминокислотной оксидазой. Оксидаза L-аминокислот в противоположность оксидазе D-аминокислот не окисляет пролин, оксипролин и N-монометиламинокислоты. L-Изолейцин и L-алло-изолейцин окисляются ею в L- и D-формы а-кето-β-метил-валерьяновой кислоты без рацемизации в процессе окисления. Найдено, что L-стереоизомеры ß-фенилсерина окисляются змеиной L-аминокислотной оксидазой в отсутствие каталазы в соответствующие оптические активные миндальные кислоты [148]. Ферментативное окисление четырех изомеров изолейцина и двух L-стереоизомеров ß-фенилсерина в оптически активные продукты лишний раз подтверждает, что ß-водородный атом не вовлекается в процесс окисления (см. стр. 189).
Интересные исследования, касающиеся окисления изомеров а, є-диаминопимелиновой кислоты и некоторых ее производных, были проведены Уорк [149]. -L-Аминокислотная оксидаза плесени Neurospora окисляет LL-диаминопимелиновую кислоту гак же активно, как мезо-форму и D-моноамид L-диаминопимелиновой кислоты. Окисление этих субстратов протекает примерно с такой же скоростью, как и окисление L-метионина и L-лизина.
В отличие от окисления LL-формы, при котором потребляется два атома кислорода (в присутствии каталазы), при окислении мезо-формы потребляется только один атом кислорода.
Физиологическое значение змеиной L-аминокислотной оксидазы не выяснено. Токсичность змеиного яда, по-видимому, не связана с присутствием этого фермента.
Активные оксидазы L-аминокислот найдены у многих микроорганизмов, в том числе у Neurospora crassa, у которой образование этого фермента стимулируется биотином [150]. Возможно, что биотин не оказывает прямого действия на синтез фермента, поскольку этот витамин необходим для роста самой плесени.
Интересно, что некоторые виды N. crassa продуцируют одновременно оксидазы D- и L-аминокислот, тогда как другие виды вырабатывают только одну оксидазу с D- или L-специфическим действием [131, 150, 151]. Оксидазы L-аминокислот найдены у ряда штаммов Penicillium, Aspergillus niger, Proteus и Aerobacter aerogenes [124, 131, 150, 152, 153]. Фермент из Proteus vulgaris [153] получен в очищенном состоянии; изучена его субстратная специфичность (см. табл. 18). В печени индюка найдена оксидаза L-аминокислот, действующая на диаминокислоты (см. стр. 343).