Биохимия аминокислот - А. Майстер 1961
Общая биохимия и физиология аминокислотного обмена
Окислительное дезаминирование
Неокислительное дезаминирование
Реакции неокислительного дезаминирования аминокислот обнаружены у микроорганизмов и в тканях животных. Ферменты, катализирующие эти реакции, проявляют относительно высокую специфичность — каждый по отношению к одной определенной аминокислоте. При дезаминировании серина, треонина, гомосерина, цистеина и гомоцистеина от молекулы аминокислоты отнимаются элементы воды или сероводород, что приводит к образованию двойной связи между а- и ß- или ß- и у-углеродными атомами. За перегруппировкой промежуточного продукта в соответствующую иминокислоту должен последовать гидролиз с образованием а-кетокислоты и аммиака. Так, например, дезаминирование гомосерина можно изобразить следующим образом:
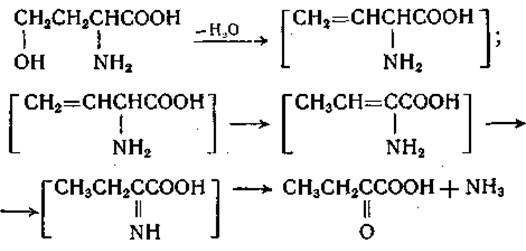
Аналогичным образом может быть представлено дезаминирование серина, треонина, гомоцистеина и цистеина. Эти реакции рассматриваются в соответствующих разделах гл. IV. Участие пиридоксальфосфата установлено для реакций, катализируемых десульфгидразами L-цистеина и L-гомоцистеина и дегидратазами L- и D-серина. Предполагают, что реакции десульфирования и дегидратации протекают с образованием промежуточного продукта типа шиффова основания, в образовании которого участвует альдегидная группа пиридоксаля (стр. 245). Следует отметить, что процесс десульфирования Цистеина может протекать и не прямым путем — через реакцию переаминирования. На этом пути образования сероводорода, катализируемом системой ферментов десульфирования, пиридоксальфосфат необходим для осуществления реакции переаминирования. Образование сероводорода из цистеина обсуждается в соответствующем разделе гл. IV.
В процессе распада гистидина с промежуточным образованием уроканиновой (ß-имидазолакриловой) кислоты (стр. 393) первое звено состоит в дезаминировании гистидина. Фермент, осуществляющий эту реакцию, различные авторы называли по-разному: гистидиндезаминаза, дезаминогистидаза, гистидин-а-дезаминаза и гистидаза. Последним термином прежде обозначали ферментную систему, вызывающую более глубокое разложение гистидина с расщеплением имидазольного кольца. В дальнейшем было обнаружено, что в препаратах «гистидазы», получение которых описано в старых работах, содержатся уроканаза и, возможно, еще. и другие ферменты. Реакция катализируемая гистидазой, аналогична той, которую осуществляет аспартаза:
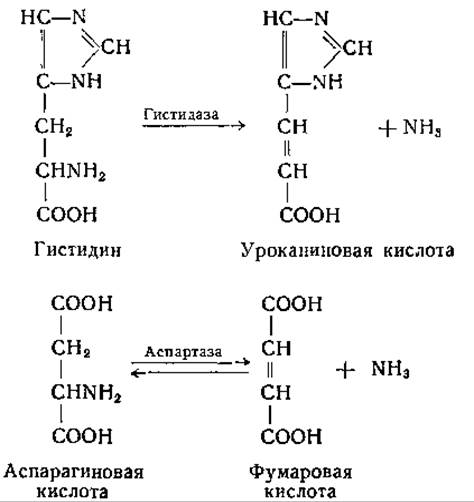
Эти реакции обсуждаются также и в других разделах [стр. 312 (аспартаза) и стр. 390 (гистидаза)].
Реакция, катализируемая триптофаназой, представляет еще один пример реакции неокислительного дезаминирования. В этой реакции триптофан распадается без поглощения кислорода на индол, пировиноградную кислоту и аммиак (стр. 408).
У некоторых анаэробных микроорганизмов обнаружены реакции одновременного дезаминирования двух аминокислот в результате их взаимного окисления и восстановления. У Clostridium sporogenes и некоторых других бактерий реакции этого типа представляют собой единственный источник энергии. Это явление было впервые описано Стиклендом; в настоящее время оно известно под названием «реакция Стикленда» [185]. Микроорганизмы, которым свойственна реакция Стикленда, в большинстве своем принадлежат к семейству Clostridiae, но эта реакция встречается не у всех видов Clostridium [185, 186]. Стикленд нашел, что клетки Cl. sporogenes катализируют восстановление метиленовой сини и бензилвиологена в присутствии некоторых аминокислот, выступающих в качестве донаторов водорода. Он установил также, что клетки Cl. sporogenes при катализируемая гистидазой, аналогична той, которую осуществляет аспартаза:
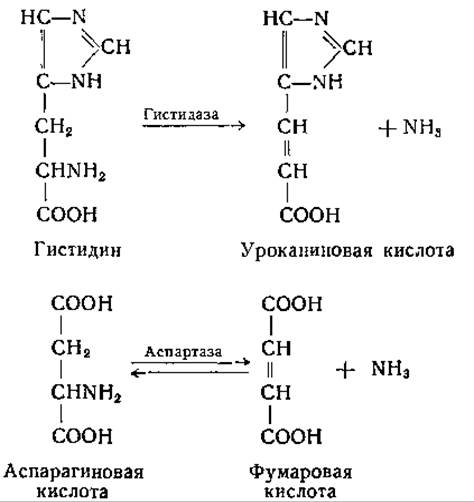
Эти реакции обсуждаются также и в других разделах [стр. 312 (аспартаза) и стр. 390 (гистидаза)].
Реакция, катализируемая триптофаназой, представляет еще один пример реакции неокислительного дезаминирования. В этой реакции триптофан распадается без поглощения кислорода на индол, пировиноградную кислоту и аммиак (стр. 408).
У некоторых анаэробных микроорганизмов обнаружены реакции одновременного дезаминирования двух аминокислот в результате их взаимного окисления и восстановления. У Clostridium sporogenes и некоторых других бактерий реакции этого типа представляют собой единственный источник энергии. Это явление было впервые описано Стиклендом; в настоящее время оно известно под названием «реакция Стикленда» [185]. Микроорганизмы, которым свойственна реакция Стикленда, в большинстве своем принадлежат к семейству Clostridiae, но эта реакция встречается не у всех видов Clostridium [185, 186]. Стикленд нашел, что клетки Cl. sporogenes катализируют восстановление метиленовой сини и бензилвиологена в присутствии некоторых аминокислот, выступающих в качестве донаторов водорода. Он установил также, что клетки Cl. sporogenes при участии другой группы аминокислот, играющих роль акцепторов водорода (табл. 19), катализируют окисление восстановленных красителей.
Таблица 19 Поведение аминокислот в реакции Стикленда
|
Донаторы водорода |
Акцепторы водорода |
|
L-Аспарагиновая кислота |
Глицин |
|
L-Лейцин |
L-Орнитин |
|
L-Изолейцин |
L-Пролин |
|
L-Валин |
L-Оксипролин |
|
L-Аланин |
L-Аргинин |
|
L-Фенилаланин L-Цистеин L-Серин L-Гистидин L-Глутаминовая кислота |
L-Триптофан |
При одновременном присутствии в системе аминокислоты- донатора и аминокислоты-акцептора образуются аммиак и углекислота. Реакция между глицином и аланином протекает следующим образом:
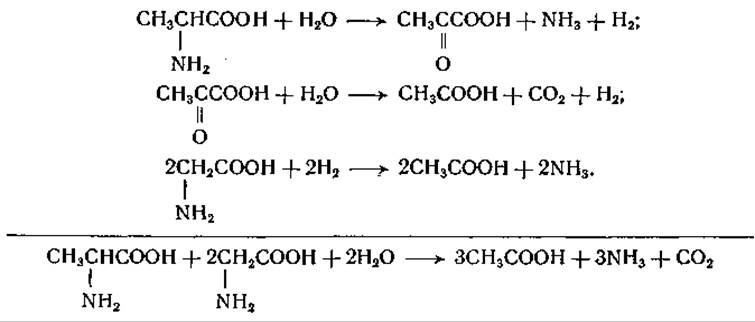
Аналогичные реакции наблюдаются и между другими аминокислотами, из которых всегда одна служит акцептором, а другая — донатором водорода [187—190]. В качестве продуктов реакции из пролина образуется 5-аминовалерьяновая кислота, а из изолейцина, лейцина и валина — а-метилмасляная, изовалерьяновая и изомасляная кислота соответственно. Реакция между пролином и лейцином выражается следующим суммарным уравнением:
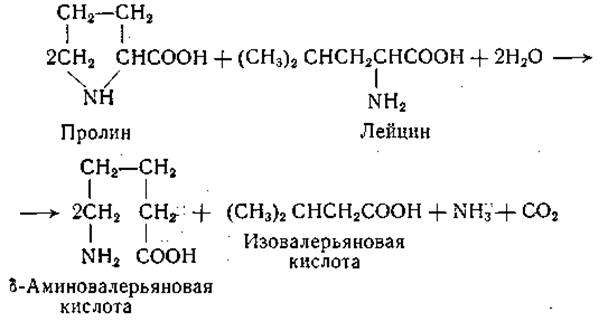
Нисман и Вине [191] обнаружили, что в аэробных условиях аминокислоты, являющиеся донаторами водорода, превращаются преимущественно в соответствующие жирные кислоты; однако наряду с этим появляются небольшие количества соответствующих a-кетокислот. На основании этих наблюдений механизм реакций Стикленда может быть представлен следующей схемой:
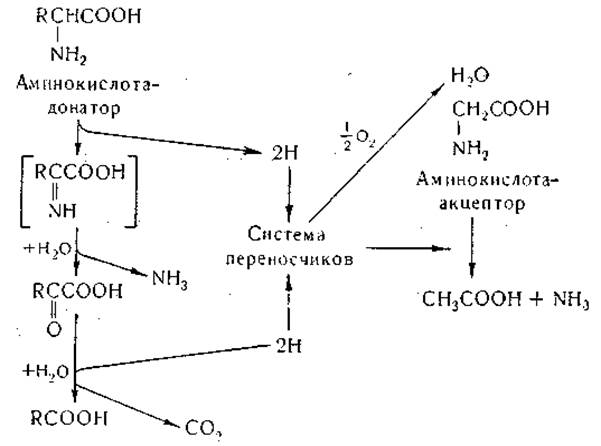
По данным Нисмана, в аэробных условиях аминокислоты-акцепторы и кислород конкурируют за водород, отщепленный от аминокислоты-донатора. Имеются данные, свидетельствующие о том, что в реакции Стикленда в качестве переносчика водорода участвует дифосфопиридиннуклеотид [187, 188]; так, установлено, что дифосфопиридиннуклеотид может быть восстановлен аланином, а восстановленный кофермент вновь переводится в окисленную форму пролином или глицином. Исследования, проведенные в последние годы, свидетельствуют о том, что процесс сопряженного окислительного и восстановительного дезаминирования, описанный Стиклендом, состоит из сложного ряда промежуточных реакций; некоторые стороны этого процесса, например природа систем, участвующих в переносе водорода, нуждаются в дальнейшем изучении. Те данные, которые известны в настоящее время, совместимы с приведенной выше схемой Нисмана [187].
Некоторые виды Clostridium способны разлагать также отдельные аминокислоты, например серин, гистидин, глутаминовую кислоту, метионин, тирозин; к числу продуктов распада относятся аммиак, водород и углекислота. Известно также, что Cl. sporogenes может катализировать восстановление некоторых аминокислот в присутствии газообразного водорода, согласно уравнению:
![]()
Образование и использование газообразного водорода в указанных реакциях обеспечивается действием гидрогеназы [187]:
![]()