Биохимия аминокислот - А. Майстер 1961
Общая биохимия и физиология аминокислотного обмена
Перреаминирование
Доказательства существования различных трансаминаз
После того как было установлено, что в реакции ферментативного переаминирования вступают очень многие аминокислоты, стало очевидным, что в природе существует множество различных трансаминаз. Однако исследования по разделению и очистке этих ферментов не поспевают за открытием новых реакций переаминирования. Это объясняется, очевидно, тем, что разработка способов очистки ферментов вообще представляет сложную задачу, а может быть, и тем, что внимание исследователей распыляется в связи с большим разнообразием субстратов переаминирования, существование которых установлено или предполагается.
Описаны способы разделения и частичной очистки аспартат-глутамат- и аланин-глутамат-трансаминаз из сердечной мышцы [208, 262—265]. Доказано, что в печени реакции переаминирования между глутамином и а-кетокислотами [282], между аспарагином и а-кетокислотами [289] и между серином и аланином [297] катализируются различными ферментами. Трансаминазы, катализирующие реакции переаминирования ароматических аминокислот с а-кетоглутаратом, в клетках печени крысы локализованы в цитоплазматических гранулах [315].
Экстракты из клеток Escherichia coli были подвергнуты фракционированию посредством избирательной адсорбции на гелетрифосфата кальция и последующей дробной элюции. Этим способом удалось разделить фракции с трансаминазной активностью по отношению к трем разным группам субстратов [272].
Вся свойственная исходному экстракту активность в реакциях переаминирования между а-кетоглутаровой кислотой и различными аминокислотами оказалась сосредоточенной в двух фракциях (табл. 23). Одна из них, а именно фракция А, была неактивна по отношению к изолейцину и валину и очень слабо активна в реакции с лейцином. В отличие от фракции А во фракции Б отсутствовала трансаминазная активность по отношению к триптофану и аспарагиновой кислоте. Далее был изучен мутантный штамм Е. coli, проявляющий абсолютную потребность в изолейцине и относительную — в валине как факторах роста; этот штамм не может расти на средах, содержащих вместо изолейцина и валина соответствующие а-кетокислоты. Оказалось, что у данного мутанта Е. coli диапазон специфичности реакций переаминирования с участием а-кетоглутаровой кислоты очень близок к диапазону специфичности фракции А; иначе говоря, у этого организма отсутствует трансаминазная активность в реакциях, свойственных фракции Б. Эти результаты находятся в соответствии с присущей данному мутанту абсолютной потребностью в изолейцине и с тем, что его рост не может быть обеспечен аналогичной изолейцину а-кетокислотой.
Таблица 23 Реакции переаминирования между а-кетоглутаровой кислотой и различными аминокислотами у Escherichia coli [272]
|
Аминокислота |
Трансаминазная активность по отношению к соответствующей аминокислоте * |
|||
|
экстракт из клеток дикого типа |
Фракция А |
Фракция Б |
экстракт из клеток мутантного штамма |
|
|
Аспарагиновая кислота |
100 |
100 |
0 |
100 |
|
Валин |
37 |
0 |
58 |
0 |
|
Изолейцин |
40 |
0 |
84 |
0 |
|
Лейцин |
41 |
3 |
100 |
3 |
|
Метионин |
31 |
10 |
32 |
19 |
|
Тирозин |
25 |
25 |
6 |
18 |
|
Триптофан |
73 |
59 |
0 |
72 |
|
Фенилаланин |
37 |
44 |
26 |
29 |
* Максимальная активность принята за 100%.
Как видно из табл. 23, спектры трансаминазной активности фракций А и Б частично перекрываются. Но если принять, что у мутанта генетические изменения состоят в утрате одного-единственного фермента, то можно заключить, что фракция Б содержит в основном лишь один фермент. Во фракции А, по-видимому, присутствуют несколько трансаминаз, но разделить их при дальнейшем фракционировании не удалось. Как отмечено ниже (стр. 353), этот мутантный штамм Е. coli, способный к медленному росту на среде, не содержащей валина, синтезирует валин путем реакции переаминирования между аланином или а-аминомасляной кислотой и а-кетоизовалерьяновой кислотой.
Фракции А и Б, выделенные из экстракта Е. coli, по-видимому, могут катализировать и другие реакции переноса аминогруппы, помимо тех, в которых участвуют глутаминовая или а-кетоглутаровая кислоты. Оказалось, что смесь фракций А и Б (а также диализованный исходный бесклеточный экстракт) катализирует следующие реакции, протекающие со скоростями одинакового порядка:

Между тем реакция тирозин ⇄ изолейцин в тех же условиях не происходила. Можно полагать, что эта реакция должна была бы протекать с заметной скоростью, если бы реакционная смесь содержала глутаминовую или а-кетоглутаровую кислоту в количествах, достаточных для осуществления сопряженных реакций переаминирования. Реакция (4) может представлять прямое превращение или же (если в реакционной смеси присутствуют а-кетоглутарат или глутамат) результат сопряжения реакций (2) и (3). Отсутствие реакции тирозинизолейцин свидетельствует о том, что система не содержит а-кетоглутаровой и глутаминовой кислот в тех концентрациях, при которых возможны подобные сопряженные реакции. Найдено, что фракция А катализирует реакции переаминирования между всеми аминокислотами, входящими в число ее субстратов, и соответствующими а-кетокислотами; аналогичным свойством обладает и фракция Б. Эти факты позволяют предполагать, что одна индивидуальная трансаминаза может катализировать реакции между любой из аминокислот, принадлежащих указанной группе, и соответствующими им а-кетоаналогами. Этот вывод, основанный на результатах изучения ферментов Е. coli, подтверждается данными, полученными позднее при исследовании трансаминазы, выделенной из мицелия Neurospora [273, 316, 317] и катализирующей следующую реакцию:
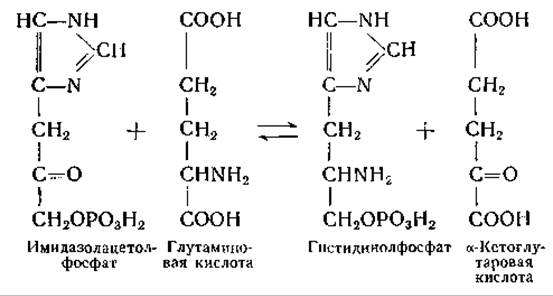
Фермент, осуществляющий эту реакцию, получен в очищенном виде; найдено, что в приведенной выше реакции глутаминовую кислоту можно заменить L-a-аминоадипиновой кислотой, L-аргинином или L-гистидином; гистидинолфосфат может быть заменен а-кетоадипиновой кислотой или а-кето-δ-гуанидиновалерьяновой кислотой. Упомянутый ферментный препарат катализирует следующие реакции переаминирования: а-аминоадипиновая кислота-глутаминовая кислота, глутамат-аргинин, глутамат-гистидин, а-аминоадипиновая кислота-аргинин и a-аминоадипиновая кислота-гистидин. Весьма вероятно, что все эти реакции осуществляются одним и тем же ферментом; ферментный препарат, по-видимому, не содержит глутаминовой и а-кетоглутаровой кислот, что исключает возможность сопряженных реакций переаминирования с глутаминовой кислотой в качестве переносчика NH2-гpyпп.
Реакция между гистидинолфосфатом и а-кетоглутаровой кислотой интересна как пример реакции переаминирования с участием сложного эфира фосфорной кислоты. Некоторую аналогию с этой реакцией представляет взаимопревращение пиридоксальфосфата и пиридоксаминфосфата, связанных с апоферментами трансаминаз (стр. 251 и примечание на стр. 214). Описанные несколькими авторами реакции, предположительно состоящие в переаминировании между пиридоксаминфосфатом и а-кетокислотами [237, 318], дают еще один пример реакций с участием соединения, в молекуле которого вместо карбоксильной группы имеется фосфатный остаток1. Возможно, что в реакциях переаминирования могут принимать участие и другие фосфорные эфиры (например, этаноламинфосфат, фосфо-β-оксипируват).
Образование некоторых трансаминаз, по-видимому, носит приспособительный характер. У Е. coli активность валин-аланин-трансаминазы значительно возрастает при выращивании культуры на среде, не содержащей валина [319]. У N. crassa активность трансаминаз, осуществляющих реакции аланин-глутамат и аспартат-глутамат (в противоположность орнитин-глутамат-трансаминазе и некоторым другим), не зависит от содержания экзогенных аминокислот в питательной среде [320].