Биохимия аминокислот - А. Майстер 1961
Общая биохимия и физиология аминокислотного обмена
Функции витамина В6 в обмене аминокислот
Между отдельными аминокислотами и витаминами существуют важные метаболические взаимоотношения. Роль рибофлавина в виде рибофлавинфосфата и флавинадениндинуклеотида отмечена выше (стр. 183). Аскорбиновая кислота участвует в окислении n-оксифенилпировиноградной кислоты в гомогентизиновую, но механизм ее действия остается пока не выясненным (стр. 419). Взаимоотношения между триптофаном и никотиновой кислотой будут обсуждены детально в одном из последующих разделов (стр. 399). Биотин, по-видимому, принимает участие во включении СО2 (через щавелевоуксусную кислоту) в молекулу аспарагиновой кислоты (стр. 312). Наличие ε-биотиниллизина в биологических объектах указывает на наличие связи между биотином и обменом лизина. Установлено также значение кофермента А в различных реакциях обмена веществ. (В образовании самой молекулы кофермента А участвуют несколько аминокислот (стр. 365).) Кофермент А принимает участие в диссимиляции углеродной цепи лейцина, изолейцина и валина, в синтезе некоторых ацилпроизводных аминокислот (например, гиппуровой кислоты) и, вероятно, в некоторых других превращениях аминокислот. Значение фолевой кислоты в обмене одноуглеродных остатков будет рассмотрено в гл. IV.
Витамин В6 в виде пиридоксальфосфата или пиридоксаминфосфата участвует во многих реакциях обмена аминокислот (табл. 24) и играет в них исключительно важную и многообразную роль.
Таблица 24 Реакции, протекающие с участием витамина В6
|
Переаминирование Декарбоксилирование Рацемизация Серин → Пировиноградная кислота -+ NH3 Треонин → а-Кетомасляная кислота + NH3 Цистеин → Пировиноградная кислота + H2S + NH3 Г омоцистеин → a-Кетомасляная кислота + H2S + NH3 Гомосерин → а-Кетомасляная кислота + NH3 Триптофан → Индол + Пировиноградная кислота + NH3 Индол + Серин → Триптофан Кинуренин → Антраниловая кислота + Аланин 3-Оксикинуренин → 3-Оксиантраниловая кислота + Аланин Цистатионин → Цистеин + а-Кетомасляная кислота + NH3 Гомоцистеин + Серин → Цистатионин Треонин ⇄ Глицин + Ацетальдегид Серин ⇄ Глицин + Формальдегид Аллиин → Аллицин + Пировиноградная кислота + NH3 Метионин → CH3SH + NH3 + а-Кетомасляная кислота |
Сведения о существовании витамина В6 были впервые получены в 1934 г. [385], когда было показано, что этот витамин является необходимым пищевым фактором для крыс; однако его функции в обмене веществ выяснены лишь недавно. Несмотря на большое количество накопленных о витамине B6 сведений, совокупность симптомов, наблюдаемых при его недостаточности, до сих пор полностью не объяснена. Осуществление химического синтеза витамина В6 и обнаружение трех природных форм этого витамина создали предпосылку для дальнейших открытий; в первую очередь было установлено его участие в ферментативном переаминировании и декарбоксилировании аминокислот.
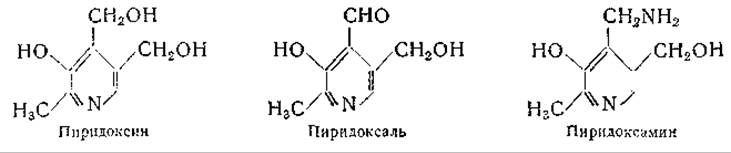
Теперь общепризнано, что механизм ферментативного переаминирования заключается, в обратимом образовании шиффовых оснований из амино (или кето) кислоты и фосфорного эфира пиридоксаля (или пиридоксамина). За несколько лет до открытия Браунштейном и Крицман [251] ферментативного переаминирования Хербст [249, 250] выдвинул предположение о наличии подобного механизма для объяснения неферментативного переаминирования между этиловыми эфирами а-аминофенилуксусной кислоты и пировиноградной кислоты:
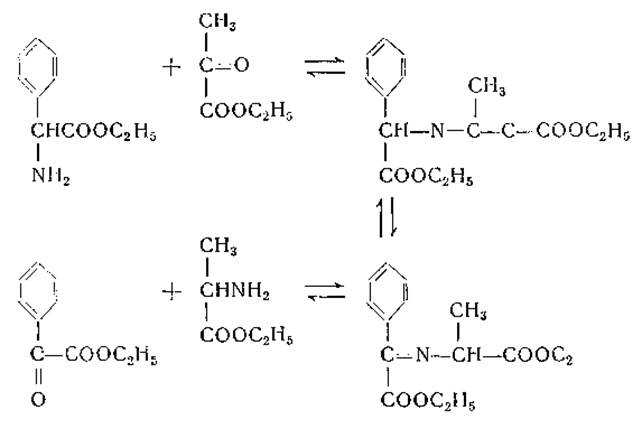
Сходная схема была предложена Браунштейном [257] для объяснения ферментативного переаминирования:
Обнаружение в природных объектах альдегидной и аминной форм витамина В6 привело Снелла [386] к предположению, что взаимопревращение этих форм витамина В6 происходит путем переаминирования и что витамин В6 может выполнять функцию кофермента при ферментативном переаминировании. Позже Снелл [387] доказал обратимое взаимопревращение пиридоксаля и пиридоксамина в результате реакций неферментативного переаминирования с амино- и кетокислотами. Экспериментальные данные, подтверждающие участие витамина В6 в ферментативном переаминировании, были получены при исследовании крыс и микроорганизмов в условиях недостаточности витамина В6. Недостаточность витамина В6 сопровождалась снижением уровня активности трансаминазы, добавление же пиридоксальфосфата к препаратам тканей или клеток восстанавливало активность фермента [388—390].
Аналогичные результаты были получены при исследовании процессов декарбоксилирования аминокислот. Было найдено, что активность тирозиндекарбоксилазы в клетках Streptococcus faecalis зависит от наличия пиридоксина в среде [383, 391]. Позднее установили, что добавление пиридоксаля вместе с аденозинтрифосфатом или же пиридоксальфосфата к клеткам 5. faecalis, выросшим на среде с недостаточным содержанием витамина В6, повышает активность этой декарбоксилазы. Препарат кофермента декарбоксилазы, выделенный из дрожжей [392], по условиям стабильности и по способности активировать декарбоксилазу оказался сходным с препаратом синтетического пиридоксальфосфата [393—396]. Был обнаружен термостабильный кофактор трансаминазы, который также оказался сходным с пиридоксальфосфатом и мог быть заменен им [208, 257, 397]. Существуют убедительные данные, показывающие, что пиридоксальфосфат участвует в декарбоксилировании аминокислот и что в трансаминировании могут принимать участие как пиридоксальфосфат, так и пиридоксаминфосфат. Эти данные получены при исследовании различных В6-авитаминозных организмов, а также в опытах, касающихся влияния добавленных синтетических коферментов на ферментные системы in vitro.
Интересный опыт был поставлен Снеллом и его сотрудниками [398]. Они выращивали различные микроорганизмы на среде, недостаточной по витамину В6, но содержавшей необходимые аминокислоты. При этом оказалось, что Streptococcus faecalis может расти на среде с недостаточным содержанием витамина В6 при наличии в ней незаменимых аминокислот, но прекращает рост при замене этих аминокислот соответствующими а-кетокислотами. Рост на средах с а-кетокислотами наблюдается лишь при добавлении к среде достаточного количества витамина В6. Следовательно, в этих условиях роль витамина B6 сводится к обеспечению трансаминаз коферментом. Аналогичные исследования были проведены в отношении D-аланина: были найдены условия, при которых добавляемый к среде витамин В6 необходим лишь для обеспечения аланинрацемазы коферментом (см. стр. 241).
Сродство к витамину В6 у различных ферментных препаратов неодинаково. Об этом свидетельствуют данные исследований, в которых изучалось активирование изолированных апоферментов, и опыты по определению влияния недостаточности витамина В6 на активность ферментов в тканях. Так, например, при недостаточности витамина В6 у крыс снижается активность глутамат-аспартат-трансаминазы [388, 390, 399, 400] и глутамат-аланин-трансаминазы [401, 403] в ткани, тогда как активность глутамин-а-кетокислотной трансаминазы остается без изменений [402]1. Зависимость последней от витамина В6 была подтверждена путем получения частично отделенного от кофермента экстракта апофермента из печени крыс после введения им изоникотинилгидразида [404]. Ряд исследований показывает, что изоникотинилгидразид действует как антагонист витамина В6 [404—408]. Так, больные, получающие изоникотинилгидразид, выделяют с мочой большие количества витамина В6, по-видимому, в виде соответствующего гидразона. Эти данные свидетельствуют о том, что действие гидразида объясняется его способностью соединяться с альдегидной группой пиридоксаля. При определенном уровне недостаточности витамина В6 у крыс активность цистеинсульфинат-пируват-трансаминазы в печени снижается по сравнению с контролем, тогда как активность цистеинсульфинат-а-кетоглутарат- и глутамат-пируват-транс-аминазы не уменьшается [409]. При диализе препаратов из печени крысы цистеиндесульфгидраза печени легко диссоциирует на апо- и кофермент; активность этой ферментной системы снижается уже при умеренной недостаточности витамина В6 [400, 402].
Хотя пиридоксальфосфат уже в 1944 г. рассматривали как кофермент трансаминаз и декарбоксилаз, это соединение, а также пиридоксаминфосфат были получены в чистом виде лишь в 1952 г. Положение фосфатной группы в коферменте было точно установлено также в 1952 г., хотя из данных более ранних исследований были сделаны правильные выводы относительно строения его молекулы.
1 По данным Оленичевой [294], у крыс при алиментарном B6-авитаминозе легко удается наблюдать глубокое подавление активности трансаминазы глутамина и трансаминазы аспарагина. — Прим. ред.
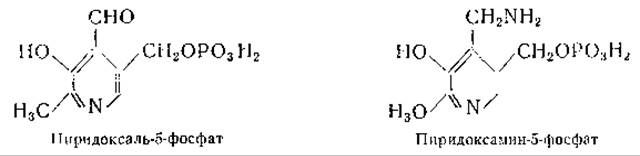
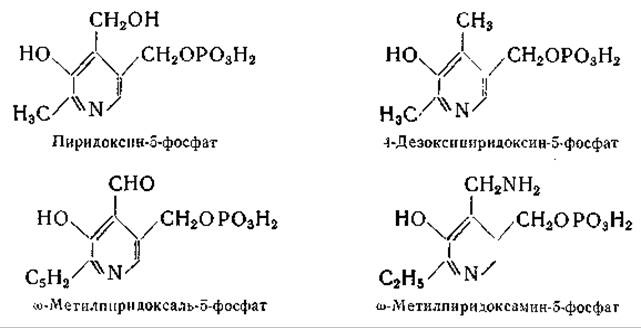
Пиридоксаль-3-фосфат, однозначный синтез которого был осуществлен Каррером и Висконтини [410], оказался не идентичным биологически активному продукту [411]. Другие исследования давали основание полагать, что фосфатная группа присоединена в положении 5 [412, 413]; наконец, однозначный синтез пиридоксаль-5-фосфата, осуществленный Бэддили и Мэтиасом [414], окончательно выяснил этот вопрос. Несомненно, что и при более ранних синтезах также были получены пиридоксаль-5-фосфат и пиридоксамин-5-фосфат, однако лишь последующие работы Каррера и сотрудников [415, 416] и Питерсона и Собера [417, 418] позволили получить чистые препараты этих соединений. Питерсон и Собер приготовили, кроме того, пиридоксин-5-фосфат, действуя на пиридоксамин-5-фосфат азотистой кислотой. Получены также 4-дезоксипиридоксин-5-фосфат, ω-метилпиридоксамин-5-фосфат и ω-метилпиридоксаль-5-фосфат [417, 419, 420].
Трансаминазы в отличие от прочих ферментов, содержащих витамин В6, характеризуются тем, что роль кофермента может выполнять как пиридоксаминфосфат, так и пиридоксальфосфат, тогда как в реакциях декарбоксилирования, рацемизации и в других реакциях, катализируемых В6-ферментами, витамин В6 проявляет каталитическое действие только в форме пиридоксальфосфата. Ранние исследования давали некоторое основание считать, что глутамат-аспартат-трансаминаза сердца свиньи активируется лишь пиридоксальфосфатом (но не пиридоксаминфосфатом) [263, 421]. Однако позднее было показано, что в данной системе активны оба кофермента [422]; в последующих работах найдено, что оба кофермента могут активировать и другие системы трансаминирования. Весьма интересно, что для проявления максимальной активности необходимо предварительное инкубирование фермента с коферментом до добавления субстрата (очевидно, требуется некоторое время для присоединения кофермента к ферменту). Для максимального активирования фермента пиридоксаминофосфатом необходима более длительная предварительная инкубация, чем при применении пиридоксальфосфата; это указывает на то, что аминная форма соединяется с белком фермента медленнее. Имеющиеся данные позволяют исключить возможность предварительного превращения пиридоксаминфосфата в пиридоксальфосфат в условиях данного эксперимента. Кофермент, очевидно, вступает с ферментом в прочную связь. Даже при многодневном диализе транс-аминазы, реконструированной с помощью пиридоксальфосфата или пиридоксаминфосфата, активность фермента не уменьшалась [422].
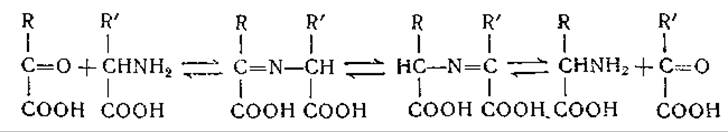
Механизм ферментативного переаминирования может быть выражен следующими уравнениями (ПЛФ и ПМФ обозначают соответственно пиридоксальфосфат и пиридоксаминфосфат)
![]()
Попытки непосредственно показать взаимопревращение пиридоксаминфосфат-фермент а и пиридоксальфосфат-фермента до сих пор были безуспешными1, по-видимому, вследствие ряда экспериментальных трудностей, обусловленных тем, что в соединение с ферментом вступает лишь очень небольшое количество кофермента и при этом отсутствует достаточно хороший метод количественного отщепления и определения связанного с ферментом кофермента. Задача осложняется еще и тем, что добавленный синтетический кофермент может присоединяться к белковой молекуле фермента не только там, где он необходим для проявления ферментативной активности, но и в других ее участках. Исследования с применением кофермента, меченного радиоактивным фосфором, позволили обнаружить неспецифическое связывание значительного количества кофермента, обусловленное (по крайней мере отчасти) образованием шиффовых оснований из кофермента и свободных аминогрупп белка.
1 Это взаимопревращение убедительно доказано в опытах с высокоочищенным препаратом глутамат-аспартат-трансаминазы [W. Т. Jenkins, J. W. Sizer, J. Am. Chem. Soc., 79, 2655 (1957); J. Biol. Chem., 235, 62Ó (i960)]. — Прим. ped.
Образование пиридоксальфосфата из пиридоксаля и аденозинтрифосфата впервые исследовали Ганселус и сотрудники [393, 396] с применением тирозиндекарбоксилазной системы Streptococcus faecalis. Пиридоксалькиназа недавно выделена из дрожжей [423]; найдено, что она катализирует следующую реакцию:
![]()
Этот фермент, для действия которого необходимо присутствие ионов металла (например, Со++, Mg++, Fe++), широко распространен; помимо дрожжей, он найден также у Escherichia coli [423], в мозге [424] и в печени [425]. Система фосфорилирует пиридоксаль, пиридоксамин, пиридоксин, 4-дезоксипиридоксин и ряд других аналогов витамина В6. Найдено, что 4-дезоксипиридоксин тормозит тирозиндекарбоксилазу Streptococcus faecalis; торможение, по-видимому, обусловлено конкуренцией указанного аналога витамина В6 с фосфопиридоксалем за аподекарбоксилазу [426—428]. Инкубирование глутамат-аспартат-трансаминазы сердца свиньи с 4-дезоксипиридоксинфосфатом препятствует активированию фермента при последующем инкубировании с пиридоксаминфосфатом или пиридоксальфосфатом [422]. Однако после полного реактивирования апотрансаминазы путем инкубирования с одним из двух коферментов 4-дезоксипиридоксин уже не оказывает тормозящего действия. Аналогичные результаты были получены с пиридоксинфосфатом, который не проявляет активности в качестве кофермента трансаминазы, но оказывает тормозящее действие примерно того же характера и той же степени, что и 4-дезоксипиридоксин: фосфат. Тормозящее действие пиридоксинфосфата указывает на возможность торможения трансаминазы в тканях в результате восстановления формильной группы пиридоксальфосфата, входящего в состав молекулы фермента; к инактивированию может приводить также окисление связанного кофермента в фосфорный эфир пиридоксиловой кислоты.
ω-Метилпиридоксаль и ω-метилпиридоксамин могут обеспечивать рост S. faecalis взамен витамина В6 в условиях, когда аминокислоты синтезируются из соответствующих а-кетокислот; это дало основание предположить, что фосфорилированные ω-метилпроизводные витамина В6 могут проявлять активность в качестве коферментов трансаминаз. Позднее было показано, что ω-метилпиридоксальфосфат активирует трансаминазы S. faecalis, однако сродство апоферментов к аналогу ниже, чем к естественному коферменту [429]. Весьма интересно, что замещение метильной группы пиридоксаля этильной группой не сопровождается полной потерей активности. В системе аланинрацемазы активность ω-метилпиридоксальфосфата значительно ниже, чем пиридоксальфосфата, а в системе цистеиндесульфгидразы он, по-видимому, совсем лишен активности.
ω-Метилпроизводные витамина В6 в отличие от множества других аналогов витамина В6 [430—433] оказывают некоторое стимулирующее действие на рост в отсутствие витамина В6. Так, (ω-метилпиридоксаль, ω-метилпиридоксин и ω-метилпиридоксамин не только действуют как факторы роста для бактерий [429], но и способствуют росту крыс, получающих рацион с недостаточным содержанием витамина В6. Однако через несколько недель скорость роста снижается до величин, близких к скорости роста контрольных (авитаминозных) животных или даже более низких. Результаты этих исследований можно объяснить тем, что ω-метилпиридоксальфосфат способен действовать как антагонист в одних ферментных системах и как активатор — в других [434].
Представление о том, что механизм ферментативного переаминирования включает обратимое образование шиффовых оснований с участием альдегидной и аминной формы витамина В6, сложилось на основании изучения неферментативных реакций переаминирования между амино- и кетокислотами [249, 250] и дальнейшего развития этих исследований в опытах с пиридоксалем и пиридоксамином. Было найдено, что многие аминокислоты вступают в реакции неферментативного переаминирования с пиридоксалем в присутствии ионов меди, железа или алюминия при 100°, причем эта реакция оказалась обратимой [387, 435—437]:
![]()
Реакция между пиридоксалем и аланином была изучена довольно подробно, и спектрофотометрическим методом установлено образование двух шиффовых оснований в качестве промежуточных продуктов [438]. При помощи хроматографии на бумаге осуществлено разделение этих промежуточных соединений [439]. Менее успешными были попытки обнаружить действие ионов металла при следующей реакции [436]:
![]()
Согласно некоторым данным, эта реакция в известной мере активируется солями алюминия и железа. Потребность в ионе металла при неферментативном переаминировании была установлена для нескольких систем, однако для реакции между глиоксиловой кислотой и аминокислотами, легко протекающей при 25°, ионы металлов, по-видимому, не нужны [291]. Участие металлов в ферментативном переаминировании не установлено.
Представление об образовании шиффовых оснований при реакциях переаминирования согласуется с данными об обмене дейтерия при этих реакциях [257, 260, 440—443]. В молекуле глутаминовой кислоты, образующейся при ферментативном переаминировании между а-кетоглутаровой и аспарагиновой кислотами в присутствии D2О, содержится около одного атома дейтерия [440, 444]. Водород аспарагиновой кислоты также замещается дейтерием в процессе ферментативного переаминирования. Обмен а-водородного атома аминокислот при переаминировании связан, как видно, с действием фермента; если из системы исключить а-кетоглутаровую кислоту, то обменивается менее 6% а-водорода аспарагиновой кислоты. Различными путями установлено, что ß-водородный атом аминокислот не участвует в реакциях переаминирования. В лейцине, выделенном из тканей крыс после скармливания им лейцина, меченного дейтерием в a-, β- и у-положениях, разведение метки водородных атомов в положениях ß и у было почти одинаковым, что указывает на отсутствие заметного обратимого а, ß-дегидрирования [445]. Другое наблюдение, согласующееся с этим выводом, заключается в том, что при обратимом ферментативном трансаминировании между L-изолейцином и а-кетоглутаровой кислотой образуется чистая L-a-кето-β-метилвалерьяновая кислота; в тех же условиях из L-алло-изолейцина образуется D-а-кето-β-метилвалерьяновая кислота [129, 130]. Если бы в процессе переаминирования происходило обратимое дегидрирование в а- и ß-положении, то должна была бы образоваться рацемическая а-кетокислота. Далее, найдено, что ферментативное переаминирование между ß-дейтеро-а-кетоглутаровой кислотой и аланином не сопровождается заметной потерей дейтерия, т. е. количество дейтерия в образующейся глутаминовой кислоте почти равно количеству его в исходной а-кетоглутаровой кислоте [446].
Изотопными методами установлено переаминирование между аминокислотой и соответствующей ей а-кетокислотой [444, 447]. Обнаружено, в частности, переаминирование между аланином и С14-пировиноградной кислотой и между С13-глутаминозой кислотой и а-кетоглутаровой кислотой. Из этих данных следует, что в системе, включающей две а-кетокислоты и аналогичные им аминокислоты, происходят реакции переаминирования между молекулами с идентичной углеродной цепью; за счет этого должны снижаться количества вновь образующихся амино- или кетокислот. Такой эффект снижения скорости переаминирования был установлен экспериментально [448].
Исследования с применением субстратов, меченных N15, показали, что аммиак не является промежуточным продуктом при ферментативном переаминировании [318], и тем самым окончательно подтвердили первоначальное представление о природе этой реакции [251]. Было найдено, что в среде, содержащей немеченый ион аммония, аминокислоты, меченные N15, непосредственно передают свою аминогруппу а-кетоглутаровой кислоте [318].
Близкое сходство между реакциями ферментативного и неферментативного переаминирования и обнаружение роли пиридоксальфосфата в качестве кофермента во многих других ферментных системах привели к разработке представлений об общности механизма реакций, катализируемых витамином В6. Мецлер и сотрудники [435] и Браунштейн и Шемякин [449] независимо друг от друга выдвинули одну и ту же, в основных чертах, теорию. Согласно представлениям этих авторов, из пиридоксаля, аминокислоты (и иона металла) образуется шиффово основание; реакции, катализируемые витамином В6, интерпретируются как результат различных последовательных перемещений электронов в молекулах промежуточных соединений. Например, Мецлер и сотрудники [435] сформулировали для реакций переаминирования следующий механизм:
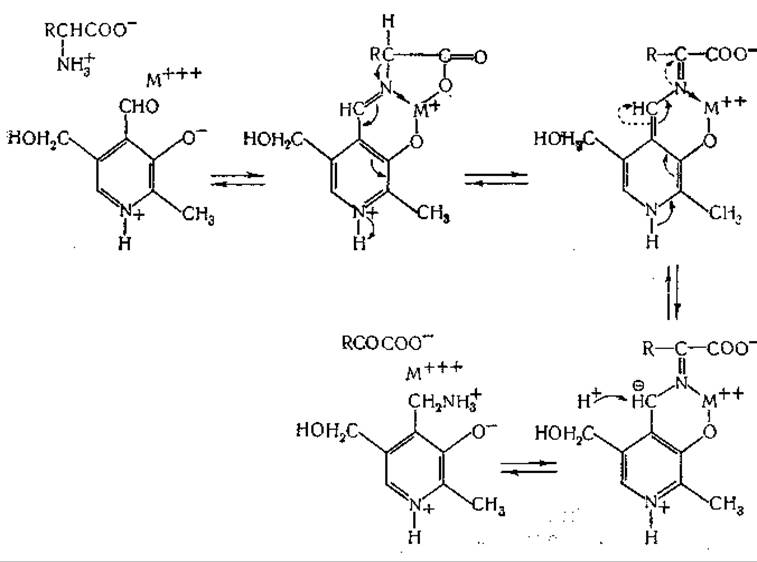
Далее, предложена указанная ниже схема реакции рацемизации аминокислот:
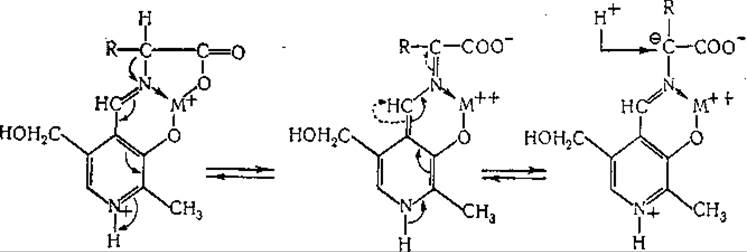
Разработаны также схемы механизма декарбоксилирования, отщепления заместителей в ß-положении (дегидратазы серина и треонина, триптофаназа, аллииназа, цистатионаза), присоединения ß-заместигелей (синтез триптофана, образование цистатионина), расщепления y-замещенных аминокислот (десульфгидраза гомоцистеина, дегидратаза гомосерина), синтеза и расщепления треонина (на глицин и ацетальдегид) и серина (на глицин и формальдегид) [435, 449]. Постулировано образование клешневидного комплекса металла с пиридоксалем и аминокислотой в качестве общего промежуточного продукта при целом ряде реакций [435]. Эти механизмы обсуждаются в соответствующих разделах гл. IV. Манделес и сотрудники [246] показали, что при ферментативном декарбоксилировании аминокислот один водородный атом остается связанным с а-углеродным атомом. Они нашли, что в аминах, образуемых при ферментативном декарбоксилировании лизина, глутаминовой кислоты и тирозина в среде, содержащей 99,8% D2O, на молекулу приходится лишь один атом дейтерия, причем он расположен исключительно у того углеродного атома, который являлся а-углеродом исходной аминокислоты. Обращение реакции декарбоксилирования также сопровождается включением дейтерия [244, 245]. Согласно данным упомянутых авторов, при этом происходит асимметрическое включение дейтерия, приводящее к образованию одного оптического изомера дейтерированного амина. Ханке и сотрудники [450, 451] путем воздействия глутамат-рацемазы на глутаминовую кислоту приготовили а-дейтеро-DL-глутаминовую кислоту. Этот продукт был декарбоксилирован ферментативно в среде Н2O образованием одного из изомеров
дейтеро-у-аминомасляной кислоты:
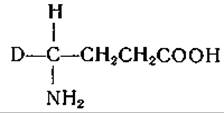
Этот изомер не теряет своего дейтерия при обработке глутаматдекарбоксилазой в водном растворе. Другой изомер дейтеро-y-аминомасляной кислоты был получен при декарбоксилировании L-глутаминовой кислоты в среде D2O; этот изомер в присутствии декарбоксилазы обменивает свой дейтерий на водород воды. Данные, полученные Ханке и его сотрудниками, находятся в согласии с механизмом декарбоксилирования, включающим следующие промежуточные фазы:
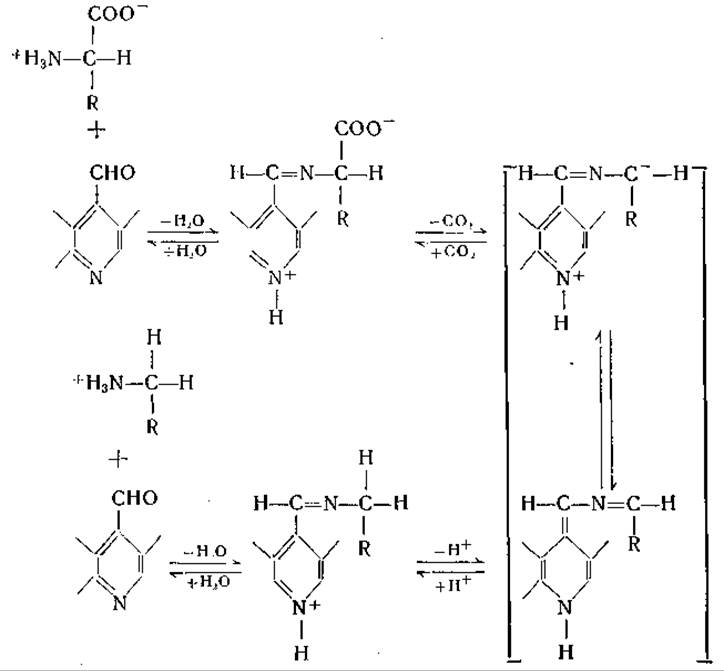
Витамин B6участвует, по-видимому, во всех реакциях переаминирования. То обстоятельство, что некоторые трансаминазы не требуют добавления этого кофермента для обеспечения максимальной активности, объясняется тем, что он в этих случаях прочно связан с ферментом. Не исключена возможность, что реакции переаминирования, в которых участвуют альдегиды (например, глиоксиловая кислота), могут протекать без витамина В6; такие реакции были осуществлены в неферментативных системах, однако до настоящего времени не получено бесспорных данных, подтверждающих существование трансаминаз, не содержащих витамина В6. Все аминокислотные декарбоксилазы, которые явились предметом тщательного изучения, также действуют при участии пиридоксальфосфата. Сперва предполагали, что для действия гистидиндекарбоксилазы витамин В6 не нужен [452], но затем было установлено, что и у этого фермента коферментом является пиридоксальфосфат [453]. Аспартат-β-декарбоксилазу Clostridium welchii удается активировать пиридоксальфосфатом или а-кетокислотами. Активирующее действие а-кетокислот было отнесено за счет реакции переаминирования между этими кислотами и содержащимся в ферментном препарате пиридоксаминфосфатом с образованием пиридоксальфосфата (стр. 208).
Многообразие реакций, для которых необходим витамин В6, свидетельствует о первостепенном значении этого витамина в процессах обмена аминокислот и дает основание полагать, что при В6-авитаминозе должны возникать различные нарушения обмена. Опубликована обширная серия исследований над В6-авитаминозными крысами [454—459]. Помимо ожидаемого изменения активности тканевых трансаминаз, при недостаточности витамина В6 было отмечено повышенное содержание мочевины в крови и пониженное содержание глутамина в кровяной плазме. Введение L-глутаминовой кислоты и L-лизина приводит к стойкому повышению содержания мочевины в крови.
Истолкование этих фактов затруднительно не только из-за множественности функций витамина В6, но также ввиду неодинаковой степени сродства различных пиридоксалевых ферментов к коферменту. Интересно отметить, что при определенных условиях возможен рост бактерий в отсутствие добавленного витамина В6; однако не исключена возможность синтеза небольших количеств витамина микроорганизмами.
Витамин В6, вероятно, участвует и в действии других ферментных систем, помимо описанных выше. Так, например, недавно найдено, что пиридоксальфосфат принимает участие в синтезе гема [460, 706]; это открытие проливает свет на развитие анемии у животных при недостаточности витамина В6. Вопрос о возможном участии витамина В6 в процессах переноса аминокислот рассмотрен в первом разделе этой главы.