Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Энергетика биохимических реакций
Термодинамика
Суммирование изменений свободной энергии
Важной особенностью термодинамических расчетов является то, что ∆G для совокупности нескольких химических реакций попросту равно сумме значений ∆G для отдельных реакций [см. уравнения (3-16) — (3-19)]. То же относится к ∆Н и ∆S.
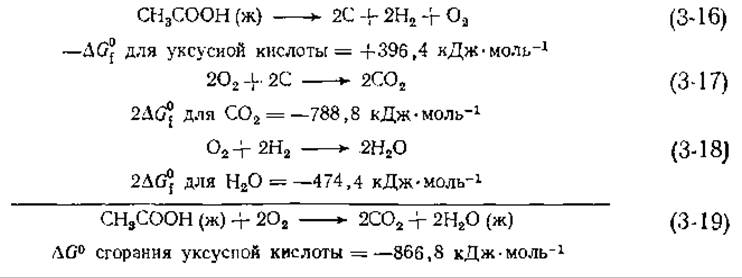
В этом примере уравнение (3-16) разложения уксусной кислоты на элементы суммируется с уравнениями (3-17) и (3-18), описывающими образование нужного числа молекул СО2 и Н2О. Суммирование этих трех уравнений дает уравнение сгорания уксусной кислоты с образованием СО2 и воды, а сумма значений ∆G для каждого из трех уравнений дает ∆G сгорания уксусной кислоты. Заметим, что полученное в результате значение ∆G соответствует сгоранию чистой жидкой уксусной кислоты в кислороде при давлении в 1 атм, а в качестве продуктов образуются СО2 при давлении в 1 атм и чистая жидкая вода — и реагенты, и продукты находятся в стандартном состоянии.
Описанную выше процедуру можно представить уравнением (3-20) — общим уравнением, позволяющим рассчитать ∆G0любой реакции, зная ∆G продуктов и реагентов:
![]()
Как меняется приращение свободной энергии при переходе соединения от стандартного к какому-либо другому состоянию? Рассмотрим случай, когда меняется давление газа. Легко показать (см. любой учебник термодинамики), что
(dG/dP)T = V. (3-21)
Используя уравнение (3-21) совместно с уравнением состояния идеального газа, получим соотношение между свободной энергией ![]() 1 моля вещества1 при давлении Р и стандартной свободной энергией
1 моля вещества1 при давлении Р и стандартной свободной энергией ![]() при давлении Р0:
при давлении Р0:
![]()
Поскольку Р0 по определению равно 1 атм, изменение свободной энергии 1 моля вещества при изменении давления от Р0 до Р просто равно RTlnP. Обычно в термодинамике вывод наиболее важных термодинамических уравнений иллюстрируется на примере идеальных газов, однако применительно к биохимическим системам более близким примером являются растворы.
1 Черточка над символами G или ∆G всегда указывает, что свободная энергия или ее изменение относятся к 1 молю вещества.