Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Энергетика биохимических реакций
Таблицы значений ∆G0 для биохимических соединений
Свободная энергия сгорания в присутствии O2 и NAD+
Ввиду исключительной важности процессов окисления для метаболизма у аэробных организмов часто бывает весьма полезно знать свободную энергию сгорания того или иного соединения. Эти данные легко получить из свободной энергии образования. Например, ∆Gc ацетата (води) можно найти следующим образом:
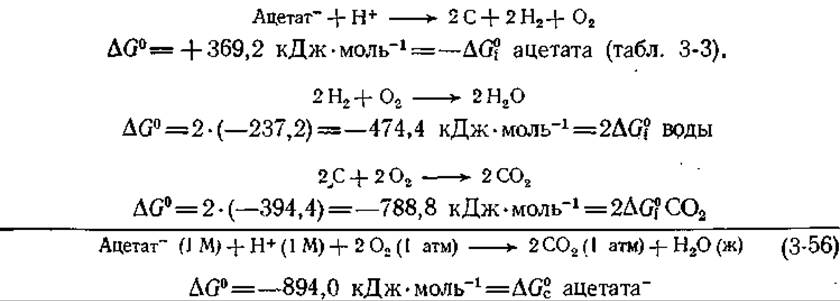
В табл. 3-3 наряду со значениями ∆G0 приведены и значения ∆G2.
Очень многие процессы окисления в клетках идут с участием особого окислителя никотинамидадениндинуклеотида (NAD+) или родственного ему соединения NADP+ (гл. 8). Поэтому удобно иметь таблицы значений ∆G0 для полного окисления соединений до СO2, происходящего под действием не O2, a NAD+1. Эти значения, обозначенные ∆G0ox и ∆G'ox(pH 7), тоже приведены в табл. 3-3. Обратите внимание, что значения эти сравнительно малы и, следовательно, окисление с участием NAD+ дает клеткам мало энергии. Рассмотрим, например, такую реакцию:
![]()
1 Близкий подход применили Деккер и др. [22].
Когда NADH, образовавшийся в результате восстановления NAD+, снова окисляется в митохондриях [уравнение (3-58)], клетки получают большое количество энергии:
![]()
Уравнения (3-57) и (3-58) в сумме дают уравнение сгорания ацетата в O2, а два значения ∆С в сумме равны ∆Gc ацетата-.
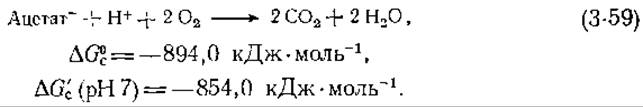
Значения ∆Gox (табл. 3-3) не только сразу дают относительное количество энергии, высвобождаемой при окислении субстратов с участием NAD+, но и оказываются весьма удобными для оценки ∆G реакций брожения. Рассмотрим, например, процесс сбраживания глюкозы в этанол:
![]()
Изменение свободной энергии ∆G' (pH 7) для сбраживания глюкозы с образованием этанола и СO2 можно сразу получить из табл. 3-3:
∆G'(pH7) =—243,8—2∙(—4,6) = —234,6 кДж∙моль-1 (3-61)
(значения ∆Goxдля Н2O, СO2 и Н+ всегда равны нулю). Те же вычисления можно проделать, используя значения ∆G0c, (что неудобно, поскольку они слишком велики) или ∆G0f. Последние тоже достаточно велики, к тому же надо вводить в расчеты данные для СO2 и воды. С помощью табл. 3-3 можно получить значения ∆G0для многих метаболических реакций, которые мы рассмотрим далее. Для этой цели подходят данные любой из колонок таблицы, но для простоты лучше пользоваться значениями ∆G'ox.
Заметим, однако, что для реакций окисления под действием кислорода или любого другого окислителя, отличного от NAD+ и не включенного в табл. 3-3, нельзя использовать непосредственно значения ∆Gox. В этом случае поступают следующим образом. Сначала из значений ∆Goxрассчитывают ∆G0или ∆G' для рассматриваемой реакции, считая, что окислителем является NAD+, а затем к полученному значению прибавляют свободную энергию окисления кислородом (или другим окислителем) образовавшегося NADH. Такого типа величины для O2 приведены в табл. 3-7; основываясь на данных этой таблицы, можно оценить их значение и для ряда других окислителей, таких, как Fe3+ и цитохром с.