Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Энергетика биохимических реакций
Электродные потенциалы и изменение свободной энергии для окислительно-восстановительных реакций
Измерение электродных потенциалов
Для измерения электродного потенциала нужно, чтобы окислитель сопряженной окислительно-восстановительной пары мог восстанавливаться потоком электронов [уравнение (3-62)], «стекающих» с поверхности электрода, во многих случаях покрытого слоем специально обработанной платины.
![]()
Уравнение (3-62) описывает реакцию, протекающую на одном электроде. Электрохимический элемент имеет два электрода, и полная реакция является суммой двух полуреакций. Электродный потенциал данной полуреакции определяется путем измерения электродвижущей силы, создаваемой элементом, в котором одна из полуреакций протекает на стандартном электроде с известным потенциалом. На рис. 3-3 схематически изображена экспериментальная система для измерения электродного потенциала. Стандартный водородный электрод представляет собой платиновый стержень, заключенный в стеклянную трубку, через которую подается газообразный водород под давлением 1 атм. Электрод погружен в раствор, содержащий ионы водорода с единичной активностью (аН+ = 1). Потенциал этого электрода условно принят за нуль. На практике в качестве стандартного электрода чаще всего используют каломельный или какой-либо другой электрод с точно известным, постоянным потенциалом. Цепь между растворами, куда погружены электроды, замыкается с помощью мостика, заполненного электролитом. В исследуемом полуэлементе на поверхности другого электрода (чаще всего платинового) протекает реакция, описываемая уравнением (3-62). Разность потенциалов между двумя электродами регулируется потенциометром. Вычитая из этой разности потенциалов потенциал стандартного электрода, получают электродный потенциал исследуемой окислительно-восстановительной пары. Важно, чтобы интересующая нас электродная реакция была полностью обратима. Передвигая движок потенциометра таким образом, чтобы электродвижущая сила (э. д. с.) исследуемой системы была точно уравновешена внешним источником напряжения, можно добиться того, чтобы ток через элемент стал равен нулю. Если реакция обратима, то небольшое изменение напряжения приведет к тому, что через элемент пойдет ток. Повышая или понижая напряжение, можно изменять направление тока.
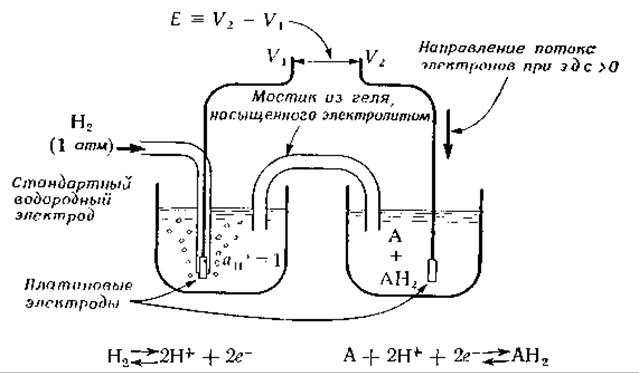
РИС. 3-3. Устройство для измерения электродных потенциалов. Внизу приведены уравнения реакций, протекающих в каждом из полуэлемеитов. Максимальная электрическая работа, которую может выполнить такой элемент над окружением, равна —∆С = nЕF, где Е = V2—V1 (разность потенциалов, измеренная с помощью потенциометра). Если вещество А, реагируя с Н2, восстанавливается до АН2, электроны во внешней цепи будут течь в направлении, указанном на рисунке. При этом в правом полуэлементе будет идти восстановление А, а в левом Н2 будет окисляться до Н+. Протоны будут перетекать слева направо через мостик из геля, насыщенного электролитом, выполняя роль носителей тока во внутренней цепи.
Обратимость реакции имеет место не для всех окислительно-восстановительных пар. Особенно это относится к органическим соединениям: например, для пары альдегид — спирт прямо измерить электродный потенциал невозможно. В ряде случаев, в частности при работе с ферментами, помогает добавление в систему легко восстанавливаемого красителя с потенциалом, близким к потенциалу измеряемой сопряженной пары (список соответствующих красителей приводится в работе [23]). Если краситель может легко обмениваться электронами с измеряемой парой, то удается прямо измерить электродный потенциал. Во многих случаях электродные потенциалы, указываемые в таблицах, рассчитываются по данным для свободных энергий (многие из потенциалов, указанных в табл. 3-7, можно рассчитать из данных, приведенных в табл. 3-3; советуем читателю проверить это). Когда в исследуемой системе А, Н+ и АН2 имеют единичные активности, наблюдаемый потенциал полуреакции представляет собой стандартный электродный потенциал Е0. Если э. д. с. гипотетической электродной системы, в которую входит стандартный водородный электрод, оказывается положительной, когда ток течет в направлении, указанном стрелкой на рис. 3-3, то потенциал сопряженной пары А/АН2 также считается положительным (его часто называют восстановительным потенциалом) Именно такому предположению соответствуют данные табл. 3-7, однако следует иметь в виду, что некоторые химики используют такие же по абсолютной величине, но противоположные по знаку окислительные потенциалы. Во избежание путаницы рекомендуем запомнить значение одного-двух потенциалов, например потенциалов пар O2—Н2O и NAD+—NADH.
Таблица 3-7 Восстановительные потенциалы некоторых биологически важных система,б
|
Полуреакция |
Е0, В |
Е0' (pH 7), В |
—∆G' (pH 7) для окисления кислородом (в расчете на два электрона), кДж∙моль-1 |
|
O2 + 4Н+ + 4е- —> 2Н2O |
+ 1,229 |
+0,815 |
0,0 |
|
Fe3+ + e- —> Fe2+ |
0,771 |
0,771 |
8,5 |
|
NO-3 + 2Н+ + 2е- —>NO2+ Н2O |
0,421 |
76,0 |
|
|
Цитохром f (Fe3+) + e- —> Цитохром f (Fe2+) |
0,365 |
86,8 |
|
|
Fe(CN)3-6(феррицианид) + e- —> Fe(CN)4-6 |
0,36 |
87,8 |
|
|
O2 + 2H+ + 2e- —> H2O2 |
0,709 |
0,295 |
100,3 |
|
Цитохром a (Fe3+) + e- —> Цитохром a (F2+) |
0,29 |
101,3 |
|
|
n-Хинон + 2Н+ + 2е- —>Гидрохинон |
0,699 |
0,285 |
102,3 |
|
Цитохром c (Fe3+) + е- —> Цитохром с (Fe2+) |
0,254 |
108,3 |
|
|
Адренодоксин (Fe3+) + e- —> Адренодоксин (Fe2+) |
0,15 |
128,3 |
|
|
Цитохром b2 (Fe3+) + e- —> Цитохром b2 (Fe2+) |
0,12 |
134,1 |
|
|
Убихинон + 2Н+ + 2е- —> Убихинон ∙ Н2 |
0,10 |
138,0 |
|
|
Цитохром b (Fe3+) + е- —> Цитохром b (Fe2+) |
0,075 |
142,8 |
|
|
Дегидроаскорбиновая кислота + 2Н+ + 2е- —> Аскорбиновая кислота |
0,058 |
146,1 |
|
|
Фумарат2- + 2Н+ + 2е- —> Сукцинат2- |
0,031 |
151,3 |
|
|
Метиленовый синий + 2Н+ + 2е- —> Лейкометиленовый синий (бесцветный) |
0,011 |
155,2 |
|
|
Кротонил-СоА + 2Н+ + 2е- —> Бутирил-СоА |
—0,015 |
160,2 |
|
|
Глутатион + 2Н+ + 2е- —> Дважды восстановленный глутатион |
—0,10 |
176,6 |
|
|
Оксалоацетат2- + 2Н+ + 2е- —> Малат2- |
—0,166 |
189,3 |
|
|
Пируват- + 2Н+ + 2е- —> Лактат2- |
—0,185 |
193,0 |
|
|
Ацетальдегид + 2Н+ + 2е- —> Этанол |
—0,197 |
195,3 |
|
|
Рибофлавин + 2Н+ +2е- —> Дигидрорибофлавин |
—0,208 |
197,4 |
|
|
Ацетоацетил-СоА + 2Н+ + 2е- —> ß-Оксибутирил-СоА |
—0,238 (38 °С) |
203,2 |
|
|
S + 2H+ + 2e- —>H2S |
0,14 |
—0,274 |
210,2 |
|
Липоевая кислота + 2Н+ +2е- —> Дигидролипоевая кислота |
—0,29 |
213,2 |
|
|
NAD+ + H+ + 2e- —> NADH |
—0,113 |
—0,32 |
219,0 |
|
NADP+ + H+ + 2e- —> NADPH |
—0,324 |
219,8 |
|
|
Ферредоксин (Fe3+) + e- —> Ферредоксин (Fe2+) (Clostridia) |
—0,413 |
237,0 |
|
|
2Н+ + 2е- —> H2 |
0 |
—0,414 |
237,2 |
|
СО2 + Н+ + 2е- —> Формиат- |
—0,42 (30 °С) |
238,3 |
|
|
Ферредоксин (Fe3+) + e- —> Ферредоксин (Fe2+) (шпинат) |
—0,432 |
240,6 |
a Соединение с более положительным потенциалом будет окислять восстановленную форму вещества с более низким потенциалом с изменением стандартной свободной энергии ∆С0 =—nF∆Е0 =—n∆E0∙96,49 кДж∙моль-1, где n — число электронов, передаваемых от восстановителя к окислителю. Если нет специального указания, температура считается равной 25 °С. Е0 относится к стандартному состоянию, при котором активность водородных ионов равна 1; Е0' относится к стандартному состоянию при pH 7, при котором все остальные активности равны единице.
б Основной источник данных: Loach Р. A., in: Handbook of Biochemistry and Molecular Biology, 3rd ed., Vol. I (G. D. Fasman, ed.), pp. 122—130, © CRC Press, Inc., Cleveland, 1976.
Максимальная работа (—∆G), которую может совершить поток электронов во внешней цепи, обусловленный электрохимической реакцией (в расчете на моль вещества), есть
—∆G = nEF = (nE ∙ 96,487) кДж∙моль-1 =
= (nE ∙ 23,061) ккал∙моль-1, (3-63)
где F — заряд моля электронов в кулонах1 (заряд электрона, помноженный на число Авогадро, т. е. 96 487 кулонов), а Е — измеренная разность электродных потенциалов двух полуэлементов (в вольтах). Если одним из полуэлементов является стандартный водородный электрод, то E — электродный потенциал сопряженной пары. Число молей электронов, перенесенных в ходе реакций («), для обычных биохимических реакций равно 1 или 2 [в уравнении (3-62) оно равно 2].
Поскольку реагенты и продукты не всегда имеют единичную активность, нам нужно найти зависимость наблюдаемого электродного потенциала от Е0 и активностей (концентраций) А, АН2 и Н+. Эта зависимость имеет следующий вид:
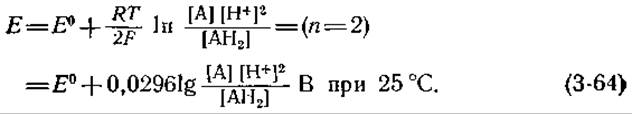
В биохимической литературе обычно вместо E0 приводят значения кажущихся стандартных электродных потенциалов при pH 7 (E0', табл. 3-7, второй столбец). Заметьте, что Е0' (pH 7) для водородного электрода равно не 0, а —0,414 В. Связь между Е и Е0' определяется уравнением (3-64), в котором в числителе отсутствует сомножитель [Н+]2, поскольку в Е0' уже входит член с lg [Н+]. По шкале значений Е0' (pH 7) потенциал пары кислород — вода равен 0,815 В, а потенциал пары NAD+—NADH равен —0,32 В.