Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Энергетика биохимических реакций
Линейные соотношения, в которые входит свободная энергия
Органические функциональные группы определенным образом влияют на распределение электронов в тех группах, к которым они присоединены. Выражение этих эффектов в виде линейных соотношений, в которые входит свободная энергия, позволяет получить весьма полезную связь между определенными химическими свойствами. Наиболее известным из таких линейных соотношений является уравнение Гаммета, которое связано с передачей влияния на распределение электронов через бензольные и другие ароматические кольца. Рассмотрим константы диссоциации соединений трех классов:
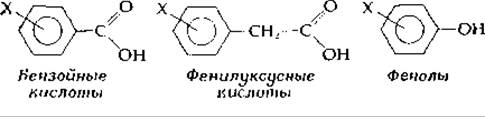
В табл. 3-8 приведены значения рКа как для исходных соединений, так и для их мета-хлор- и мета-нитрозамещенных производных.
Напомним, что рКа — это отрицательный логарифм константы диссоциации. Как следует из уравнения (3-30), рКа прямо пропорционально ∆G0 для диссоциации протонов. Гаммет рассматривает различия в рКа. Замещение атома водорода, стоящего в мета-положении бензойной кислоты, на Сl или NО2-гpyппy, «оттягивающие» на себя электроны, снижает рКа, т. е. основность сопряженного основания. Уменьшение рКа составляет —0,365 и —0,742 для мета-хлорбензойной и мета-нитробензойной кислот соответственно. Утверждение Гаммета состоит в том, что это изменение рКа является мерой способности мета-заместителя оттягивать на себя электроны [32]. Таким образом, NО2-гpyппa в этом отношении почти вдвое превосходит Сl. Численные значения изменений константы диссоциации бензойной кислоты определяют константу замещения а, которая входит в уравнение Гаммета (табл. 3-9).
рК0 — рК = σ (для замещенной бензойной кислоты). (3-65)
Таблица 3-8 Значения рКа для незамещенных и замещенных бензойных кислот, фенилуксусных кислот и фенолов
|
Метла-замещение |
Бензойные кислоты3 |
Фенилуксусные кислоты |
Фенолы |
|
—Н (исходное соединение) |
4,202 |
4,31 |
9,92 |
|
—Сl |
3,837 |
4,13 |
9,02 |
|
—NO2 |
3,460 |
3.97 |
8,39 |
а Значения рКа для замещенных бензойных кислот недавно приведены в статье Bolton Р. D., Fleming К. A., Hall F. М., JACS, 94, 1033—1034, 1972. Вычисленные исходя из них значения σ немного отличаются от тех, что приведены в табл. 3-9.
Уменьшение рKа фенилуксусной кислоты, вызванное замещением мета-водорода на Cl или NO2, составляет соответственно —0,18 и —0,34, что существенно меньше, чем для бензойной кислоты. Для фенолов же эти различия достигают —0,90 и —1,53, т. е. гораздо больше, чем для бензойной кислоты. Согласно уравнению Гаммета (3-66)1, для таких реакций, как диссоциация протонов в фенилуксусных кислотах и фенолах, изменение ∆G, вызванное мета-замещением, пропорционально σ, т. е. изменению ∆G в ходе стандартной реакции диссоциации протона бензойной кислоты [32—34].
lg (К/К0) = РК0 — рК = рσ. (3-66)
Фигурирующий в уравнении коэффициент пропорциональности является мерой «чувствительности» реакции к присутствию замещающих групп, способных отдавать или принимать электроны. Для бензойной кислоты р принято равным 1,00. По данным табл. 3-8, а также согласно многим другим данным, для фенилуксусных кислот среднее значение р = 0,49; для фенолов р = 2,23, а для отщепления протонов от замещенных пиридиниевых ионов р = 5,7. Чувствительность к замещению оказывается самой высокой (р максимально) в последнем случае, когда диссоциирует протон, присоединенный непосредственно к атому кольца, и самой низкой, когда протон наиболее удален от кольца (фенил-уксусная кислота).
1 Это уравнение может быть записано в более общем виде [32]: lg kij—lgk0 = pjσi, где k может быть либо константой равновесия, либо константой скорости. Индекс j соответствует рассматриваемой реакции, а і — замещению, оказывающему влияние на ход этой реакции.
Таблица 3-9 Константы замещения, входящие в уравнения Гаммета и Тафтаа
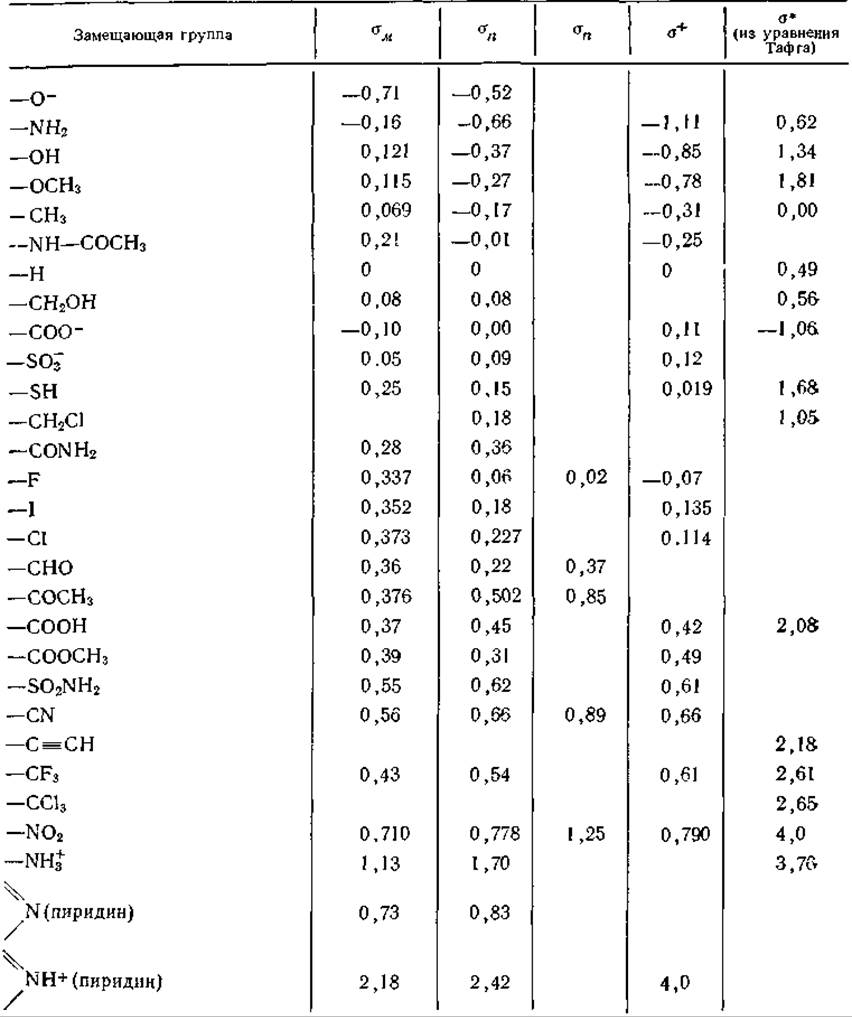
а Источники данных: Hammett L. Р., Physical Organic Chemistry, 2nd ed., p. 356 McGraw-Hill, New York, 1970, Swain C G., Lupton E. C., Jr., JACS, 90, 4328—4337, 1968; Jaffe H. H., ibid., 77, 4445—4448, 1955; Barlin G. B., Perrin D. D., Q. Rev. Chem. Soc., 20, 75—101. 1966.
Зная p для данной реакции и имея таблицы значений а, можно предсказывать, как изменится рКа под влиянием той или иной замещающей группы. Во многих случаях многократные замещения дают аддитивный эффект;
Хотя приведенные здесь примеры касаются лишь диссоциации протонов, уравнение Гаммета справедливо и для многих других процессов. Более того, поскольку скорость реакции связана со свободной энергией активации, можно установить корреляцию между константами скорости (гл. 6, разд. Д.5.д).
Так как замещения в орто-, мета- и пара-положениях оказывают количественно разное влияние, то для каждого положения определяются свои значения σ. Заметим, что замещения в орто-положении сопровождаются дополнительными эффектами, поэтому таблицы значений σ обычно составляются только для мета- и пара-положений1 (σм и σn). Еще одно осложнение связано с тем, что некоторые реакции оказываются настолько чувствительными к пара-замещению, что возникает резонанс, охватывающий всю циклическую систему. Примером служит кислотная диссоциация фенолов. σn для нитрогруппы обычно составляет 0,778, но, чтобы правильно предсказать влияние паранитрогруппы на диссоциацию фенола, нужно взять σn, равное 1,25. Это значение σ обозначается через ![]()
Такое более сильное влияние замещения на нитрогруппу может быть обусловлено резонансом фенолят-иона:
![]()
(Кривые стрелочки указывает направление перехода электронов, приводящее к превращению одной резонансной формы в другую.) По аналогичным причинам для некоторых реакций приходится вводить σ+n —константы, отвечающие присоединению сильных электронодонорных замещающих групп, таких, как ОН, которые тоже могут вызвать резонанс в циклической системе. Так, σn для ОН-группы равно —0,37, а σ+n = —0,85 [35]. Для метоксильной группы (—OCH3) σn = —0,27, σ+n =—0,78 и σм = +0,12.
Наличие различных типов констант замещения усложняет применение уравнения Гаммета. Действительно, сейчас используется свыше 20 различных наборов значений σ. Для упрощения ситуации константы замещения выражают в виде суммы двух слагаемых; одно из них учитывает «полевые», или «индуктивные», эффекты, а другое — резонансные [35, 36]. Для конкретного заместителя в пара-положении константы замещения для некоторой серии реакций задаются следующим уравнением:
σ = fF + rR. (3-68)
В этом уравнении коэффициенты f и r являются параметрами, характеризующими серию реакций, a F и R соответствуют конкретной замещающей группе. Так, σn обычного уравнения Гаммета оказывается равной
σn = 0,56F + R. (3-69)
Значения R и F для некоторых замещающих групп даны в приводимой ниже таблице.
1 Для орто-замещения в литературе можно найти кажущиеся значения σ [34].
|
R |
F |
|
|
—NH2 |
—0,68 |
0,04 |
|
—OH |
—0,64 |
0,49 |
|
—ОСН3 |
—0,50 |
0,41 |
|
—СН3 |
—0,14 |
—0,05 |
|
—СООН |
+0,14 |
0,55 |
|
—NO2 |
+0,20 |
1,11 |
Группы расположены в порядке убывания количества отдаваемых ими электронов, создающих резонанс. Замещающие —СООН- и NО2-группы, имеющие положительные значения R, являются акцепторами электронов. Как видно из таблицы, все заместители, исключая метальную группу, дают электронакцепторный индуктивный эффект.
Значения σм в какой-то мере отражают нерезонансное влияние группы и поэтому отчасти коррелируют с F-компонентой, тогда как в основном коррелируют с R.
Существуют и другие линейные соотношения, включающие зависимость от свободной энергии; например, кислотность алифатических соединений связана с «константой полярного замещения по Тафту» σ* следующим уравнением:
lg (K/K0) = p*σ*. (3-70)
Хорошее приближение для оценки значений рКа дают уравнения (3-71) И (3-72) [34]:
![]()
Вопросы и задачи
1. а. Исходя из значения ∆G0 гидролиза сахарозы (табл. 3-5), рассчитайте константу равновесия
![]()
для 25 °С. Назовем эту реакцию гидролиза реакцией 1.
б. Устойчива ли сахароза в 1 М растворе? Объясните почему.
в. Если к 1 М раствору сахарозы добавлена кислота, катализирующая процесс гидролиза, какова будет конечная равновесная концентрация сахарозы? (Расчет проводите в предположении, что концентрации равны активностям.)
г. Реакцией 2 является гидролиз a-D-глюкозо-1-фосфата с образованием глюкозы и неорганического фосфата (P1). Используя значение ∆G0 этой реакции (табл. 3-5), рассчитайте константу равновесия.
д. Сахарозофосфорилаза из бактерий Pseudomonas saccharophila катализирует следующую реакцию (реакция 3):
Сахароза + Р1→ a-D-глюкозо-1-фосфат + Фруктоза.
Рассчитайте константу равновесия и изменение стандартной свободной энергии при 25 °С для реакции 3, исходя из полученных
выше значений констант равновесия реакций 1 и 2. Покажите, что ∆G0 реакции 3 равно ∆G0 реакции 1 минус ∆G0 реакции 2. е. Могут ли бактерии осуществлять реакцию 3 в две указанные ниже последовательные стадии? Объясните почему.
Сахароза → Глюкоза + Фруктоза,
Глюкоза + Фосфат → Глюкозо-1-фосфат.
2. Для каждой из приведенных ниже реакций укажите, в каком интервале находится константа равновесия — между 0,1 и 10 (т. е. около единицы), больше 100 или меньше 0,01. Считайте, что pH постоянно и равно 7,0.
а. 2ADP3- → АТР4- + АМР2-;
б. ATP3- + Глюкоза → Глюкозо-6-фосфат2- + ADP2- + Н+;
в. ADP2- + HРО2-4 + Н+ → АТР3-;
г. Глюкозо-6-фосфат2- → Фруктозо-6-фосфат2-;
д. Фосфоенолпируват3' + Глюкоза → Глюкозо-1-фосфат2- + Пируват-.
о. В результате сгорания в калориметрической бомбе при 25 °С (при постоянном объеме) 1 моля твердой мочевины с образованием воды (в жидком состоянии), углекислого газа и газообразного азота (N2) выделилось 666 кДж тепла. Рассчитайте ∆Н — изменение теплосодержания (энтальпии) реакции.
4. По данным табл. 3-3 рассчитайте ∆G' (pH 7) следующих реакций:
5. Какова ионная сила 0,2 М раствора NaCl? 0,2 М Na2SO4?
6. Отношение [ATP]/[ADP] для активно дышащей дрожжевой клетки равно ~10. При каком отношении [3-фосфоглицерат]/[1,3-дифосфоглииерат] в клетке фосфоглицераткиназная реакция (рис. 9-7; реакция 7) будет смещена в сторону синтеза 1,3-дифосфоглицерата (при 25 °С, pH 7)?
7. а. По данным табл. 3-7 определите константу равновесия реакции между малатом и метиленовым синим, предполагая, что все реагенты вначале присутствовали в равных концентрациях. Четко укажите, какому направлению реакции соответствует полученное значение изменения свободной энергии.
б. Рассчитайте процентное содержание восстановленной (лейко-) формы метиленового синего при pH 7 и температуре 25 °С в системе, электродный потенциал которой равен 0,065 В.
8. NAD+ является коферментом как пируватдегидрогеназы, так и этанолдегидрогеназы. Используя значение Е0' из табл. 3-5, рассчитайте изменение свободной энергии и константу равновесия реакции
Лактат- Ацетальдегид → Пируват- Этанол.
9. Рассмотрим окисление ацетата при 25 °С:
СН3СОО- (0,1 М) + 2О2 (г, 0,2 атм) + Н+(10-7М) → 2Н2О (ж) + 2СO2 (г).
а. Чему равно равновесное давление СO2, если реакция не сопряжена ни с какими другими реакциями?
б. Чему равно равновесное давление СО2, если реакция сопряжена с образованием 0,01 М АТР из 0,01 М ADP и НРО2-4 в цикле трикарбоновых кислот?
в. Какие выводы вы можете сделать из выполненных выше расчетов о возможности 100%-ной эффективности запасания энергии в виде АТР в ходе цикла трикарбоновых кислот?
г. Если давление СО2 равно 0,01 атм, какова будет эффективность запасания энергии в условиях, описанных в пункте б?
10. Константа равновесия приводимой ниже реакции, катализируемой АТР-креатинтрансфосфорилазой, была определена путем непосредственного химического анализа. Данные анализа представлены ниже. [Kuby S. A., Noltman Е. A., in: The Enzymes, 2nd ed. (P. D. Boyer, H. Lardy, K. Myrbäck, eds.), Vol. VI, pp. 515—602, Academic Press, New York, 1962].

а. Каковы значения ∆G°, ∆Н0 и ∆S0 реакции при 25°С?
б. Каковы значения ∆G', ∆Н' и ∆S' (pH 7) реакции при 25 °С?
в. Каковы значения ∆G', ∆Н' и ∆S' (pH 7) реакции гидролиза креатинфосфата при 25 °С?
11. В калориметре при 25 °С в 0,1 М фосфатном буфере (pH 7,4) в присутствии суспензии частичек, содержащих митохондриальную систему транспорта электронов, была проведена следующая реакция (Рое М., Gutfreund Н., Estabrook R. W., ABB, 122, 204—211, 1967):
![]()
Количество потребляемого кислорода непрерывно регистрировалось с помощью кислородного электрода. Температура контролировалась погруженной в раствор термопарой. Перед началом реакции в 29,0 мл буфера, содержащего O2, было добавлено 96 мкмолей NADH. Реакция оказалась очень близка к реакции нулевого порядка, скорость потребления О2 составляла 6,87 мкмоль∙мин-1, а скорость повышения температуры — 0,01171 град∙мин-1. Теплоемкость калориметра вместе с содержимым была равна 254,6 Дж∙К-1. Чему равно ∆Н рассматриваемой реакции? Указание: источником Н+ служил фосфатный буфер, имевший ∆Н диссоциации 5,4 кДж∙моль-1.
12. Изменения энтальпии и свободной энергии при 25 °С для приводимой ниже реакции даны в табл. 3-5:
АТР4- (1 М) + Н2O → ADP3- (1 М) + Н+ (10-7 М) + HPO2-4 (1 М).
а. Сколько тепла выделится при постоянных температуре и давлении, если реакция будет идти в пробирке и не будет совершаться никакой работы, помимо работы по увеличению объема Р∆V?
б. Сколько тепла выделится или поглотится в ходе этой реакции,
если она с эффективностью 100% будет сопряжена с эндергонической реакцией?
в. Какой должна быть эффективность сопряжения с эндергонической реакцией, чтобы приведенная выше реакция не Сопровождалась ни выделением, ни поглощением тепла?