Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Как молекулы соединяются друг с другом
Кооперативные изменения конформации
Сравнительная биохимия гемоглобина: аномальные гемоглобины
Даже у человека существует несколько типов гемоглобина. Кроме миоглобина и гемоглобина А (а2β2) у взрослых, известен также минорный гемоглобин А2(а2δ2). В крови человеческого плода содержится другой тип гемоглобина — гемоглобин F (а2у2). В присутствии 2,3-дифосфоглицерата он обладает более высоким сродством к кислороду, чем гемоглобин А, что способствует выполнению его функции — снабжению плода кислородом. Через несколько месяцев после рождения гемоглобин F исчезает и заменяется гемоглобином А. Гемоглобины человека различаются по аминокислотному составу и последовательности. У других видов аминокислотный состав гемоглобинов различается еще сильнее. Взаимодействия между субъединицами также варьируют, а у одно- то из типов гемоглобинов, эритрокруоринов, обнаруживаемых у некоторых беспозвоночных, имеется 192 субъединицы [79].
Что же общего между всеми гемоглобинами? Прежде всего для них характерен один и тот же способ укладки полипептидных цепей вокруг идентичных для всех гемоглобинов (или очень сходных) гемогрупп. Однако наиболее поразительным является тот факт, что, несмотря на четко выраженное единообразие общей структуры всех гемоглобинов, имеется всего девять инвариантных аминокислотных остатков и один почти инвариантный. Эти десять остатков заключены на рис. 4-17 в прямоугольные рамки. Два глицина (или аланина) в положениях В-6 и Е-8 инвариантны потому, что тесный контакт между спиралями В и Е не позволяет находиться в этих положениях аминокислотным остаткам большего размера. Пролин С-2 обеспечивает изгиб молекулы. Четыре других инвариантных остатка непосредственно связаны с гемогруппой. Два из них, His Е-7 и His F-8, являются «гем-связанными» гистидинами. Девятый остаток, Туг НС-2, о котором уже шла речь в разд. 5.а, играет основную роль в кооперативном связывании кислорода. И только Lys Н-9 расположен с наружной стороны молекулы. Причины, по которым этот остаток инвариантен, не ясны [80].
Дополнение 4-Г
Серповидноклеточная анемия
Ген, нередко встречающийся у лиц африканского происхождения, вызывает (в случае гомозиготности) тяжелое, часто летальное заболевание, получившее название серповидноклеточная анемия3. В 1949 г. Полинг и Итано с сотрудниками обнаружили, что гемоглобин больных серповидноклеточной анемией имеет необычно высокую электрофоретическую подвижностьб. Позднее, в 1957 г., Ингремв разработал метод пептидных карт (гл. 2, разд. 3.2, рис. 4-20) и применил его для исследования гемоглобина. Он расщепил молекулу гемоглобина трипсином на 15 пептидов и разделил полученную смесь с помощью электрофореза и хроматографии. Ему удалось показать, что аномалия, характерная для серповидноклеточного гемоглобина (гемоглобина S), локализована в ß-цепи (в шестом положении) (рис. 4-17). Глутаминовая кислота, находящаяся в этом положении в нормальном гемоглобине, оказалась замещенной в гемоглобине S на валин. Это был первый случай, когда причина генетического заболевания была прослежена до молекулярного уровня и обнаружена замена одной аминокислоты в специфическом белке.
При низком парциальном давлении О2 гемоглобин S в эритроцитах кристаллизуется. Кристаллизация приводит к нарушению структуры эритроцитов, они приобретают серповидную форму и легко разрушаются, что приводит к анемии. Появление остатка гидрофобной аминокислоты, валина, в 6-м положении, находящемся недалеко от конца молекулы, способствует образованию нового связывающего центра. В результате тетрамеры гемоглобина ассоциируют, образуя длинные микротрубчатые структурыг, которые кристаллизуются внутри эритроцитов.
В чем причина высокой частоты встречаемости серповидноклеточного гена (известно, что его носителями являются примерно 3 млн. американцев)? Тот факт, что этот ген «выжил» и встречается чаще всего среди африканского населения, можно объяснить, по-видимому, тем, что наряду с вредным воздействием он оказывал также и определенное положительное влияние. Дело в том, что возбудитель малярии, являвшийся во все времена причиной высокой смертности людей, часть своего жизненного цикла проводит в эритроцитах (рис. 1-7). При этом оказалось, что в эритроцитах, которые наряду с гемоглобином А содержали гемоглобин S, условия для роста возбудителя малярии менее благоприятны, чем в клетках, содержащих только гемоглобин А. Благодаря этому гетерозиготные носители гена серповидноклеточности выживали при эпидемиях малярии, однако давалось это дорогой ценой — одна четверть их потомства погибала от серповидноклеточной анемии.
Каковы перспективы борьбы с этим заболеванием? Продлить жизнь больным можно, переливая кровь, но эти меры не являются радикальными. Недавно проведенные исследования показали, что цианат реагирует с концевой аминогруппой валина в ß-субъединицах гемоглобина S; это снижает вероятность образования серповидных клеток. Реакция описывается следующим уравнением:
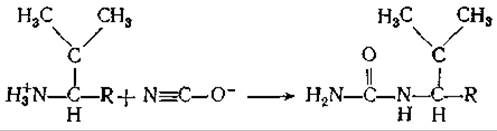
Препарат был с большой осторожностью испытан на людях, однако оказался слишком токсичным. И все же можно надеяться, что удастся найти новые лекарственные средства, препятствующие кристаллизации гемоглобина S.
а The much more numerous heterozygotes carry one hemoglobin S gene but have, at most, minor problems.
б Pauling L., Itano H. A., Singer S. J., Wells I. C., Science, 110, 543—548 (1949).
в Ingram V. M., Nature (London), 180, 326—328 (1957).
г Wishner В. C., Ward К. B., Lattman E. E., Love W. E., JMB, 98, 179— 194 (1975).
д Harkness D R., Trends Biochem. Sсi., 1, 73—76 (1976).
Многие изменения в структуре гемоглобина человека обусловлены мутациями. Установлено, что в крови одного человека из 600 содержится мутантный гемоглобин, в котором обычно одна из аминокислот без всяких последствий заменена на другую (рис. 4-20). Однако замены вблизи гемовой группы часто неблагоприятно влияют на связывание кислорода, а замены в области одной из поверхностей раздела между субъединицами могут привести к нарушению кооперативного взаимодействия между ними [81]. Одним из наиболее широко распространенных аномальных гемоглобинов с серьезно нарушенной функцией является гемоглобин S, обнаруженный у лиц, страдающих серповидноклеточной анемией (дополнение 4-Г). В гемоглобине S остаток глутаминовой кислоты в 6-м положении ß-цепи заменен остатком валина. Интересно, что замена того же остатка глутаминовой кислоты на остаток лизина дает гемоглобин С, наличие которого не связано с такими серьезными патологическими нарушениями, как при серповидноклеточной анемии. Ряд других замен, которые удалось выявить и идентифицировать, приведен на рис. 4-17.
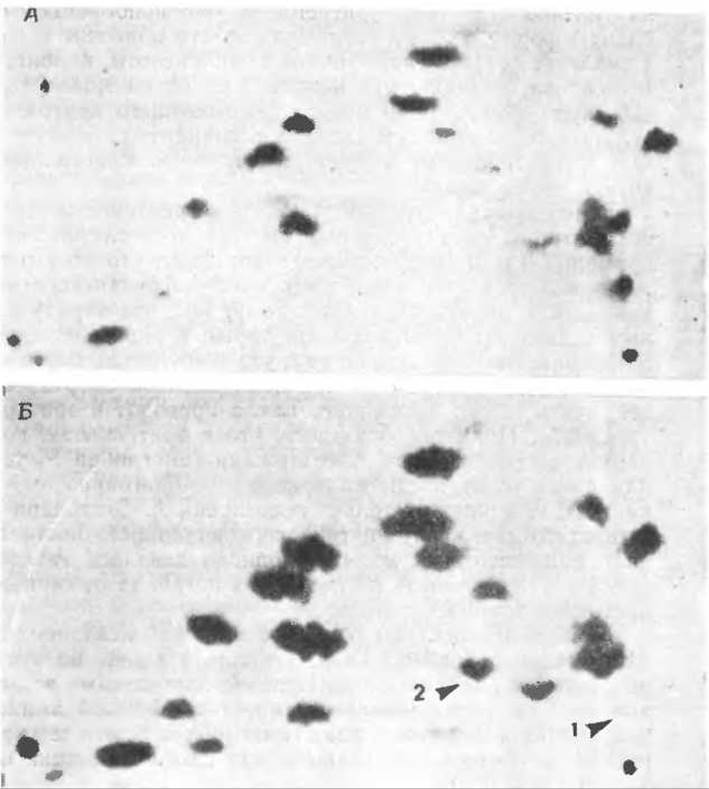
РИС. 4-20. Пептидные карты гемоглобинов человека. Денатурированный гемоглобин) обрабатывали трипсином и образовавшуюся смесь из 28 пептидов разделяли на бумаге с помощью электрофореза (в горизонтальном направлении; анод слева) и хроматографии (в вертикальном направлении). Местоположение пептидов определяли: опрыскиванием бумаги нингидрином или специфическими реагентами на остатки гистидина или тирозина. А. Пептидная карта гемоглобина А здорового взрослого человека. Б. Пептидная карта гемоглобина S. Легко видеть, что один гистидинсодержащий пептид (1) отсутствует, но зато появляется новый пептид (2). Он содержит первые 8 остатков N-конца цепи субъединицы белка. (Lehman Н., Huntsman R., Man’s Haemoglobin, North-Holland, Amsterdam, 1974.)
Представляет интерес семейство гемоглобинов М. Присутствие такого гемоглобина в крови приводит к серьезным нарушениям; выживают только гетерозиготы по данному аномальному признаку. Кровь в этих случаях темная, поскольку железо в половине субъединиц гемоглобина М необратимо окислено до трехвалентного (метгемоглобин). В нормальной крови содержание метгемоглобина не превышает ~1%. В норме метгемоглобин восстанавливается специальной метгемоглобин-редуктазной системой (дополнение 10-А), тогда как метгемоглобины М не восстанавливаются. У всех пяти гемоглобинов М имеются замены в местах, расположенных вблизи гемогруппы. В четырех из них один из гистидинов, связанных с гемом (F-8 или Е-7) либо в а-, либо в ß-субъединице, заменен на тирозин. В пятом валин-67 в ß-субъединицах заменен на глутаминовую кислоту. Два гемоглобина М, имеющие замены В а-субъединицах (MBoston и MIwate), «заморожены» в Т (дезокси)-форме; они обладают низким сродством к кислороду и связывают его некооперативно.
В гемоглобине Rainier1 инвариантный тирозин Н-22 заменен на цистеин. Сродство к кислороду у этого гемоглобина очень велико, однако кооперативность отсутствует. Гемоглобин Kansas, в котором аспарагин-102 в ß-субъединице заменен на треонин, также лишен кооперативности и обладает очень низким сродством к кислороду, тогда как гемоглобин Richmond, в котором тот же аспарагин заменен на лизин, функционирует нормально. В гемоглобине Hiroshima С-концевой гистидин в ß-субъединице заменен аспарагиновой кислотой. Этот С-концевой гистидин является одной из аминокислот, которая дает бор-протон, в связи с чем в мутантном гемоглобине Hiroshima сродство к кислороду повышено в три раза, а эффект Бора наполовину уменьшен [82].
1 Названия (большинства аномальных гемоглобинов происходят обычно от названий городов или больниц, в которых они были впервые обнаружены. Сначала эти гемоглобины пытались обозначать разными буквами, однако, когда их число стало настолько большим, что букв уже не хватало, вернулись к старым обозначениям. В тексте и на рис. 4-17 сохранены английские названия, под которыми они фигурируют в научной литературе, чтобы читатель мог точно знать, о каком гемоглобине идет речь — Прим. перед.