Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Мембраны и клеточные оболочки
Строение мембран
Мембранные белки
Поскольку мембранные белки легко денатурируют, их довольно долго не удавалось выделить и изучить. Преодолеть эти трудности помогло использование принципиально новых подходов. Оказалось, что ряд белков можно солюбилизировать с помощью детергентов. Например, родопсин — светочувствительный пигмент и основной белковый компонент наружных члеников палочек сетчатки — может быть получен в солюбилизированном виде, в котором он нормально обесцвечивается на свету (гл. 13, разд. Е). Несколько ферментов удалось выделить из мембран и очистить фракционированием в органических растворителях, например в метаноле. Мембранные белки обычно нерастворимы в воде. Однако мембраны эритроцитов удалось практически полностью солюбилизировать в воде, используя хелатобразующий агент ЭДТА в концентрации 5∙10-3 М (табл. 4-2) или 0,1 М тетраметиламмонийбромид [27]. Результаты этих опытов указывают, что в поддержании стабильности мембран важную роль играют ионные взаимодействия между белками (или между белками и фосфолипидами).
При электрофорезе белков плазматических мембран в полиакриламидном геле с додецилсульфатом натрия (гл. 2, разд. 3.6) получают от 1 до 6 четко выраженных полос и, как минимум, еще 35 менее интенсивных полос, соответствующих мол. весам в интервале от 10 000 до 360 000 [28]. Однако некоторые очень важные мембранные белки, например (Na+ + К+)-зависимая АТРаза (разд. Б.2.в), присутствуют в столь незначительных количествах (в одном эритроците их содержится всего несколько сотен молекул [3, За]), что эти белки не удается идентифицировать на электрофореграмме. Митохондриальные мембраны могут иметь еще более сложный состав, чем плазматические, тогда как состав миелина несколько проще.
Около одной трети белка в мембране эритроцитов приходится на долю двух гидрофобных белков, получивших название спектрин (или тектин). Их мол. вес составляет 220 000—250 000 и вместе с более низкомолекулярным белком (мол. вес 43 000) они образуют палочковидные структуры, имеющие размер ~ 3x200 нм. В эритроците содержится около 2,2∙105 таких палочек, и если их расположить рядом друг с другом, то они полностью покроют внутреннюю поверхность эритроцита (130 мкм2). Поскольку после обработки различными химическими реагентами [28а], модифицирующими аминокислотные остатки белков, находящихся на внешней поверхности мембран (например, иодирование лактопероксидазой, гл. 10, разд. Б.6), опектрины не метятся, считают, что они расположены с внутренней стороны мембран [3, 29]. Предположение о сходстве этих белков с миозином еще требует доказательств, а их роль в функционировании мембраны остается неясной.
Другой важный компонент мембран эритроцитов — это гликопротеид с мол. весом ~ 100 000, который сравнительно прочно закреплен внутри мембраны и имеет углеводные цепи, выступающие в окружающий раствор [29]. На электронно-микроскопических фотографиях поверхностей мембранного бислоя, полученных методом замораживания — скалывания (рис. 5-1, Д), видно, что в мембране на площади 1 мкм2 хаотично расположено приблизительно 4200 частиц диаметром 8 нм. Не исключено, что эти частицы являются рассматриваемым гликопротеидом. Значение этого белка остается неясным. Однако было высказано предположение, что его молекулы содержат «каналы», необходимые для транспорта воды [29а] и анионов [29b] (обмен бикарбонатов и хлоридов через мембраны эритроцитов происходит очень активно и связан с функционированием гемоглобина в транспорте кислорода). О том, что гликопротеид пронизывает мембрану, свидетельствует тот факт, что при обработке трипсином интактных эритроцитов происходит частичный протеолиз этого гликопротеида без разрушения мембраны. Кроме того, в результате целого ряда химических реакций удается модифицировать именно этот белок, в то время как большая часть мембранных белков остается интактной [3, За].
Особый интерес представляет еще один гликопротеид, содержащийся в эритроцитах, — гликофорин (обозначаемый иногда PAS-1) [30, 31]. Он имеет мол. вес ~31 000 и также встроен в мембрану. Замечательно, что около 60% его веса составляют углеводы. Белковая часть гликофорина, первичная структура которой известна, представлена единичной пептидной цепью, содержащей приблизительно 131 аминокислотный остаток [31] В 50-членном N-концевам фрагменте очень велико содержание треонина и серина. Считают, что N-концевая часть, с которой связано около 16 олигосахаридных разветвленных цепей, выступает из клеточной мембраны; всего на одну полипептидную цепь приходится ~160 молекул сахара (рис. 5-2). Из-за высокого содержания сиаловой кислоты (рис 2-14) гликопротеид имеет большой отрицательный заряд. Молекула гликофорина состоит из 3 частей («доменов»), К N-концевой части молекулы, связанной с углеводными остатками, примыкает цепь из 32 гидрофобных остатков, которые, по-видимому, образуют а-спиральный Участок, пронизывающий бислой. Третий участок, расположенный на С-конце, гидрофилен и обогащен остатками пролина, глутаминовой и аспарагиновой кислот. Он может достигать цитоплазмы (рис. 5-2) и связывать ионы кальция или взаимодействовать с —NH+3-гpyппaми фосфолипидных головок.
Если бы все углеводные остатки гликофорина оказались равномерно распределенными на поверхности клетки, то они могли бы покрыть около 1/5 ее поверхности, образован редкую сетку. В действительности же они распределены, по-видимому, неравномерно и образуют выступающие из мембраны локальные скопления. Было показано, что углеводные выступы являются носителями антигенов групп крови MN-типа (разд. В 1) и ряда других иммунологических детерминант. Они служат также рецепторами для вирусов гриппа и местами присоединения растительных агглютининов (разд В.З).
20 или даже большее число гликопротеидов встроено в мембрану эритроцитов [28b]; их иногда называют внутренними или интегральными белками. Белки, менее прочно связанные с мембраной и расположенные главным образом на внутренней поверхности, носят название периферических [32].
Миелин содержит простой и вместе с тем весьма интересный набор белков. Около 30% общего количества белка приходится на долю сильно основного белка А-1 [33] с мол. весом ~ 18 000. Для белка А-1 человека установлена аминокислотная последовательность. Считают, что этот белок находится в вытянутой ß-конформации, причем близко расположенные друг к другу четыре пролиновых остатка в середине полипептидной цепи позволяют ей образовать шпилечную петлю. Значительный интерес к изучению этого белка объясняется тем, что он вызывает у животных аутоиммунное заболевание — экспериментальный аллергический энцефаломиелит, которое служит моделью известного в клинике заболевания нервной системы, характеризующегося демиелинизацией (рассеянный склероз). Это позволяет считать, что белок А-1 в интактном миелине взаимодействует с циркулирующими антителами, и свидетельствует о расположении этого белка на поверхности миелиновой мембраны. Однако функция его не известна.
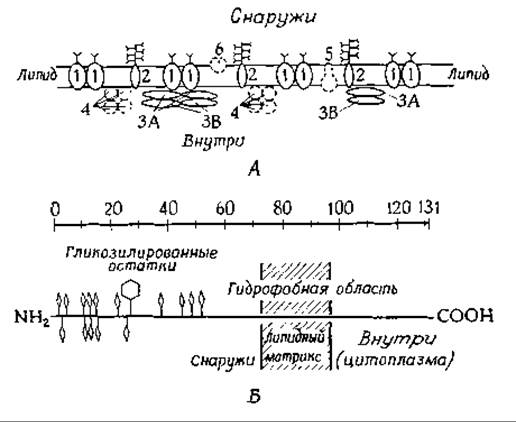
РИС. 5-2. А. Схематическая модель мембраны эритроцита. 1 — гликопротеид с мол. весом 100 000; 2 — сиалогликопротеид (гликофорин); 3 — спектрин; 4 — глицеральдегид- 3-фосфатдегидрогеназа; 5—(Na++K+) -зависимая АТРаза; 6 — ацетилхолинэстераза. Данные, приведенные на рисунке, не соответствуют истинному содержанию соответствующих полипептидиых цепей в мембране. Палочкообразные структуры (Y) обозначают углеводы. (Juliano R., ВВА, 300, 341—348, 1973.) Б. Схематическое изображение молекулы гликофорина. Ромбы — О-гликозидные звенья, шестиугольники — N-гликозидные звенья [31].
Другим важным белковым компонентом миелина является протеолипид, сильно обогащенный остатками гидрофобных аминокислот; он содержит жирные кислоты, присоединенные, вероятно, сложноэфирными связями [9]. Подобные протеолипиды встречаются достаточно часто [33а]. Из эндоплазматического ретикулума мышечных клеток был экстрагирован белок с мол. весом 12 000, растворимый в смеси хлороформ — метанол (2:1). Субъединицы F-пилей Е. coli (гл. 1, разд. А.6) примерно такого же размера находятся (в растворенном состоянии) в наружной мембране клеточной стенки бактерий [33b].
Многие белки в мембранах выполняют ферментативные функции. Так, например, система транспорта электронов в митохондриях локализована в мембранах (гл. 10), и ряд ферментов, обладающих высокой растворимостью в липидах, уже выделен. Примером может служить фосфатидилсерин—декарбоксилаза, катализирующая превращение фосфатидилсерина в фосфатидилэтаноламин (гл. 12, разд. Е.2) в процессе биосинтеза последнего. Гликозилтрансферазы, необходимые для биосинтеза липополисахаридов наружной мембраны бактериальной клетки, по-видимому, также встроены в плазматическую мембрану. Эти ферменты не активны в отсутствие липидов, но восстанавливают активность в присутствии фосфатидилэтаноламина [34]. Особый интерес представляет белок с мол. весом 26 000, обнаруженный в пурпурных мембранах Halobacterium halobium (гл. 13, разд. Е. 6). Этот белок, структуру которого удалось выяснить с помощью электронной микроскопии с разрешением 0,7 нм, по-видимому, обеспечивает работу светочувствительного протонного насоса [35]. Каждая молекула белка состоит из семи плотно упакованных а-cпиральных участков, расположенных почти перпендикулярно к поверхности мембраны. В совокупности эти молекулы образуют высокоупорядоченные структуры, промежутки между которыми заполнены фосфолипидами.
В этом разделе очень кратко рассказано о том, что в настоящее время известно о составе и строении белков клеточных мембран. Нет сомнения, что в ближайшем будущем при изучении мембранных белков будут получены новые интересные результаты.