Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Мембраны и клеточные оболочки
Антигены и рецепторы на поверхности клетки
Белковые агглютинины (лектины)
Объектами интенсивных исследований в последние годы явились некоторые белки растительного происхождения, обладающие уникальной способностью вызывать агглютинацию эритроцитов. Эти белки — лектины — привлекли внимание не только потому, что они являются специфическими белковыми реагентами на сахара и с успехом используются при изучении поверхности клеток, но также и потому, что некоторые из них, в частности конканавалин А (на долю которого приходится до 2—3% белка в семенах канавалии мечевидной), вызывают преимущественно агглютинацию раковых клеток. Конканавалин А и некоторые другие лектины обладают митогенной активностью, т. е. стимулируют процесс митотического деления и размножения покоящихся лимфоцитов. Связывающие участки лектинов специфичны к определенным сахарам. Так, конканавалин А связывается с остатками a-D-маннопиранозы и a-D-гликопиранозы, содержащими немодифицированные гидроксильные группы в положениях С-3, С-4 и С-6 [92]. В этом белке есть также специфические участки связывания для ионов Са2+ и переходных металлов, например Мn2+. Лектин из бобов сои связывается с остатками D-N-ацетилгалактозамина и D-галактозы, а лектин из семян пшеницы специфичен к D-N-ацетилглюкозамину.
Полная структура конканавалина А была установлена методом рентгеноструктурного анализа [93, 94] (рис. 5-7). Этот белок представляет собой тетрамер, состоящий из субъединиц с мол. весом 27 500. При рН≤5,8 он диссоциирует на димеры. Строение конканавалина А не совсем обычно, поскольку он не содержит а-спиральных участков. Каждый мономер состоит из 237 остатков, 57% которых образуют трехслойную ß-структуру (рис. 5-7, В). Белок не связывает углеводы до тех пор, пока не будут заняты два участка, связывающие металл. Возможно, что для образования участка, связывающего углевод, необходимо конформационное изменение белка, которое происходит только в процессе его связывания с ионами.
Какую роль играют лектины в растениях и в других организмах, в которых они образуются? Служат ли они в растениях аналогами антител, обеспечивающими защиту от бактерий и грибов? Можно ли, учитывая их способность ускорять митоз, приписывать им определенную роль в регулировании клеточного деления и прорастания семян? В настоящее время мы еще не в состоянии ответить на эти вопросы. Образование лектиноподобных белков миксомицетами [95] и белков с агглютинирующими свойствами фибробластами эмбриона цыпленка [96] указывает на то, что лектины могут представлять собой компоненты систем, ответственных за узнавание клеток; не исключено, что они соединяют клеточные поверхности друг с другом, связывая полисахаридные группы двух соседних клеток.
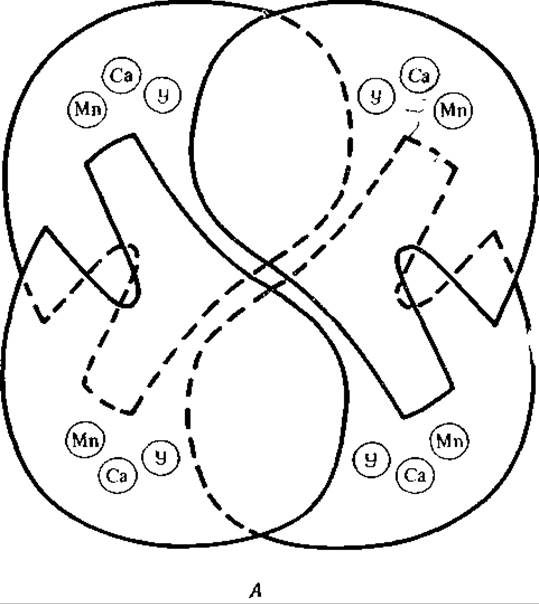
РИС 5-7. Строение конканавалина А — лектина из канавалин мечевидной А. Схематическое изображение тетрамерной структуры белка [93]. Отмечены места связывания ионов Са2+ и Мn2+, а также углевода (У). (Edelman G., Becker I., Reeke О., Jr., Cunningham В., личное сообщение.)
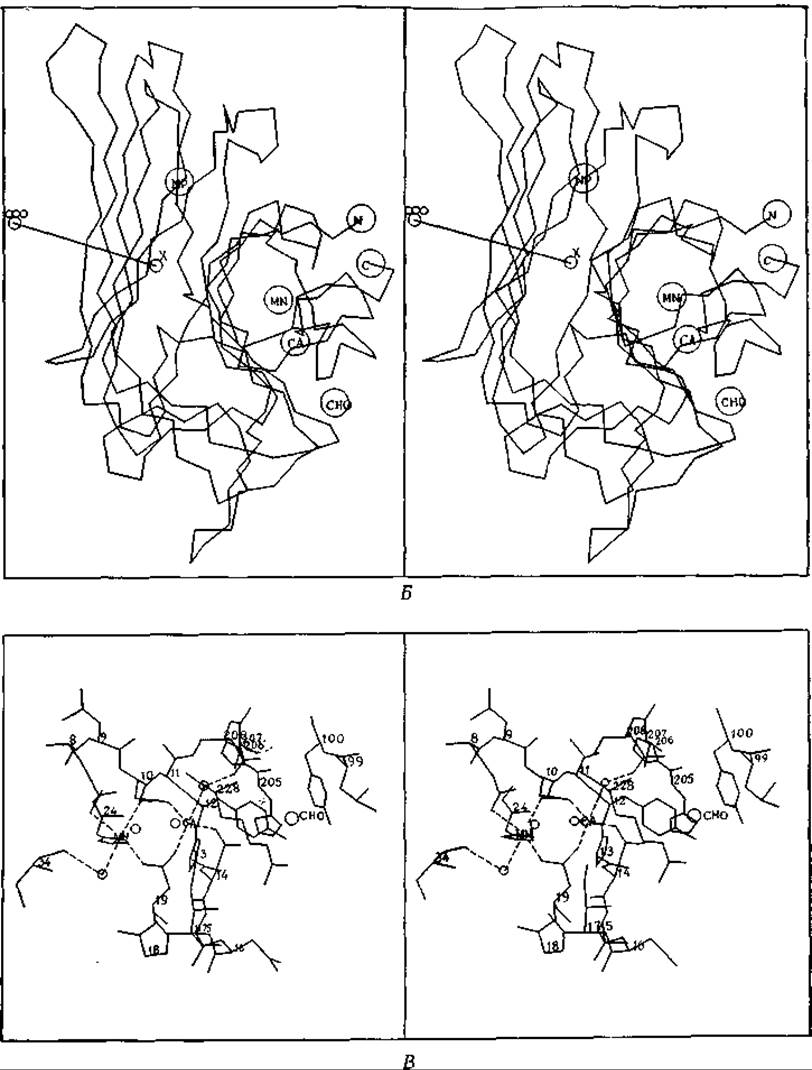
РИС. 5-7. Б. Стереограмма положений а-углеродных атомов 237 аминокислотных остатков одной субъединицы белка [94а]. Обозначения СА и MN соответствуют положенням участков, связывающих металлы. Участок, связывающий углевод, обозначен СНО, неполярный связывающий участок — NP, a N- и С-концы полипептидной цепи — N и С. В. Стереограмма участков связывания ионов Са2+ и Мn2+. Оба нона образуют, по-видимому, по 6 координационных связей. Обратите внимание, что атомы кислорода карбоксильных групп 10-го и 19-го остатков являются лигандами для обоих ионов. В число других лигандов входят карбонильная группа пептидной связи и имидазольная боковая цепь. Атом N-3 последней участвует в координационном связывании с Мn2+ и образует, по-видимому, водородную связь с пептидной карбонильной группой. Маленькими кружками, связанными с Мn2+ и Са2+, обозначены молекулы воды; буквами СНО обозначено место присоединения углевода. (С любезного разрешения К. Hardman.)
Дополнение 5-Е
Антитела
К числу наиболее интересных растворимых сывороточных белков относятся иммуноглобулины (у-глобулины), которые выполняют функцию антител, защищающих организм от опасностей вторжения чужеродных вещества,б. Различия в молекулярных весах и химических свойствах позволяют разделить иммуноглобулины на пять классов. Первые три из них — IgG, IgM и IgA—в количественном отношении наиболее существенны, однако важное значение имеют и остальные два — IgD и IgE. Например, у лиц, склонных к аллергическим реакциям, отмечено повышенное содержание IgE.
Основу строения всех иммуноглобулинов составляет квазисимметричный димер, состоящий из двух легких и двух тяжелых цепей, длина которых у иммуноглобулинов разных классов различна. В антителах человека обнаруживают два класса легких цепей ϰ и λ. Тяжелые цепи обозначают греческими буквами у, μ, а, δ и ε (см. прилагаемую таблицу). Иммуноглобулины IgM и IgA содержат дополнительную J-цепьв.
|
Обозначение |
Мол. вес |
Формула |
|
IgG |
150 000 |
ϰ2y2или λ2y2 |
|
IgM |
950 000 |
(ϰ2μ2)3или (λ2μ2)5 |
|
IgA |
300 000 или больше |
(ϰ2а2)n или (λ2а2)n |
|
IgD |
160 000 |
ϰ2δ2 или λ2δ2 |
|
IgE |
190 000 |
ϰ2ε2 или λ2ε2 |
Обработка антител меркаптоэтанолом приводит к разрыву дисульфидных связей, при помощи которых цепи связаны друг с другом, и позволяет получить препараты мономерных легких и тяжелых цепей. При ферментативном гидролизе пептидных цепей иммуноглобулинов появляются чрезвычайно гетерогенные пептидные фрагменты. Этот результат не был неожиданным, поскольку уже давно известно, что в организме содержатся буквально тысячи различных антител, каждое из которых имеет специфический участок связывания для различных антигенных детерминант. Если раньше было неясно, как формируются различные участки связывания, то обнаружение гетерогенности аминокислотных последовательностей позволило сделать предположение, что для каждого антитела характерна своя аминокислотная последовательность.
Значительным успехам в понимании детального строения антител способствовал тот факт, что у больных с опухолями лимфатической системы (например, при опухоли костного мозга — множественной миеломе) была обнаружена секреция огромных количеств гомогенных иммуноглобулинов или их фрагментов. В скором времени подобные опухоли были найдены у мышей, которые стали источником экспериментального материала. Оказалось, что белки Бенс-Джонса, секретируемые в мочу у больных миеломой, представляют собой легкие цепи иммуноглобулинов. Определение аминокислотной последовательности показало, что у каждого больного белок Бенс-Джонса гомогенен, однако не было обнаружено даже двух больных, секретирующих один и тот же белок. Позже были получены также интактные гомогенные миеломные глобулины и макроглобулины (IgM).
Первое сообщение о расшифровке полной аминокислотной последовательности IgG появилось в 1969 г.г Оказалось, что обе тяжелые цепи белка содержат по 446 аминокислот, а обе легкие — по 214. Таким образом, всего в молекуле IgG содержится 1320 аминокислот. Исследование иммуноглобулина IgM показало, что более длинные тяжелые цепи этого белка содержат по 576 аминокислотд. У всех иммуноглобулинов тяжелые и легкие цепи связаны между собой дисульфидными связями. Наличие дисульфидных связей внутри цепей заставляет их складываться в петли. Для IgM характерна полимеризация, обусловленная наличием дополнительных дисульфидных связей между молекулами этого белка и приводящая к образованию пентамеров, которые можно легко увидеть при помощи электронного микроскопа.
К тяжелым цепям присоединены олигосахаридные фрагменты. Как видно из приведенного рисунка, у IgM их пять.
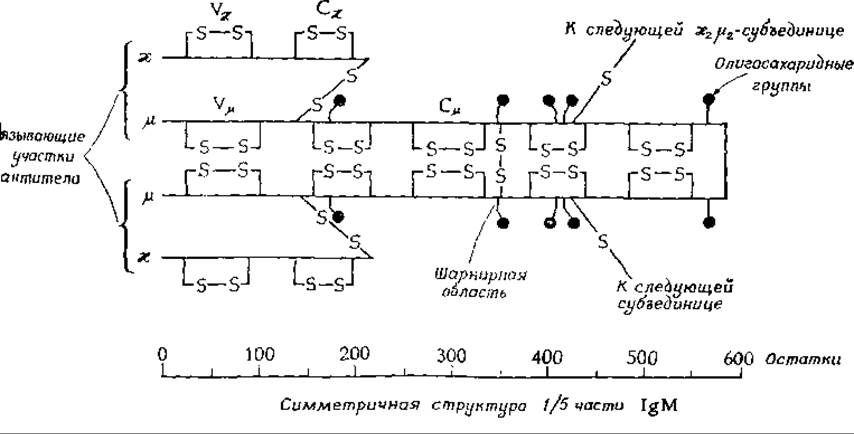
Они состоят из остатков маннозы и N-ацетилглюкозамина, связанных с аспарагином. В состав других иммуноглобулинов (IgA, IgE и IgG) входят также остатки фукозы, галактозы и N-ацетилнейраминовой кислотые.
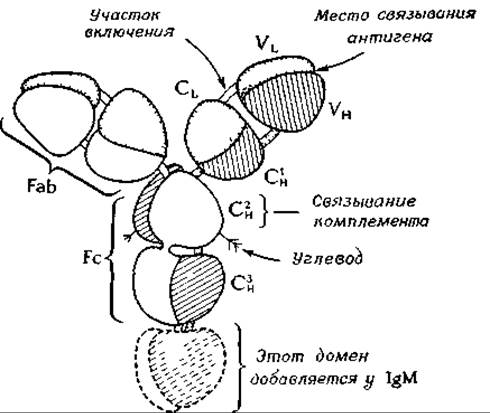
Обработка интактной молекулы IgG ферментом папаином приводит к расщеплению обеих тяжелых цепей в участке, расположенном рядом с внутрицепочечным дисульфидным мостиком, в так называемой шарнирной области. При этом молекула распадается на три части — на два фрагмента, несущих участки, связывающие антитела (Fab-фрагменты), каждый из которых содержит N-концевой участок тяжелой цепи и связанную с ним легкую цепь, и один Fc-фрагмент. Двухвалентность антитела, т. е. способность связываться с двумя антигенами, была известна еще до того, как установили, что его можно разделить на два Fab-фрагмента.
Данные о форме и строении молекул IgG были подтверждены результатами электронно-микроскопического и рентгеноструктурного анализаж.
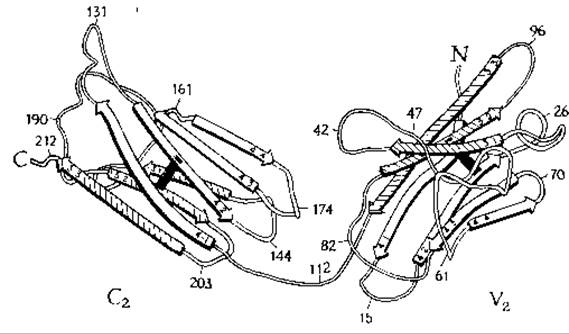
Определение аминокислотной последовательности иммуноглобулинов привело к неожиданным результатам. Одни участки молекул разных антител имеют сильно различающиеся последовательности (вариабельные участки), тогда как последовательность других участков у них почти не меняется (константные участки). Молекулу антитела можно в соответствии с этими данными разделить на участки, или домены. Вариабельные участки, у N-концов легких и тяжелых цепей, принято обозначать соответственно VL и VH, а константные участки — СL и СH. При исследовании СY-участков было обнаружено, что приблизительно через 110 остатков большая часть аминокислотной последовательности повторяется. Константный участок тяжелой цепи молекулы IgG состоит из трех таких доменов (Сн1, Сн2 и Сн3), аминокислотная последовательность которых весьма сходна. В молекуле IgM имеется еще и четвертый Сн-домен. Эти данные позволяют предполагать, что в процессе эволюционного развития иммуноглобулинов происходила последовательная дупликация короткого гена, кодирующего синтез последовательности приблизительно из 110 аминокислот.
В пределах вариабельных участков цепей иммуноглобулинов находятся так называемые гипервариабельные участки. Считают, что именно они формируют участки связывания антигенов, расположенные на концах Fab-фрагментов и образованные как легкими, так и тяжелыми цепями.
Результаты кристаллографических исследований свидетельствуют о близком сходстве складчатых структур, формируемых во всех доменах. Семь вытянутых участков цепи образуют два складчатых слоя с преимущественно антипараллельным расположением цепей; в промежутках между слоями упакованы гидрофобные боковые цепи. Общие размеры структурной единицы — 4,0X2,5X2,5 нм. В центре каждого домена имеется S—S-мостик, связывающий два слоя друг с другом.
Структура вариабельных доменов несколько сложнее. Различные домены связаны между собой участками вытянутых пептидных цепей, которые иногда называют участками включения (switch region)з-о.
В последнее время появилась возможность точно установить, каким образом Fab-фрагменты связывают специфические гаптены. Гаптены— это небольшие молекулы, которые могут связываться с антителами наподобие антигенных детерминант, но сами не способны вызывать образования антител при введении в организм животного. Было показано, что в связывании гаптена фосфорилхолина с одним Fab-фрагментомз и витамина К — с другим принимают участие гипервариабельные участки как тяжелых, так и легких цепей.
Складчатое строение одной цепи в константном и вариабельном доменах белка Бенс-Джонсак.
Как функционируют иммуноглобулины? Одна из реакций, агглютинация, происходит в результате взаимодействия поливалентного антитела с двумя клетками. Чаще, однако, взаимодействие антитела с антигеном вызывает другие эффекты. Один из таких эффектов — связывание белка Сlq, входящего в состав комплемента (дополнение 5-Ж). Было установлено, что с белком Clq связывается СH2-домен Fc-фрагмента IgGп. Связывание происходит лишь после того, как соответствующий антиген (но не гаптен) свяжется с иммуноглобулином. Кроме того, для активации системы комплемента необходимо наличие агрегата, состоящего из двух или из большего числа молекул IgG (или одной молекулы пентамерного IgM). Было высказано предположение, что в процессе связывания с антигеном молекула иммуноглобулина претерпевает конформационное изменение, в результате которого формируется участок связывания Clq. Странно, однако, что связывание комплемента с антителом могут вызывать только поливалентные антигены (т. е. антигены, способные связываться более чем с одним антителом), тогда как гаптены не способны индуцировать связывание с комплементом и даже не вызывают заметных конформационных изменений в Fab. Таким образом, ряд важных аспектов функционирования антител остается еще не выясненным.
а Edelman G. М., Science, 180, 830—840 (1973).
б Porter R. R., Science, 180, 713—716 (1973).
в Hauptman S. P., Tomasi T. B., JBC, 250, 3891—3896 (1975).
г Edelman G. E., Cunningham B. A., Gall W. E., Gottlieb P. D., Rutishauser U., Waxdal M. PNAS, 63, 78—85 (1969).
д Putnam F. W., Florent G., Paul Q., Shinoda T., Shimizu A., Science, 182, 287—291 (1973).
е Baenziger J., Kornfeld S., Kochwa S., JBC, 249, 1889—1896 (1974).
ж Sarma V. R., Silverton E. W., Davies D. R, Terry W. D., JBC, 246, 3753—3759 (1971).
з Segal D. M., Padlan E. A, Cohen G. H., Rudikoff S., Potter M., Davies D. R., PNAS, 71, 4298—4302 (1974).
и Amzel L. M., Poljak R. J., Saul F., Varga J. M., Richards F. F., PNAS, 71, 1427—1430 (1974).
к Schiffer M., Girling R. L, Ely K. R, Edmundson A. B., Biochemistry, 12, 4620—4631 (1973).
л Epp О., Colman P., Fehlhammer H., Bode W., Schiffer M., Huber R., Palm W., EJB, 45, 513—524 (1974).
м Blake С. C. F., Nature (London), 253, 158 (1975).
н Nisonoff A., Hopper J. E., Spring S. B., The Antibody Molecule, Academic Press, New York, 1975.
о Davies D. R., Padlan E. A., Segal D. M., Annu. Rev. Biochem., 44, 639— 667 (1975).
п Low T. L. К., Liu Y.-S. V., Putnam F. W., Science, 191, 390—392 (1976).