Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Молекулы, из которых мы состоим
Принципы построения малых молекул
Водородные связи и гидрофобные взаимодействия
Хотя целостность молекулы поддерживается ковалентными связями, многие важнейшие свойства биологических соединений определяются значительно более слабыми связями. Среди этих нековалентных связей особенно важны водородные и гидрофобные. Водородные связи обусловлены электростатическим притяжением, возникающим из-за неравномерного распределения электронов между атомами, участвующими в образовании ковалентной связи: например, в молекуле воды электроны, образующие связь Н—О, немного смещены к атому кислорода. В результате на атоме водорода создается небольшой нескомпенсированный положительный заряд, а на атоме кислорода — небольшой отрицательный. Наличие такой поляризации иногда указывают стрелками, заменяющими изображение химических связей; используются также обозначения δ+ и δ-. Молекулы с сильно поляризованными связями называют полярными, как и функциональные группы, в которых имеются такие связи. Им противопоставляют неполярные группы, такие, как —СН3-группа; здесь образующие связь электроны почти равномерно распределены между атомами углерода и водорода.
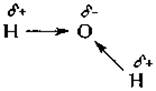
Водородная связь образуется в тех случаях, когда положительно заряженный конец одного из диполей (одной из поляризованных связей) притягивается к отрицательно заряженному концу другого диполя. Способность к образованию водородных связей ярко выражена у молекул воды; при этом каждый атом кислорода может образовывать водородные связи с двумя другими молекулами воды. Водородные связи имеют резко выраженный направленный характер: наиболее сильной связь бывает в том случае, когда все три атома оказываются на одной прямой. Энтальпия образования водородной связи вдоль прямой, ∆H°, может достигать —20 кДж∙моль-1 (—5 ккал∙моль-1).

Водородные связи длиннее ковалентных, но заметно короче (на ~0,06—0,08 нм) расстояний, которые соответствуют межатомным контактам, определяемым значеннями вандерваальсовых радиусов. Следует помнить, что водородные связи всегда образуются между парами групп, одна из которых обращена к другой отрицательным концом диполя, а другая служит донором протона. Группа, являющаяся акцептором протона, может также рассматриваться как донор неподеленной пары электронов. При обсуждении механизмов органических реакций принято стрелками указывать направление смещения электронов. В этой книге мы тоже иногда будем указывать направление водородных связей стрелками, идущими от доноров электронов к атомам водорода (как это было сделано выше, когда мы рассматривали образование водородных связей между молекулами воды).
Жиры, углеводороды и другие вещества, молекулы которых состоят в основном из неполярных групп, плохо растворимы в воде и хорошо растворяются в неполярных растворителях. В водной среде неполярные группы стремятся ассоциировать — это явление часто называют гидрофобным взаимодействием. В то же время сахара и другие соединения, содержащие много полярных групп, напротив, очень хорошо растворяются в воде и не ассоциируют.
Растворимость сахара в воде объясняется способностью многочисленных гидроксильных групп этого соединения к образованию водородных связей с молекулами воды. Природу гидрофобного связывания, о котором будет говориться в гл. 4 (разд. Б.4), понять несколько труднее, но обусловлено оно главным образом сильным взаимным притяжением молекул воды, вовлеченных в густую сеть водородных связей [7].
Многие молекулы, имеющие в своем составе кольцевые структуры (например, пурины или пиримидины), довольно слабо растворяются как в воде, так и в органических растворителях. Молекулы этих соединений, содержащие полярные и неполярные участки, не оказывают предпочтения ни одному из растворителей и плотно упаковываются в структуре твердого кристалла.