Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Молекулы, из которых мы состоим
Белки
Конформации пептидных цепей
Рассмотрим цепочку из —СН2 (метиленовых) -групп — такие цепочки составляют синтетический полимер полиэтилен. Атомы водорода при углеродах, стоящих в цепи через один, в полностью вытянутой цепи фактически соприкасаются друг с другом — никаких более крупных атомов сюда поместить нельзя.
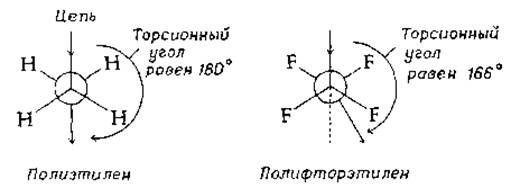
Даже при замещении атомов водорода (вандерваальсов радиус 0,12 нм) атомами фтора (радиус 0,135 нм) цепь полимера не может остаться полностью вытянутой. Торсионный угол, равный в полиэтилене 180°, в полифторэтилене принимает значение 166° — этого изменения достаточно для снятия напряжения в контактах между атомами фтора, и при этом атомы фтора и соседние атомы углерода еще не мешают друг другу. Сформировавшаяся в результате спиральная структура напоминает структурные элементы, встречающиеся в белках и других биополимерах. Итак, образование спиральной конформации — это естественное следствие взаимного стерического «вытеснения» одних групп атомов другими [12, 13].
Конформационные свойства биополимеров носят сложный характер, однако все же их значительно упрощает жесткость структуры большинства мономерных звеньев.
а. Пептидное звено
Жесткость полипептидов обусловлена плоским характером пептидных групп, что связано с наличием резонанса
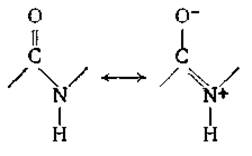
Ожидаемое из-за этого резонанса укорочение связи С—N и удлинение связи С = О получило экспериментальное подтверждение при рентгеноструктурном анализе данных структур. Каждое пептидное звено можно изобразить в виде жесткого плоского листка, размеры которого указаны в верхней части рис. 2-3. Правда, расположение связей вокруг атома азота отчасти сохраняет пирамидальный характер [14, 15] (рис. 2-3, внизу).
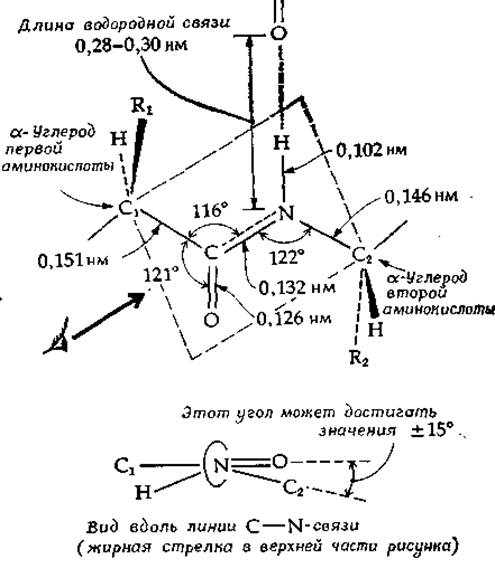
РИС. 2-3. Размеры пептидной группы. Указаны межатомные расстояния, а также лина водородной связи, образуемой с соседней пептидной группой. Все атомы внутри пунктирной рамки лежат примерно в одной плоскости. Однако, как показано в нижней части рисунка, расположение связей вокруг атома азота отчасти сохраняет пирамидальный характер.
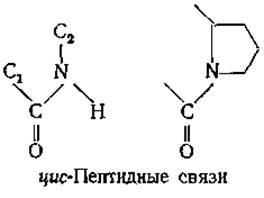
Наиболее распространена транс-пептидная связь (рис. 2-3), но встречается и цис-пептидная связь (она примерно на 8 кДж∙моль-1 менее устойчива, чем первая); цис-связь чаще всего образуется при томе азота пролина [16, 17].
Полипептид можно рассматривать как цепочку из связанных друг с кругом плоских пептидных звеньев (рис. 2-4). Каждое пептидное звено присоединяется к другому через а-углерод аминокислоты. Этот углерод обусловливает присутствие в цепи двух одинарных связей, вокруг которых возможно вращение (исключением служит циклический остаток пролина). Конформация аминокислотного звена в цепи белка определяется торсионными углами относительно каждой из упомянутых одинарных связей. Эти углы обозначаются через φ и ψ и для полностью вытянутой цепи принимаются равными 180°, как это показано на рис. 2-4 [18]. Поскольку и φ и ψ могут меняться, аминокислотный остаток в принципе способен принимать самые разные конформации. Многие из них, однако, сразу исключаются, являясь стерически невозможными; в этом легко убедиться с помощью молекулярных моделей.
1 Широко используется и другое соглашение, согласно которому в полностью выгнутой цепи φ = ψ = 0 [13].
В наши дни стало привычным просматривать целиком всю область возможных значений φ и ψ используя вычислительные машины. Расчеты конформации пептидной группы выполнил Рамачандран.
Результаты такого анализа часто представляют в виде графиков зависимости φ от ψ (графиков Рамачандрана, или конформационных карт), на которых обводят рамками области возможных комбинаций двух углов. Конформационные карты пептидов (рис. 2-5) показывают, что число возможных комбинаций торсионных углов довольно велико. Существенная часть этих комбинаций действительно реализуется в белках. Вместе с тем гораздо больше таких пар углов, которые совершенно исключаются, если не рассматривать более гибких пептидов, содержащих глицин (рис. 2-5,5). В табл. 2-3 приведены приблизительные значения торсионных углов для ряда пептидов с регулярной структурой.
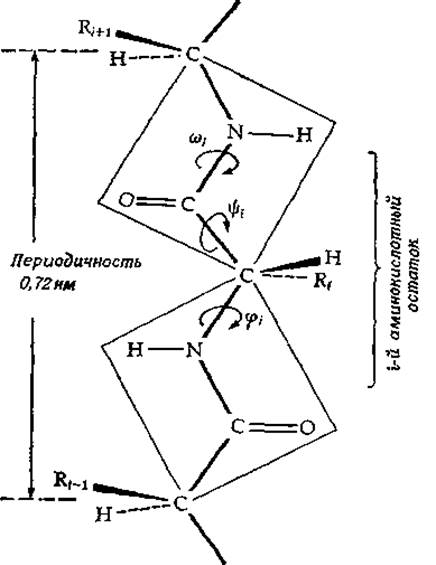
РИС. 2-4. Две пептидные группы в полностью вытянутой ß-конформации. Торсиовные углы φі, ψі и ωі- считаются равными 0°, если атомы главной цепи находятся в заслоненной, или цис-конформации. В полностью вытянутой цепи все эти углы равны 180°.
б. ß-Структура, образуемая вытянутыми участками цепи
Как впервые указал Лайнус Полинг, одним из важных принципов формирования структуры белков является образование как можно большего числа водородных связей между группами С = О и N—Н основной цепи. Простым примером может служить слой уложенных рядом вытянутых цепей (φ=ψ=180°), между которыми образованы водородные связи. Подобную структуру имеет полиглицин — ее до некоторой степени иллюстрирует рис. 2-6 (вверху слева). Обратите внимание, что на этом рисунке соседние цепи идут в противоположных направлениях, отсюда и название — антипараллельная ß-структура. Помимо того, что антипараллельность цепей создает наиболее благоприятные условия для образования водородных связей между цепями, она еще способствует тому, чтобы цепь повернула и шла назад вдоль самой себя. Это очень важный фактор при формировании клеточных структур.
Беспрепятственное образование ß-структуры из полностью вытянутых цепей возможно лишь для полиглицина; присутствие боковых (R) цепей в других аминокислотах неизбежно вызывает искажение структуры. Например, фиброин шелка характеризуется периодичностью 0,70 нм, тогда как полностью вытянутая цепь имеет периодичность 0,72 нм (рис. 2-4). Как показали Полинг и Кори, это укорочение цепи может быть обусловлено изменением угла φ на ~40° (до значения —140°) и изменением угла ψ в противоположном направлении на ~55° (до значения +135°), в результате чего образуется как бы «гофрированная» многоцепочечная структура, названная складчатым слоем (рис. 2-6). В белках нередко встречается и параллельная ß-структура.
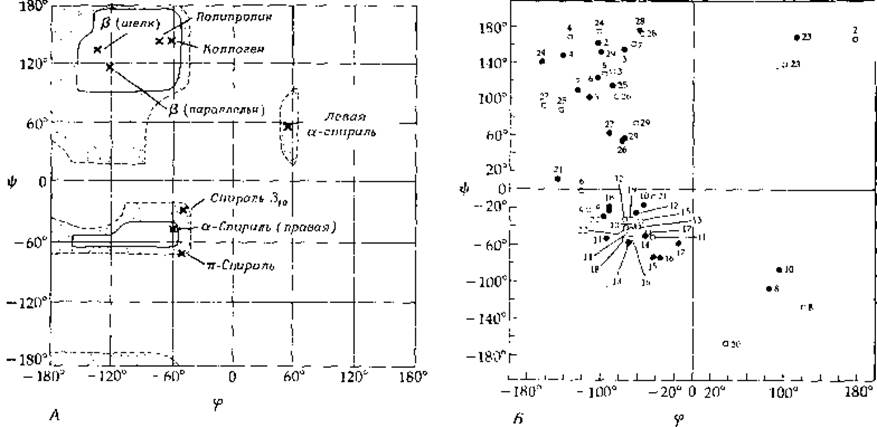
РИС. 2-5. А. Рассчитанная Рамачандраном диаграмма (конформационная карта) допустимых значений углов φ и ψ. Для двух расположенных слева областей, заключенных в сплошные рамки, стерические ограничения отсутствуют. Обратите внимание, что в эти области попадают складчатый ß-слой, коллагеновая структура и а-спираль. Области, отмеченные точками, характеризуются наличием небольших стерических барьеров, однако соответствующие конформации все же могут реализоваться. Б. График Рамачандрана для В-цепей инсулина (гл. 4, разд. Г.7); значения углов ф и ф получены с помощью построения молекулярных моделей по данным рентгеноструктурного анализа с разрешением 0,19 нм. Большая часть конформаций соответствует искаженной а-спирали или близка к ß-структуре. 8, 20 и 23—-это остатки глицина. (Blundell Т., Dodson G., Hodgkin D., Mercola D., Adv. Protein Chem., 26, 279—402, 1972.)
Таблица 2-3 Примерные значения торсионных углов для некоторых регулярных пептидных структура
|
Структура |
φ |
ψ |
|
Гипотетическая полностью вытянутая цепь полиглицина |
—180° |
+ 180°б |
|
ß-Поли (L-аланин) в антипараллельном складчатом слое |
—139° |
+ 135° |
|
Параллельный складчатый слой |
—119° |
+ 113° |
|
Полиглицин II |
—80° |
+ 150° |
|
Полн(L-пролин) II |
—78° |
+ 149° |
|
Коллагенв |
—51°, —76°, —45° |
+ 153°, +127°, +148° |
|
Правая а-спираль |
—57° |
—47° |
а По материалам комиссии IUPAC-IUB по биохимической номенклатуре, Biochemistry, 9, 3471—3479, 1970.
б Торсионные углы для полностью вытянутой цепи могут быть равным образом обозначены как +180° или —180°, что полностью эквивалентно одно другому. Для более удобного сравнения с другими структурами здесь принято, что φ = —180°, ψ = +180°.
в Набор из трех углов соответствует трем остаткам, образующим преобладающую в коллагене повторяющуюся последовательность (Pro-Gly-Pro)n (Yonath A., Traub W., JMB, 43, 461—477, 1969.)
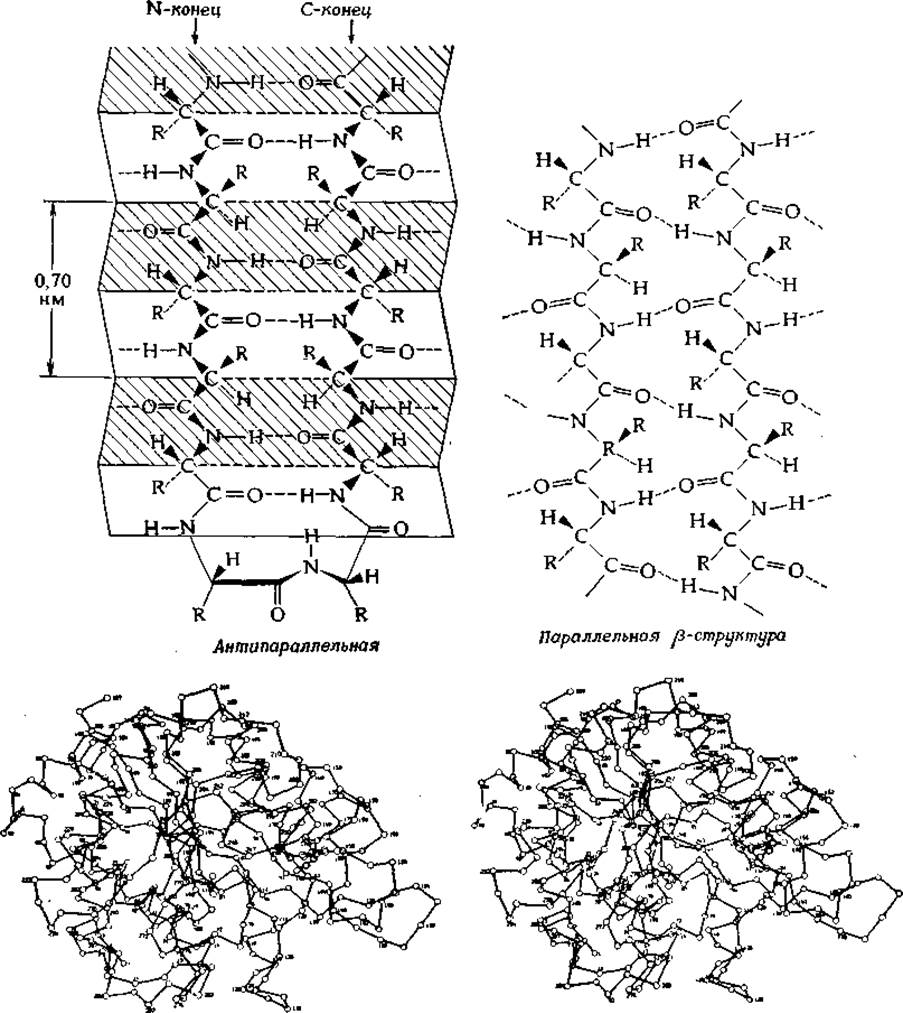
РИС. 2-6. Структура складчатого ß-слоя, образованного вытянутыми цепями. Слева показана антипараллельная структура в фиброине шелка. Периодичность — 0,70 нм — несколько меньше, чем в полностью вытянутой цепи. Боковые цепи аминокислот (R) располагаются поочередно то выше, то ниже изображенных на рисунке складок (напоминающих меха аккордеона). Пары водородных связей между цепями придают структуре большую прочность. Цепь может повернуть назад (ß-поворот, или ß-изгиб) и идти вдоль самой себя. В средней точке ß-поворота пептидная группа ориентирована почти перпендикулярно плоскости складчатого слоя. Аналогичная структура образуется из параллельных цепей (справа), хотя в этом случае расположение водородных связей чуть менее выгодно. Внизу приведено стереоизображение пептидного остова фермента карбоксипептидазы А [26]. Хотя на этом рисунке водородные связи не показаны и даны лишь положения а-углеродных атомов, все же можно различить восемь участков цепи, идущих из левой верхней части молекулы направо вниз. Эти цепи (среди которых есть и параллельные, и антипараллельные) связаны единой сетью водородных связей. Рисунок можно рассматривать через специальные стереоскопические очки, но после небольшой тренировки стереоизображение удается увидеть и без очков (этому очень полезно научиться, так как множество молекулярных структур публикуется теперь в журналах в виде стереоизображений). Поместите хорошо освещенный рисунок на расстоянии 20—30 см от глаз. Расслабьте глаза так, как будто вы смотрите в бесконечность. Из четырех возникающих изображений два центральных нужно свести в одно, что и дает стереоскопический эффект. Довольно удачная схема остова цепи в области ß-структуры приведена в книге Днккерсона и Гейса (стр. 89) [13].
в. Полиглицин II и коллаген
Известна и другая форма полиглицина, в которой каждый аминокислотный остаток повернут на 120° относительно предыдущего вокруг винтовой оси 3-го порядка (вид с торца показан на рис. 2-7,А). Угол ψ для каждого остатка равен примерно 150°, а φ ∼-80°. Смещение вдоль оси составляет 0,31 нм на остаток, периодичность — 0,93 нм. Молекулы могут образовывать как правую, так и левую спирали. Группы N—Н и С = О в такой структуре выступают из спирали перпендикулярно ее оси. При этом, как и в ß-структуре, между соседними цепочками образуются водородные связи.
Весьма сходную с полиглицином II спиральную структуру имеет поли (L-пролин). Из-за присутствия больших по размеру боковых групп более предпочтительной оказывается левая спираль. Надо сказать, что для полипептидной цепи из L-аминокислот любой способ укладки в спираль будет приводить к разной стабильности правой и левой спиралей.
В организмах животных в очень большом количестве присутствует коллаген — главный белковый компонент соединительной ткани, базальных мембран и других структур. Структурной единицей коллагена служит тропоколлаген, который, как считают, представляет собой отрезок тройной спирали размером 1,5X280 нм. Он напоминает полиглицин II (рис. 2-7,А), но содержит только три цепи. При этом индивидуальные левоспиральные цепочки оказываются далее скрученными в правую суперспираль.
Преобладание в белках какой-то одной аминокислоты — довольно редкое событие. Коллаген же содержит 33% глицина, 21% приходится на пролин + оксипролин и 11% составляет аланин. Все дело в том, что крупные по размеру боковые группы не могут уместиться внутри тройной спирали. То же самое относится и к фиброину шелка, который состоит в основном из периодически повторяющейся последовательности
(—Glу—Ser—Glу—Аlа—Glу—Аlа—)n.
В этом случае при образовании складчатого слоя все боковые группы серина и аланина оказываются по одну сторону слоя, а в другую обращены лишь атомы водорода глицина. В результате слои прилегают друг к другу более тесно — боковые цепи аланина и серина одного слоя встраиваются в промежутки между боковыми цепями аланина и серина соседнего слоя [19].
г. а-Спираль
Весьма интересный набор конформаций реализуется в том случае, когда оба угла, φ и ψ, близки к —60°. Этой области углов соответствуют спиральные структуры, стабилизированные внутрицепочечными водородными связями. Наибольший интерес представляет а-спираль (рис 2-8), причем правая спираль из L-аминокислот намного стабильнее левой. Пока в природе обнаружены только правые а-спирали. Обратите внимание, что в а-спирали все С = О и N—Н-группы, образующие пептидные связи, примерно параллельны оси спирали; при этом каждая карбонильная группа образует водородную связь с четвертой по ходу цепи N—Н-группой. Число аминокислотных остатков на виток спирали равно 3,61. Шаг спирали (поддающийся экспериментальному определению с помощью рентгеноструктурного анализа) составляет 0,541 нм.

РИС. 2-7А. Структура полиглицина II и коллагена. Л. Вид на структуру полиглицина II вдоль оси спирали. Обратите внимание на наличие винтовой оси 3-го порядка. Сходную структуру образует полипролин, а коллаген, по- видимому, представляет собой тройной «канат» из трех пептидных цепей, структура которых тоже близка к той, что здесь изображена, однако при этом наблюдается правая суперспирализация. Б. Электронная микрофотография базальной мембраны (между стрелками) и расположенных ниже коллагеновых фибрилл на срезе кожи земноводного. Нити диаметром 1,5 нм в области базальной мембраны (указаны стрелками), по-видимому, представляют собой отдельные молекулы тропоколлагена, уложенные параллельно, но с «отставанием на четверть», из-за чего и возникает периодичность в 64 нм. Некоторые фибриллы видны в поперечном сечении (помечены крестиком). (С любезного разрешения Elizabeth D. Нау.)
Роговой слой кожи, волосы, ногти, иглы дикобраза — все эти структуры построены из ряда белков, известных под общим названием кератин. Один из главных компонентов кератина1, так называемый «белок с низким содержанием серы», состоит из а-спиралей, шаг которых равен не 0,54 нм, а только 0,51 нм. Такое уменьшение шага объясняется тем, что две или три правые а-спирали обвиваются одна вокруг другой, формируя левую суперспираль, которая образует микрофибриллы диаметром около 2,0 нм [19—21]. Считают, что такая же структура лежит в основе мышечных белков — миозина [22] и тропомиозина [23] (гл. 4, разд. Е.1). Обычно оба эти белка изображают в виде двунитевых «канатов», в которых гидрофобные боковые группы одной цепи расположены в углублениях на поверхности соседней цепи2.
Встречаются и другие спиральные структуры, диаметр которых может быть как больше, так и меньше, чем диаметр а-спирали; они также играют определенную роль в формировании структуры белков [13]. В спирали З10 на один виток приходится ровно три остатка; каждый карбонил связан водородной связью с третьей по ходу цепи N—Н-группой. Таким образом, эта спираль закручена сильнее, чем а-спираль. п-спираль содержит 4,4 остатка на виток и по диаметру превосходит а-спираль. Хотя З10- и п-спирали не относятся к основным структурным элементам белков, они тем не менее встречаются в них, чаще всего образуя по одному витку на концах спиралей.
1 Принято считать, что другие белки, входящие в состав кератина, образуют аморфную «матрицу», пронизанную микрофибриллами. Одним из белков «матрицы» является «белок с высоким содержанием серы», богатый цистеином и имеющий большое число поперечных связей. Наиболее богаты цистеином волосы человека.
2 Тенденция к сплетанию и образованию структуры типа «каната» определяется тем, что стабилизирующие структуру периодически повторяющиеся связи между цепочками могут образоваться лишь в том случае, если цепочки обвиваются одна вокруг другой [23а].