Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Молекулы, из которых мы состоим
Белки
Размеры и форма молекул белка
Как внутренняя структура белков, так и их размеры и форма могут сильно различаться. Некоторое представление об имеющихся здесь возможностях дает рис. 2-12, на котором показано несколько способов укладки полипептидной цепи из 300 аминокислотных остатков. В полностью вытянутой конформации цепь растягивается до ~ 100 нм. Если ее сложить 13 раз, то образовавшийся складчатый слой будет иметь форму квадрата со стороной 7 нм и толщиной около 0,5 нм. Из той же полипептидной цепи можно получить тонкий а-спиральный стержень длиной 45 нм и толщиной ~ 1,1 нм. Вместе с двумя другими такими же цепями (при наличии соответствующего аминокислотного состава) эта цепь может дать тройную спираль коллагенового типа длиной 87 нм и диаметром ~1,5 нм. (Заметим, что это составляет около 1/3 длины молекулы тропоколлагена.)
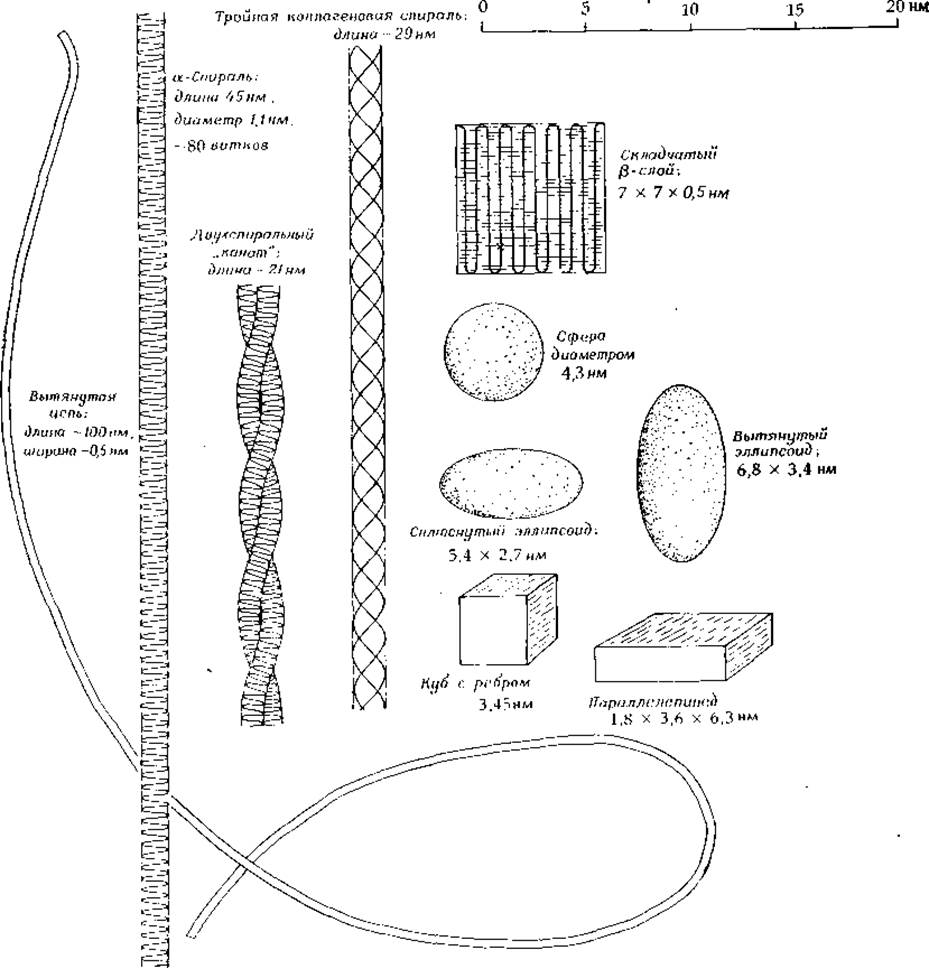
РИС. 2-12. Формы, которые может иметь молекула белка из 300 аминокислотных остатков (мол. вес —34 500).
Глобулярные белки заметно различаются по плотности упаковки и по содержанию гидратационной воды [24, 25]. Однако наиболее типична для них плотность ~1,4 г∙см-3. При средней массе остатка в 115 дальтон наш полипептид из 300 остатков составит по массе 34 500 дальтон, или 5,74∙10-20 г, и займет объем в 41 нм3. Это может быть куб с ребром 3,45 нм, параллелепипед размерами 1,8X3,6x6,3 нм, сфера диаметром 4,3 нм или же какое-то геометрическое тело весьма неправильной формы. При расчетах молекулу белка чаще всего представляют в виде идеализированного эллипсоида или цилиндра.
Полезно сравнить эти размеры с размерами самых мелких клеточных структур; например, жгутик бактерии имеет диаметр ~ 13 нм, а толщина клеточной мембраны составляет ~8—10 нм. Из кирпичиков, эквивалентных по размеру цепи из 300 остатков, могут быть построены жгутики бактерий или микротрубочки эукариот. а-Спиральный полипептид может пройти сквозь клеточную мембрану, выступая с обеих сторон, тогда как глобулярный белок с той же длиной цепи целиком уместится внутри мембраны.
Дополнение 2-А
Белки плазмы крови
Из всех белков лучше всего изучены белки, присутствующие в плазме кровиа,б,в. Простота их выделения и большое клиническое значение привели к тому, что уже в ранний период их исследования эти белки были разделены электрофоретически. Электрофорез при pH 8,6 (в барбиталовом буфере) указывает на присутствие шести главных компонентов. Быстрее всех перемещается присутствующий в наибольших количествах сывороточный альбумин. Далее следуют а1-, a2- и ß-глобулины, фибриноген и у-глобулины. Электрофорез в крахмальном геле приводит к расщеплению каждой из этих полос, так что в конце концов их получается примерно 20. Каждая из полос содержит, как правило, более одного белка. В общей сложности выделено и хорошо охарактеризовано свыше 50 белков плазмы крови. В плазме обнаружено примерно 60 ферментов, содержание некоторых из них очень мало — по-видимому, их наличие связано с выходом в плазму небольшого количества внутриклеточных белков.
В норме общее содержание сывороточных белков лежит в интервале 5,7—8,0 г на 100 мл (~1 мМ). Содержание индивидуальных белков варьирует от 3,5—4,5 г на 100 мл для альбумина до нескольких миллиграммов и менее для некоторых других белков. На втором месте по количеству идут иммуноглобулины (дополнение 5-Е); содержание одного из них (IgG) достигает 1,2—1,8 г на 100 мл. а1-Антитрипсин, а2-макроглобулин, а- и ß-липопротеиды, гаптоглобулин, трансферрин и фибриноген присутствуют в количестве более 200 мг на 100 мл.
Белки плазмы выполняют множество функций. Одна из них, присущая в основном сывороточному альбумину, состоит в поддержании в плазме достаточно высокого осмотического давления, сравнимого с давлением в цитоплазме клеток. Сывороточный альбумин человека состоит из одной цепи, содержащей 584 аминокислотных остатка; его мол. вес равен 69 000. В молекуле имеются три повторяющиеся гомологичные области — три домена, каждый из которых содержит шесть дисульфидных мостиков. Можно предположить, что в ходе эволюции ген, детерминирующий этот белок, дважды дуплицировалсяг. Сравнительно низкий молекулярный вес и высокая плотность отрицательных зарядов на поверхности молекулы очень помогают сывороточному альбумину в выполнении его функции, связанной с поддержанием осмотического давления.
Другой важной функцией сывороточных белков является их транспортная функция. Так, сывороточный альбумин связывает и переносит многие слаборастворимые продукты метаболизма. Трансферрин переносит железо, а церулоплазмин (а2-белок, см. дополнение 10-3) — медь. Транскортин — это переносчик стероидных гормонов, в частности кортизола; белок, связывающий ретинол, является переносчиком витамина А, а белки, связывающие кобаламин, переносят витамин B12. Липопротеиды, подразделяющиеся на три основных класса, переносят фосфолипиды, нейтральные липиды и эфиры холестеринад. Главным компонентом этих веществ служит липид. Фракция а1 сыворотки содержит липопротеид с высокой плотностьюе. Фракция, идущая непосредственно перед ß-белками, содержит липопротеид с очень низкой плотностью, а в ß-фракции присутствует липопротеид с низкой плотностью. Все эти белки сейчас интенсивно исследуются. Большой интерес к ним обусловлен их связью с сосудистыми заболеваниями, а также с отложением холестерина и других липидов, переносимых белками плазмы, в атеросклеротических бляшках.
Иммуноглобулины, ингибитор трипсина а1 (дополнение 7-В), десяток или больше факторов свертывания крови (рис. 6-16) и белки системы комплемента (дополнение 5-Ж) несут защитные функции; этот вопрос будет рассмотрен несколько позже. Гормоны, многие из которых являются белками (табл. 16-1), присутствуют в крови в процессе их переноса к органам-мишеням. Функции целого ряда сывороточных белков пока не известны. К ним, в частности, относятся многие гликопротеиды. Концентрация некоторых из них, например гаптоглобина (а также а2-макроглобулина), имеет тенденцию повышаться при самых разнообразных патологических состояниях организма.
а Putnam F. W. ed., The plasma Proteins, 2nd ed., Vols. 1 and 2, Academic Press, New York, 1975.
6 White A., Handler P., Smith E. L., Principles of Biochemistry, 5th ed., Chapter 30, McGraw-Hill, New York, 1973.
B Turner M. W., Hulme B., The Plasma Proteins: An Introduction, Pitman, London, 1971.
r Behrens P. Q., Spiekerman A. M., Brown I. R., Fed. Proc., 34, 591 (1975).
д Morrisett J. D., Jackson R. L., Gotto A. M., Jr., Annu. Rev. Biochem., 44, 183—207 (1975).
e Schonfeld G., Pfleger B., Roy R., JBC 250, 7943—7950 (1975).