Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Молекулы, из которых мы состоим
Нуклеиновые кислоты
Пары оснований
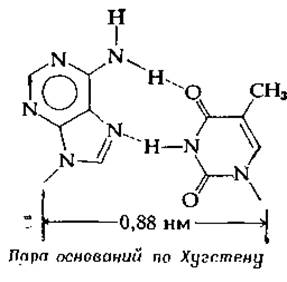
Структура пар оснований в том виде, как это было предложено Уотсоном и Криком, изображена на рис. 2-21. Хотя дифракционные данные показывают, что в ДНК присутствуют именно такие пары оснований, рассматривались и другие варианты. На рис. 2-25 изображены очертания пар оснований с указанием групп, способных к образованию водородных связей. Число групп, которые в качестве доноров или акцепторов электронов могли бы участвовать в этом процессе, получается довольно большим, а следовательно, может быть несколько вариантов спаривания оснований. Один из таких вариантов предложил Хугстен (здесь показана соответствующая этой схеме пара А—Т). Обратите внимание, что расстояние, «покрываемое» данной парой (между атомами сахара С-Г), равно 0,88 нм, что заметно меньше значения 1,08 нм для пар Уотсона — Крика. В двуспиральных структурах таких пар не обнаружено, однако не исключается возможность образования тройных спиралей, в которых присоединяемое к паре третье основание располагается по схеме Хугстена [75]. И действительно, именно такие триплеты оснований недавно обнаружены в некоторых участках молекулы тРНК [74].
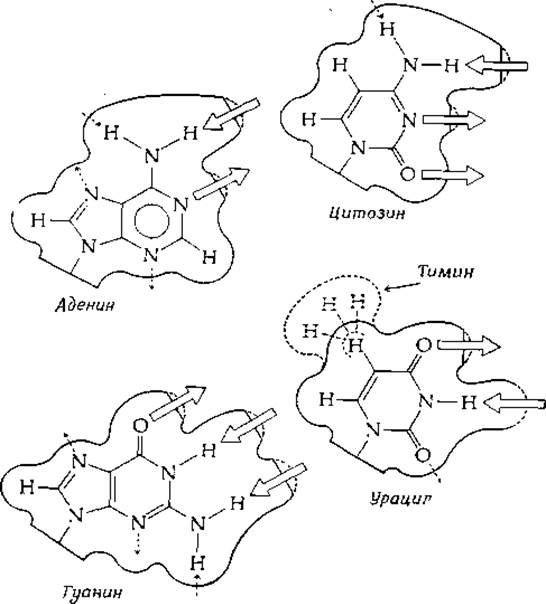
РИС. 2-25. Внешние очертания пуриновых и пиримидиновых оснований нуклеиновых кислот. Изображены поверхности, определяемые вандерваальсовыми радиусами; отмечены также некоторые из возможных направлений, вдоль которых могут быть образованы водородные связи. Толстыми стрелками указаны водородные связи, соответствующие схеме спаривания оснований по Уотсону и Крику.
В живых системах пуриновые и пиримидиновые основания взаимодействуют не только между собой, но и с белками. Они связываются с ферментами, участвующими в метаболизме нуклеиновых кислот и нуклеотидов, и выполняют роль своеобразных «держателей», с помощью которых к белкам прикрепляются многие промежуточные продукты метаболизма, а также коферменты (гл. 8).
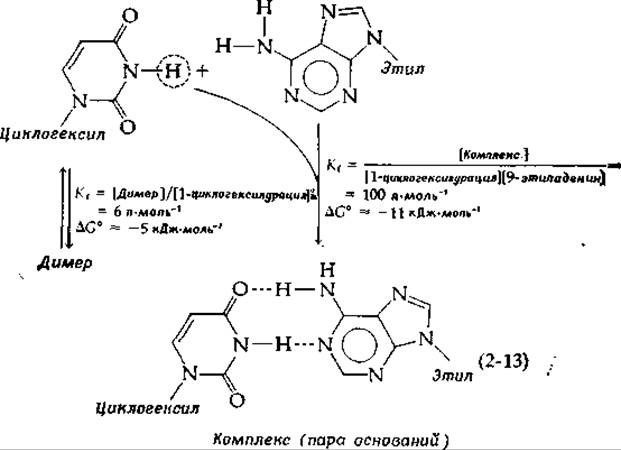
Насколько сильны связи, образуемые между парами оснований в ДНК? На этот вопрос ответить трудно, поскольку всегда имеет место сильное взаимодействие молекул с полярными растворителями. Некоторое представление об энергии этих связей дают исследования, проводимые в неполярных растворителях. Так, было показано, что 1-циклогелсилурацил образует димеры, стабилизированные или водородными связями, или стэкинг-взаимодействием, но энергия ассоциации при этом невелика, ∆G0 равно ~5 кДж∙моль-1. В смеси этого соединения с 9-этиладенином получается комплекс — пара оснований — с константой образования [см. уравнение (4-2)], более чем в 10 раз превышающей константу образования димеров [уравнение (2-13)] [68]. Когда атом водорода, который в уравнении (2-13) заключен в кружок, заменили на группу —СН3, блокирующую образование пар, константа Kiстала меньше 1 (∆G°>0). Различие в свободной энергии образования в этих двух случаях составляет всего 7 кДж∙моль-1, однако даже такая небольшая энергия, суммированная по многим парам оснований в молекуле ДНК, заметно повышает устойчивость структуры.
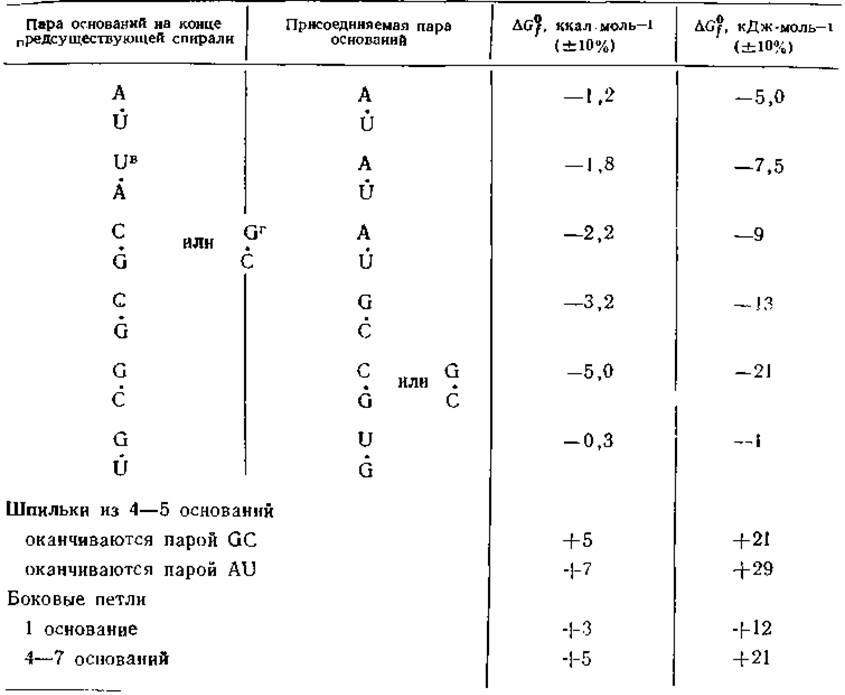
Выполненные недавно измерения энергии образования пар между всеми возможными нуклеотидами позволяют провести количественную оценку свободной энергии образования спиральных областей в молекулах РНК [76]. В табл. 2-6 приведены приращения свободной энергии образования таких спиралей из одноцепочечных структур в пересчете на одну пару оснований, присоединяемую к концу уже существующей спирали. При добавлении пары AU вклад в ∆G0fсоставляет всего от —5 до —7 кДж. Точное значение зависит от того, какое из оснований — А или U — находится на 5'-конце предсуществующей спирали. Добавление пары AU к спирали, оканчивающейся парой CG или GC, дает вклад —9 кДж∙моль-1. Большие приращения энергии имеют место при добавлении GC-пap, в которых между основаниями имеются три водородные связи, а не две, как в AU-пapax.
Таблица 2-6 Изменение свободной энергии ∆G0f при присоединении одной пары оснований к предсуществующей спирали РНК (при 25 °С)a,б
а Таблица с некоторыми изменениими заимствована из работы [76].
б Все пары оснований соответствуют следующей ориентации:
![]()
в Те же значения получаются при присоединении пары
![]()
г Те же значения получаются при присоединении пар
![]()
Пары UG также стабилизируют двойные спирали РНК, хотя и весьма незначительно. Присутствие же неспаренных оснований оказывает дестабилизирующий эффект. Наиболее прочные шпильки содержат до 4—5 оснований. В зависимости от того, какой парой заканчивается шпилька — GC или AU, — спираль дестабилизируется на 20—30 кДж∙моль-1. «Малые петли», отходящие с одной стороны спирали, вносят меньший дестабилизирующий эффект. Рис. 2-26 дает пример того, как с помощью табл. 2-6 можно оценить энергию образования петель в линейной цепи РНК.