Биохимия - Химические реакции в живой клетке Том 1 - Д. Мецлер 1980
Молекулы, из которых мы состоим
Как мы изучаем структуру молекул
Конформация макромолекул
Многие физические методы, упоминавшиеся в предыдущем разделе, сводятся к измерению величин, зависящих как от молекулярного веса, так и от формы молекул. Следовательно, те же методы могут использоваться и для определения конформации. Однако намного более ценными в этом отношении являются два других метода: рентгеноструктурный анализ кристаллических соединений и получение спектров ядерного магнитного резонанса (ЯМР) соединений, находящихся в растворе.
а. Рентгеноструктурный анализ
Вскоре после открытия рентгеновых лучей по дифракционным картинам, получаемым при прохождении через кристалл рентгеновского пучка, стали определять межатомные расстояния и устанавливать структуру кристалла. Этот метод был настолько усовершенствован, что позволял устанавливать структуру довольно сложных органических соединений, затрачивая на эксперимент всего несколько дней. При этом наиболее серьезной проблемой, затрудняющей применение рентгеноструктурного метода, часто оказывалось приготовление достаточно крупных и совершенных кристаллов.
В последние годы рентгеноструктурный анализ широко применяется для определения структуры молекул белков и нуклеиновых кислот. Длины и углы связей, точно установленные для малых молекул, используются как стандартные значения в предположении, что они сохраняются такими же и в более сложных полимерных структурах. Одним из этапов определения структуры белков и нуклеиновых кислот является построение молекулярных моделей полимеров, согласующихся с рентгеновскими данными и сохраняющих стандартные значения длин связей и валентных углов (рис. 4-19, Б) [71].
б. Ядерный магнитный резонанс (ЯМР) [157—162]
В основе ЯМР-спектроскопии лежит поглощение электромагнитных волн в радиочастотном диапазоне ядрами, обладающими магнитным моментом. Все ядра с нечетными массовыми числами (например, 1Н, 13С, 15N, 17O, 19F и 31Р), равно как и ядра с четным массовым числом, но нечетным атомным номером, обладают магнитными свойствами, в то время как 12С и 16О немагнитны. Поглощение кванта энергии E = hv происходит лишь в том случае, когда ядра находятся в сильном
магнитном поле ЯМР-спектрометра. В спектрометре с рабочей частотой 100 МГц (v = 100 МГц) энергия кванта составляет всего Е = 6,625∙10-34∙108 = 0,04 Дж∙моль-1, что на пять порядков ниже среднего значения энергии теплового движения молекул (3,7 кДж∙моль-1). Таким образом, спиновый переход, индуцированный в ЯМР-спектрометре, не оказывает заметного влияния на химические свойства молекул.
Резонансная частота v, при которой в спектрометре происходит поглощение энергии, есть
v = μH0/h, (2-32)
где Н0 — напряженность внешнего магнитного поля, μ — магнитный момент исследуемых ядер, h — постоянная Планка.
В принципе спектр ЯМР можно получить, поддерживая магнитное поле Н0 постоянным и определяя, при какой частоте произойдет поглощение, как это делается при снятии ультрафиолетовых, видимых и инфракрасных спектров (гл. 13). Однако ЯМР-спектрометры работают при фиксированной частоте (чаще всего 60, 100 и 220 МГц), наиболее мощные из них — на частотах свыше 300 МГц. При снятии спектра магнитное поле, создаваемое мощным электромагнитом спектрометра, изменяют с постоянной скоростью. Тем не менее ЯМР-спектры всегда выражают в виде сдвигов частоты в герцах, как будто изменялась частота генератора.
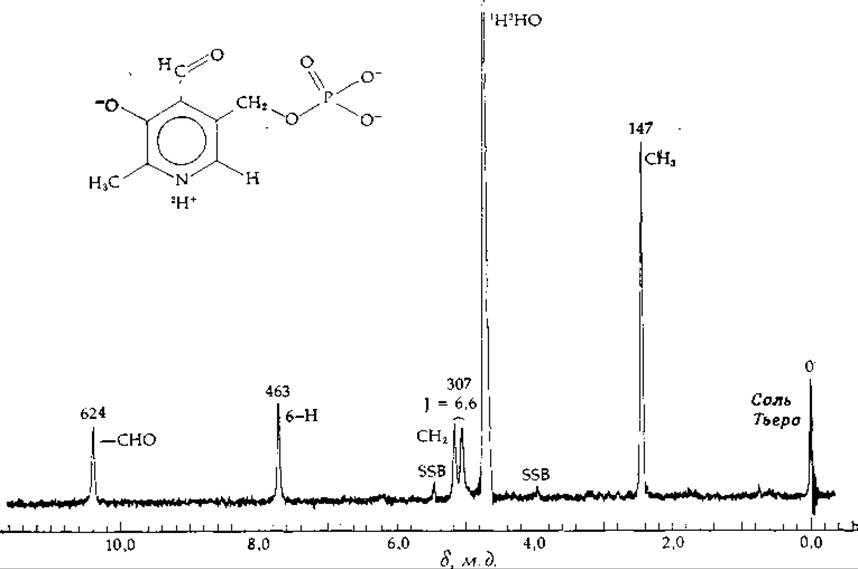
РИС. 2-40. Спектр ПМР для пиридоксаль-5'-фосфата; спектр снят при 60 МГц; pD = 7,05. Внутренним эталоном служит соль Тьера. Над каждым пиком указана величина химического сдвига в герцах, внизу изображена шкала. Для усреднения неоднородностей магнитного поля ампула с образцом в ходе измерений быстро вращается вокруг своей оси. Неполное усреднение приводит к появлению так называемых боковых сигналов; на нашем рисунке это два пика, обозначенные SSB. (С любезного разрешения J. Likos.)
На рис. 2-40 показан протонный спектр ЯМР (спектр ПМР) кофермента пиридоксальфосфата в растворе 2Н2О (окись дейтерия); спектр снят в спектрометре с рабочей частотой 60 МГц (см. также работу [163]). Из такого спектра можно определить четыре параметра. 1. Интенсивность (площадь пика). В протонных спектрах ЯМР эти площади, обычно пропорциональны числу химически эквивалентных протонов, дающих данный пик. 2. Химический сдвиг — разницу в частотах пиков, отвечающих данному протону и какому-то эталонному соединению. На рис. 2-40 эталонный пик расположен в правой части спектра и отвечает соли Тьера (3-триметилсилил-1-пропансульфонат натрия). 3. Ширину пика (в герцах) на половине его высоты. Для быстро движущихся в растворе молекул ширина протонного пика равна — 0,1 Гц. 4. Константы спин-спинового взаимодействия, которые являются мерой взаимодействия между соседними ядрами, обладающими магнитным моментом.
При Н0 = 14 000 Гс и частоте 60 МГц протонные сигналы от органических соединений растягиваются на интервал примерно в 700 Гц. Положение сигналов всегда определяется по отношению к пику для некоторого эталонного соединения, расположенному в высокочастотной области. Для протонов эталонным соединением служит чаще всего тетраметилсилан (ТМС), инертное вещество, которое можно добавлять прямо в ампулу с образцом. Поскольку биохимики в качестве растворителя обычно используют D2О, эталоном служит водорастворимая соль Тьера. Положения пиков для двух соединений различаются лишь незначительно.
При снятии спектра ЯМР в D2О часто бывает необходимо знать, значение «pD» среды. Обычно в этом случае к показаниям рН-метра прибавляют 0,40.
В молекулах, подобных ТМС, ядра экранированы от внешнего магнитного поля окружающими их электронами, поэтому сигналы расположены в области более высоких частот (более высоких энергий). Протоны, связанные с атомом углерода или каким-либо другим атомом, имеющим дефицит электронов (из-за того, что они связаны с атомами или группами, оттягивающими электроны на себя), такой экранировки не имеют (разэкранированы). Чем сильнее разэкранировка, тем сильнее слабопольный сдвиг пика ЯМР от положения сигнала ТМС. В спектре, изображенном на рис. 2-40, пик, соответствующий 2-метильным протонам, расположен на 147 Гц левее пика от соли Тьера, но все же соответствуют сравнительно высокому полю. В ароматических кольцах протоны очень сильно разэкранированы за счет кольцевого тока, обусловленного п-электронами. Так, пики, соответствующие 5-метиленовым протонам, которые расположены вблизи ароматического кольца, смещены на 303 и 310 Гц в слабое поле. Протон, непосредственно связанный с кольцом, разэкранирован еще сильнее, и его пик смещен в слабое поле на 463 Гц. 4'-водород альдегидной группы разэкранирован вследствие электронных токов в карбонильной группе; его пик расположен в еще более слабом поле.
Величину такого химического сдвига, т. е. смещение резонансных частот химически неэквивалентных ядер относительно, частоты стандартного вещества, можно выражать прямо в герцах, но тогда химический сдвиг будет возрастать с увеличением магнитного поля — в спектрометре на 100 МГц он будет больше, чем в спектрометре на 60 МГц. Чтобы этот параметр не зависел от типа прибора, вводится величина δ, измеряемая в миллионных долях (м. д.):
![]()
δ представляет собой относительный сдвиг частоты и не зависит от напряженности поля. Однако зависимость от эталонного соединения остается, поэтому, приводя значение δ, указывают, относительно какого соединения оно определялось. Несколько реже используют шкалу τ
т = 10—δ (относительно ТМС). (2-34)
На энергию спинового перехода протона сильное влияние оказывают локальные поля, создаваемые другими магнитными ядрами, в частности другими протонами. Такое спин-спиновое взаимодействие (связь) приводит к расщеплению сигналов протонного спектра ЯМР на несколько близко расположенных линий. Так, этильная группа чаще всего представлена четырьмя расположенными на одинаковом расстоянии друг от друга линиями, соответствующими СН2-группе, и тремя линиями от СН3-протонов. Протоны, присоединенные к одному и тому же атому углерода, обычно не дают расщепления собственных линий, но зато приводят к расщеплению сигналов от протонов, связанных с соседними атомами углерода. Эти соседние протоны могут находиться в любом из двух спиновых состояний, что проявляется в разнице энергии рассматриваемых ЯМР-переходов, которую легко измерить [157—161].
Константа спин-спинового взаимодействия J представляет собой расстояние в герцах между соседними пиками мультиплета. Эта величина не зависит от напряженности поля, а следовательно, и от частоты спектрометра. Представленный на рис. 2-40 сигнал от 5'-метиленовых протонов расщепляется вследствие 1Н-31Р-взаимодействия с J ≃ 7 Гц. Чем ближе расположены ядра друг к другу, тем сильнее спин-спиновое взаимодействие, однако иногда оно может проявляться и на расстоянии пяти ковалентных связей.
При наличии подозрения на взаимодействие часто применяют технику двойного облучения, или спиновой развязки. Образец облучают при резонансной частоте одного из участвующих в спин-спиновом взаимодействии ядер, а спектр снимают в интервале резонансных частот другого ядра пары. При этих условиях мультиплет вырождается в синглет, что и свидетельствует о взаимной связи двух ядер.
Константа спин-спинового взаимодействия между двумя протонами, связанными с соседними атомами углерода (или другими атомами), зависит от торсионного угла <р [уравнение (2-35)]1.
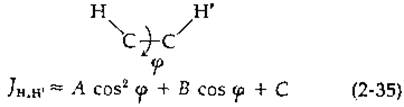
Уравнение Карплуса (2-35) получено теоретическим путем, но константы А, В и С подбираются эмпирически [164]. В выписанных ниже приближенных уравнениях (2-36)—(2-38) [164] средний член уравнения (2-35) опущен:
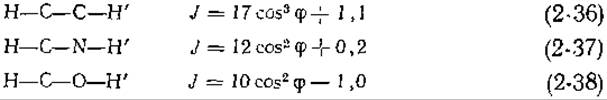
Поскольку второй член в этих уравнениях равен 1 Гц или меньше, часто используют одночленное уравнение Карплуса.
Спектры ЯМР позволяют определять торсионный угол между атомами водорода при а-углероде аминокислотного остатка и соседнем атоме азота пептидной связи (φ', но не φ)2; это позволяет установить, в какой конфигурации находится пептидная группа — цис или транс.
![]()
1 Уравнение можно записать и в таком виде: J ≈ A'+B'cos φ+C'cos 2φ (M. Karplus, JACS, 85, 2870—2871, 1963). Поскольку cos 2φ = 2cos2φ—1, это эквивалентно уравнению (235), но константы А', В' и С' получаются иными. Встречается также форма записи через sin2φ.
2 Если φ (разд. Б.3) = 180°, φ'≃+120.
Метод ЯМР использовался для определения конформации малых пептидов и полиэфиров [165—167] и структуры углеводов [168] и нуклеотидов.
Весьма ценную информацию дают спектры ЯМР, снятые в присутствии парамагнитных ионов лантанидов, таких, как европий (Eu) и празеодим (Рr) [169, 169а]. Эти ионы индуцируют существенные сдвиги многих сигналов ЯМР, что при наличии определенных эмпирических соотношений помогает определить структуру того или иного соединения.
Спектры ПМР белков чрезвычайно сложны, однако в их расшифровке достигнуты весьма значительные успехи [170—175]. На рис. 2-41 приведены спектры ПМР «фермента рибонуклеазы, полученные при 60 и 220 МГц. Как легко видеть, при более высокой частоте разрешение выше. Обращает на себя внимание и тот факт, что после тепловой денатурации фермента (до 72,5°С) многие сигналы спектра, снятого при 220 МГц, оказываются более узкими. Это означает, что в результате денатурации все однотипные боковые группы белка попадают в примерно эквивалентное окружение. Кроме того, было показано, что спектры ПМР для белков, находящихся в конформации статистического клубка, хорошо соответствуют спектрам, которые можно получить, исходя из стандартных химических сдвигов отдельных аминокислот [171], что согласуется с изложенным выше.
Как правило, спектры ПМР снимают в D2O, поскольку сигнал Н2O накладывается на большую часть спектра. Все же при снятии спектров в Н2O на далеком слабопольном конце спектра (δ > 10) видны слабые пики от NH-протонов имидазольных боковых цепей (рис. 2-42). Спектры, снятые при трех разных значениях pH, показывают, что при повышении pH от 4,4 до 8,9 сигнал, соответствующий наименьшей энергии, смещается от 12,9 до 11,1 м. д. При промежуточном значении pH (5,31) пик занимает промежуточное положение, довольно близкое К положению пика при pH 4,4. Снимая зависимость химического сдвига от pH, получают S-образную кривую титрования (гл. 4, разд. В), по которой можно оценить значение рКа диссоциирующих групп. Для гистидина (который считается функциональной группой активного центра фермента; см. гл. 7, разд. Д. 2) полученное таким образом рКа равно 5,8.
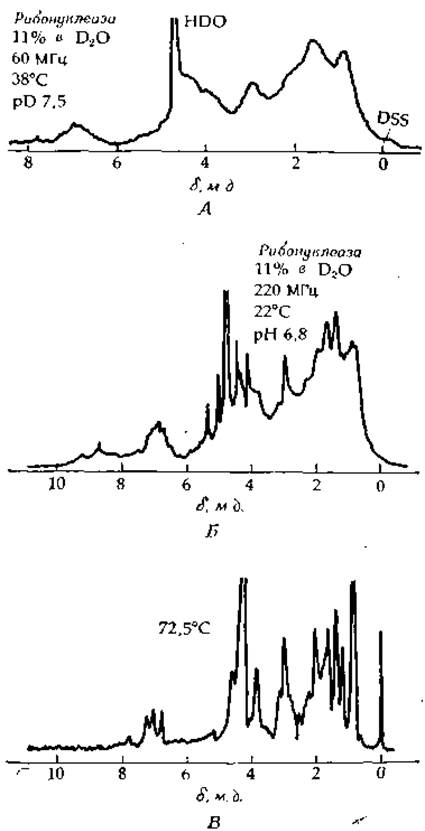
РИС. 2-41. Спектр ПМР для нативной рибонуклеазы, снятый при 60 МГц (А) и 220 МГц (Б) и для денатурированного фермента, снятый при 220 МГц (В). Концентрация фермента в 2H2О составляла 11%, pD = 7,5 (А) и 6,8 (Б). Эталон — соль Тьера (MacDonald С. С., Phillips W. D., J. Am. Chem. Soc., 89, 6333, 1967).
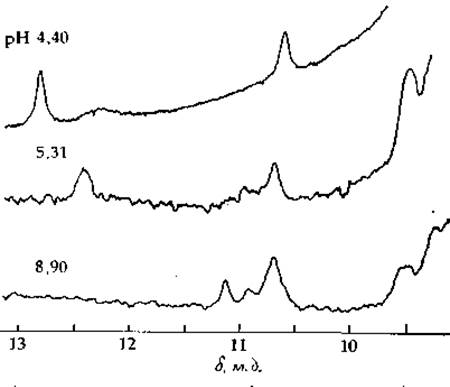
РИС. 2-42. Спектр ПМР для рибонуклеазы А в растворе 0,1 М NaCl при температуре 22°. Три спектра соответствуют трем значениям pH: 4,4; 5,3 и 8,9. Каждый спектр есть результат усреднения нескольких измерений; операция усреднения проводилась, на ЭВМ Varian С1024 (Griffen J. Н. et al., Biochemistry, 12, 2097, 1973).
В протонных спектрах ЯМР (до 360 мгц) молекул тРНК удалось, идентифицировать 26 резонансных линий, соответствующих двадцати: протонам, участвующим в образовании водородных связей между парами оснований (N—Н—N, рис. 2-24) и водородных связей, стабилизирующих третичную структуру (в частности, водородных связей в триплетах оснований по схеме Хугстена; разд. Г.6) [176].
в. Магнитный резонанс на ядрах 13С (13С-ЯМР)
Использование ядер 13С в ЯМР-спектроскопии довольно ограниченно в связи с малым природным содержанием этого изотопа. Еще одна трудность связана с наличием спин-спинового взаимодействия между 13С и 4H, поскольку в органических соединениях в нем участвует большое число протонов. Поразительные успехи в развитии 13С-ЯМР-спектроскопии были достигнуты благодаря использованию «широкополосного подавления связи 13С—4Н (шумовой развязки). Поскольку природное содержание 13С составляет всего 1,1%, этот изотоп редко занимает в молекуле соседние положения. Таким образом, (13С—13С) взаимодействие не вносит никаких осложнений и в 13С-ЯМР-спектре с применением шумовой развязки каждый атом углерода дает одиночный пик. Однако даже и в таком виде 13С-ЯМР-спектроскопия не находила широкого практического применения до тех пор, пока не появились импульсные спектрометры, основанные на использовании Фурье-преобразования [181]. В таких приборах образец облучают сильным радиочастотным импульсом длительностью в несколько микросекунд. Каждый следующий импульс поступает через 1—2 с, так что за 1—2 с снимается эквивалент обычного спектра ЯМР. Данные поступают на ЭВМ, где накапливаются спектры, многократно зарегистрированные в течение нескольких минут, часов или даже дней. Это позволяет получать спектры 13С-ЯМР с большой точностью.
Химические сдвиги в спектрах 13С-ЯМР часто составляют 100 м. д. и даже больше относительно ТМС. Присутствие при атоме углерода нескольких групп-заместителей чаще всего дает аддитивный эффект [177].
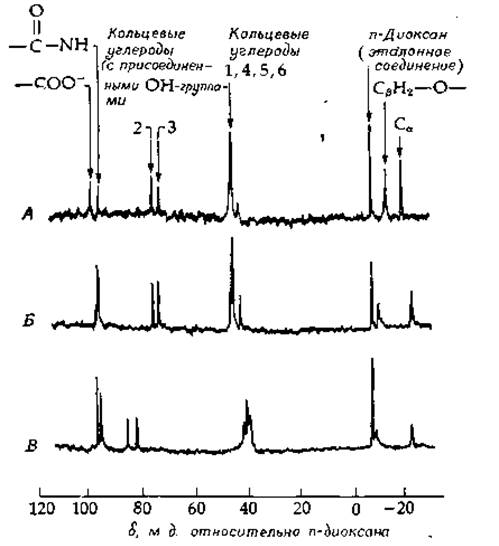
РИС. 2-43. Спектр ЯМР ядер 13С с шумовой развязкой 13С—Н. А. Мономер энтеробактина [N-(2,3-диоксибеизоил)-L-серии]. Б. Свободный эитеробактии. В. Ga3+-энтeробактии. Препараты растворяли в (CD3)2SO при ~50°. Химический сдвиг отсчитывался от внутреннего эталона, n-диоксаиа. Приведенные результаты есть результат усреднения от 17 000 до 49 000 спектров (Llinas М. et al., Biochemistry, 12, 3840, 1973).
На рис. 2-43 приведен спектр 13С-ЯМР соединения, синтезируемого бактерией Е. coli, — энтеробактина, который образует комплекс с железом. Он представляет собой циклический тример 2,3-диокси-N-бензоил-L-серина (рис. 2-44). Статья [167], из которой взят рис. 2-43, помимо того, что иллюстрирует применение спектров ЯМР для установления структуры, очень интересна с биохимической точки зрения. Образование комплекса с трехвалентными ионами вызывает в молекуле энтеробактина сильные конформационные изменения. Сравнение свободного энтеробактина с его галлиевым хелатом показывает, что угол ψ почти не меняется; φ вместо 60° становится равным —150°, а соответствующий боковой цепи угол χ принимает значение 60° (вместо прежних 162°). В свободном энтеробактине амидная группа почти плоская, в хелате же торсионный угол ω меняется до —133°.
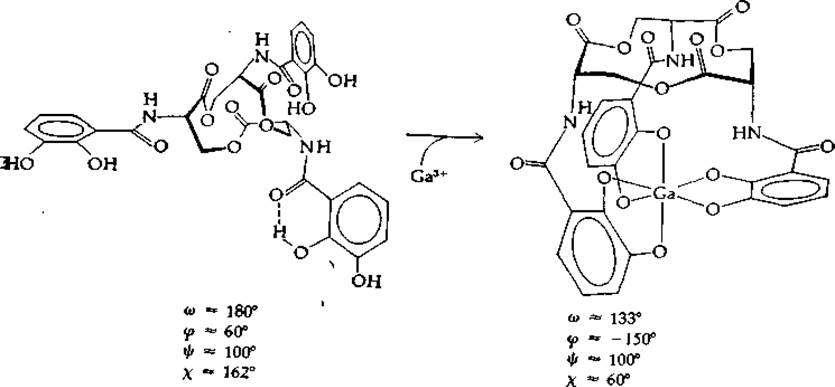
РИС. 2-44. Структура энтеробактина из Е. coli, способного образовывать комплекс с железом, а также структура его комплекса с ионом галлия Ga3+[167].
13С-ЯМР применяется и для исследования структуры белков. На рис. 2-45 показана часть 13С-ЯМР-спектра цитохрома с (гл. 10, разд. Б.5). Многие из резонансных линий удалось идентифицировать — они принадлежат атомам углерода, входящим в состав ароматических, аминокислот или порфиринового кольца. Обратите внимание на поразительные изменения спектра при восстановлении железа из ферри в ферро-состояние.
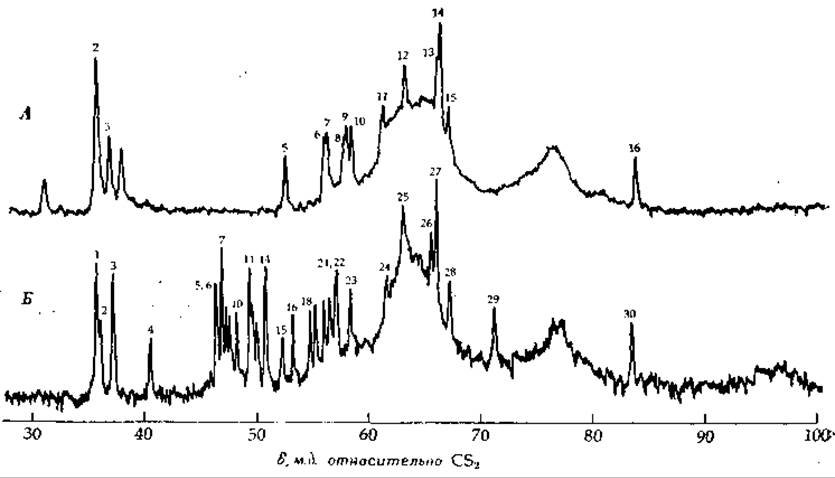
РИС. 2-45. Часть 13С-ЯМР-спектра цитохрома с из сердца лошади, где расположены полосы резонансного поглощения ароматических углеродов и атомов аргинина. Спектр снят с применением шумовой протонной развязки при pH 6,7; температура 41 °С, частота 15,18 МГц. А. Феррицитохром с, 14,4 мМ (результат усреднения! 46 000 спектров, снятых в течение 14 ч). Б. Ферроцитохром с, 11,5 мМ (результат усреднения 16 384 спектров) [178].
г. Магнитный резонанс на ядрах 31Р
Чувствительность ЯМР на ядрах фосфора составляет всего 1/15 от чувствительности протонного ЯМР, однако в биохимии такие спектры ЯМР применяются довольно широко. Особый интерес представляет возможность измерить pH во внутриклеточной среде по химическому сдвигу сигнала ЯМР от ортофосфата (неорганического фосфата, Pi) [182]. ЯМР на ядрах 31Р позволяет следить за ходом химических реакций с участием фосфорилированных субстратов, протекающих внутри клеток [183—185]. Недавно при исследовании белков и других биохимических соединений стали применять ЯМР на ядрах 15N естественного содержания [186].
д. Оптические методы исследования конформации
О конформационных изменениях полимеров часто можно судить по изменению спектров поглощения ароматических боковых цепей аминокислот, а также пуриновых и пиримидиновых оснований (рис. 2-28). Другими ценными методами являются инфракрасная спектроскопия, раман-спектроскопия, флуоресцентный анализ и КД-спектроскопия; все эти методы рассматриваются в г л. 13.
Вопросы и задачи
1. Нарисуйте следующие структуры, стабилизированные водородными связями:
а. димер уксусной кислоты;
б. тирозин-карбоксилатную группу в молекуле белка;
в. ионную фосфат-гуанидиниевую пару в фермент-субстратном комплексе;
г. пары оснований GC и GU (напомним, что пара GU не укладывается в схему Уотсона — Крика).
2. Нарисуйте структуры возможных таутомерных форм катиона, образующегося при протонировании 9-метиладенина.
3. Заполните следующую таблицу:
|
Название |
Мономер |
Тип связи |
Примерный молекулярный вес |
|
Белок Полисахарид Нуклеиновая кислота |
|||
|
Тейхоевая кислота поли-β-оксибутираг |
4. Попробуйте предсказать, в какой конформации скорее всего окажутся приведенные ниже пептидные фрагменты в белке — в а-спирали или в составе ß-структуры.
а. поли-β-лейцин;
б. поли-L-валин;
в. Pro-Glu-Met-Val-Phe-Asp-Ile;
г. Pro-Glu-Ala-Leu-Phe-Ala-Ala.
5. Сравните растворимость в воде и в эфире аминокислот и насыщенных жирных кислот и их физическое состояние. Как эти различия связаны со структурой указанных соединений?
6. Какие функциональные группы встречаются в боковых цепях белков? Каково структурное и функциональное значение а) гидрофобных групп; б) кислых и основных групп; в) сульфгидрильных групп?
7. Составьте таблицу значений рKа для кислых и основных групп, входящих в состав белка. Какие из этих групп больше всего влияют на кривые титрования белков?
8. рКадля трипептида L-Ala—L-His—L-Gln имеет следующие значения: 3,0 (а-СООН), 9,1 (a-NH3), 6,7 (имидазол).
а. Какова изоэлектрическая точка трипептида — значение pH, при котором его суммарный заряд равен нулю? Указание: для аминокислот pi обычно является среднеарифметическим двух значений рКа (см. Е. J. Cohn and J. Т. Edsall, «Proteins, Amino Acids and Peptides», pp. 90—93. Reinhold, New York, 1943).
б. Нарисуйте структуры ионных форм, которые пептид принимает при pH 5 и pH 9. При каждом из этих значений pH рассчитайте процентное содержание каждой ионной формы. Указание: определение понятий pH и рКа можно найти в гл. 4, где подробно объясняется их смысл и рассматриваются свойства буферов.
9. Перечислите названия всех изомерных трипептидов, содержащих по одному остатку тирозина, аланина и валина.
10. а. Напишите структурную формулу глидил-L-триптофанил-L-пролил-L-серил-L-лизина.
б. Какие аминокислоты можно получить из этого пептида в результате кислотного гидролиза?
в. В результате щелочного гидролиза?
г. В результате обработки азотистой кислотой с последующим кислотным гидролизом?
д. Куда будет смещаться этот пептид в электролитической ванне при pH 7,0 — к катоду или к аноду? Чему примерно равна его изоэлектрическая точка?
е. Если раствор этого пептида привести к pH 7, а затем титровать гидроокисью натрия в присутствии 10% формальдегида, то сколько эквивалентов основания на моль пептида потребуется для того, чтобы повысить pH до 10?
11. Сравните структурные особенности и свойства следующих белков: фиброина шелка, а-кератина, коллагена, бычьего сывороточного альбумина.
12. Как обычно меняется растворимость белков с изменением pH? Почему?
13. Известно, что пептид содержит только L-лизин и L-метионин. Из данных по титрованию следует, что на каждую свободную карбоксильную группу пептида приходятся 3 свободные аминогруппы. При обработке пептида азотистой кислотой (HNCО2) в аппарате Ван-Слайка каждая аминогруппа освобождает 1 моль N2. Если провести полный кислотный гидролиз дезаминированного пептида и вновь обработать гидролизат HNO2, то высвобождается то же количество N2, что и из исходного пептида. Обработка исходного пептида избытком динитрофторбензола дает динитрофенильный (ДНФ) пептид, который по спектрофотометрическим данным содержит по три ДНФ-группы на каждую свободную карбоксильную группу. После полного гидролиза этого ДНФ-пептида выявляются следующие продукты: бесцветное соединение, содержащее S (А4); соединение желтого цвета, содержащее S (А2), и соединение желтого цвета, не содержащее S (А3). При частичном гидролизе ДНФ-пептида образуются A1, А2и А3 и еще четыре соединения, имеющие желтую окраску — B1, В2, В3 и В4. При полном гидролизе из B1 образуется А1 А2 и А3; из В2 — A1 и А2; из В3 —A1и А3, а из В4— только А3. Какова наиболее вероятная структура исходного пептида?
14. Дисахарид, не обладающий редуцирующими свойствами, при обработке его диметилсульфатом и щелочью дает октамегильное производное. Кислотный гидролиз этого производного приводит к образованию 1 моля 2,3,4,6-тетраметил-D-глюкозы и 1 моля 2,3,4,6-тет» раметил-D-галактозы. Дисахарид быстро гидролизуется мальгазой или лактазой (ß-галактозидазой).
Дайте этому дисахариду подходящее описательное наименование и изобразите его хеуорсову проекционную формулу.
15. Альдопентоза (А) в D-конфигурации при окислении концентрированной азотной кислотой дает 2,3,4-триоксипентандиоловую кислоту (триоксиглутаровую кислоту, В), не обладающую оптической активностью. При добавлении к A HCN с последующим гидролизом, лактонизацией и восстановлением образуются две стереоизомерные альдогексозы (С и D). Окисление D дает оптически неактивную 2,3,4,5-тетраоксигександиоловую кислоту (сахариновая кислота, Е). Напишите структурные формулы соединений А—Е.
16. Какие продукты образуются в результате реакции йодной кислоты с сорбитом?
17. 10,0 г гликогена после метилирования и кислотного гидролиза дают 6,0 миллимолей 2,3-ди-О-метилглюкозы.
а. Какой процент остатков глюкозы в гликогене содержат замещенные группы в а-(1—>6) -положении?
б. Чему равно среднее число остатков глюкозы на каждый неразветвленный отрезок цепи?
в. Сколько миллимолей 2,3,6-три-О-метилглюкозы могло бы образоваться из этого полимера?
г. Сколько остатков глюкозы содержит полисахарид, если его мол. вес равен 2∙106?
д. Сколько нередуцирующих концов приходится на молекулу, или, иными словами, сколько цепей содержит молекула?
18. Что такое температура плавления (Тпл) препарата ДНК? Как Тпл зависит от нуклеотидного состава и как это можно объяснить?
19. Нарисуйте схему полинуклеотидных фрагментов молекул ДНК и РНК и укажите места разрыва цепи при следующей обработке:
а) НСl, мягкий гидролиз;
б) НСl, более жесткий гидролиз;
в) NaOH, мягкий гидролиз;
г) NaOH, более жесткий гидролиз;
д) панкреатической рибонуклеазой;
е) панкреатической ДНКазой;
ж) ДНКазой селезенки;
з) фосфодиэстеразой селезенки;
и) фосфодиэстеразой змеиного яда;
к) микрококковой ДНКазой.
20. Кислотный гидролиз препарата ДНК дал следующий состав оснований (в %): аденин — 24,0; тимин —33,0; гуанин — 23,0; цитозин — 20,0. Это весьма необычный результат. Укажите две его особенности и предложите возможные объяснения этого факта, исходя из особенностей структуры ДНК.
21. Йодное число соединения определяется как количество I2 в граммах, поглощенное одним граммом жира при насыщении С = С-связей (с образованием дииодпроизводных). Примечание: обычно применяют галогенизирующие реагенты йодистый монохлорид (ICl) и йодистый монобромид (IВr), однако подное число выражают именно в граммах І2. Число омыления — это количество КОН в граммах, необходимое для полного омыления (гидролиза и последующей нейтрализации жирных кислот) 1 г жира. Имеется чистый триглицерид с числом омыления 198 и йодным числом 59,7.
а. Каков его молекулярный вес?
б. Чему равна средняя длина цепи жирных кислот?
в. Сколько двойных связей содержится в молекуле триглицерида?
22. Спермацет (воск, извлекаемый из головы кашалота) как по физическим свойствам, так и по инертности по отношению к таким реагентам, как Вr2/СНСl3 и КМnO4, напоминает высокомолекулярные-углеводороды; качественный анализ позволяет определенно говорить лишь о присутствии в спермацете углерода и водорода. Однако ИК-спектры свидетельствуют о наличии в структуре сложноэфирной связи, а количественный анализ дает эмпирическую формулу С16Н32O. Титрование пробы раствора, полученного в результате длительного перемешивания воска в спиртовом растворе КОН, показывает, что на каждые 475 г воска приходится один эквивалент основания. При добавлении к охлажденной смеси воды и эфира она разделяется на два слоя — водный и эфирный. Подкисление водного слоя дает твердый продукт А, эквивалент которого по реакции; нейтрализации составляет 260±5. После испарения эфира образуется твердое, нетитрующееся вещество В. Восстановление как спермацета, так и вещества А литий-алюминий-гидридом дает в качестве единственного продукта вещество В.
Какова наиболее вероятная структура спермацета?
23. а. Объясните вкратце два преимущества метода изотопного разведения.
б. Исходя из приводимых ниже данных, рассчитайте количество-сАМР (циклического АМР), присутствующего в 1 мл клеток седалищной мышцы человека. Клетки обрабатывали 32Р-сАМР с удельной активностью 50 мкКи∙мкмоль-1 в течение 0,2 ч (при: этом весь сАМР был поглощен клетками). Далее клетки подвергали гомогенизации, после чего выделяли и очищали растворимый сАМР. Удельная активность выделенного сАМР оказалась равной 10 мкКи∙мкмоль-1. Суммарное количество добавленного сАМР составляло 1,0∙10—7 молей на 1 мл клеток.
24. Рисунок в дополнении 2-В иллюстрирует высокоэффективное разделение растворимых белков Е. coli. В белки были включены 14C-аминокислоты.
а. Как бы вы поставили эксперимент с введением метки?
б. Какие другие изотопы можно использовать для мечения белков? Какие химические формы изотопа вы бы предпочли? Какие здесь возможны ограничения?
в. Какие растворимые компоненты клеток Е. coli, обработанных ультразвуком, могут помешать проведению подобного двумерного- разделения и как их можно удалить?
г. Какие еще методы (помимо использования радиоактивных изотопов) можно применить для выявления локализации белков?
д. Если бы можно было обнаружить все растворимые белки Е. соli, то сколько отдельных белков вы ожидали бы увидеть?
е. Укажите по крайней мере два наиболее важных качества, которыми должен обладать метод разделения, для того чтобы его можно было применить к системам, содержащим очень большое число белков.
25. 35S испускает только ß-частицы; процесс распада характеризуется следующими параметрами: t1/2 = 86,7 дня, εмакс = 0,168 МэВ.
а. Напишите уравнение радиохимического распада 35S.
б. Рассмотрите преимущества и ограничения, связанные с использованием 35S в качестве изотопной метки.
26. Располагая некоторым количеством агарозы, бромциана, 6-аминогексановой кислоты и другими компонентами, необходимыми для проведения аффинной хроматографии, укажите, какие химические реакции должны обеспечить связывание триптофана через его аминогруппу.