Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Коферменты - особые природные специализированные реагенты
Связанный биотин в роли простетической группы
Витамин биотин, обнаруженный в тканях, прочно присоединен ковалентной связью к белкам. Первые сведения об этом были получены в работе [4], авторы которой выделили из автолизатов быстро растущих дрожжей содержащее биотин вещество биоцитин, ε-N-биотинил-L-лизин:
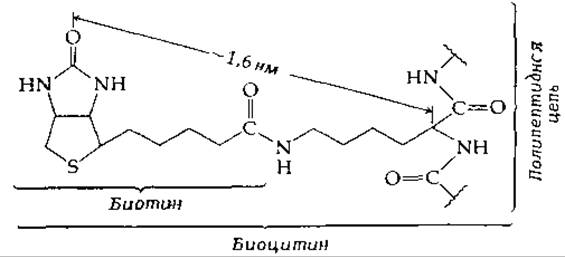
Теперь мы знаем, что лизиновый остаток биоцитина первоначально находился в составе белковой цепи в активном центре биотинсодержащих ферментов. Таким образом, в своих функционирующих формах бициклическая система биотина прикреплена к белку с помощью гибкой «ножки».
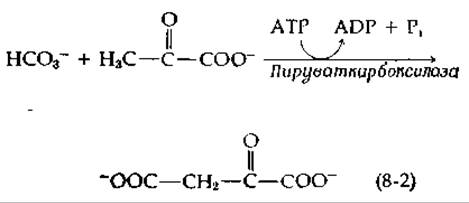
Биотин служит переносчиком карбоксильных групп в ряде реакций ß-карбоксилирования типа 5.В (табл. 7-1). Первым указанием на существование этой функции явились данные о способности аспартата частично заменять биотин в стимулировании роста дрожжей Torula cremoris. Было известно, что аспартат образуется путем переаминирования из щавелевоуксусной кислоты, которая в свою очередь могла образоваться путем ß-карбоксилирования пирувата. Последующие исследования показали, что биотин необходим в ATP-зависимой реакции между пируватом и бикарбонат-ионом:
Другие биотинзависимые карбоксилазы действуют на ацетил-СоА, пропионил-СоА и ß-метилкротонил-СоА, используя НСО3 для присоединения карбоксильной группы в положениях, указанных стрелками на приведенных структурных формулах:
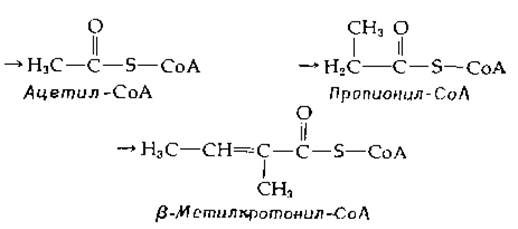
Заметим, что, хотя карбоксилирование ß-метилкротонил-СоА, строго говоря, не является ß-карбоксилированием (гл. 7, разд К,3), присутствие двойной связи С = С, сопряженной с карбонильной группой, делает двойную связь изоэлектронной ß-карбоксилированию.