Биохимия - Химические реакции в живой клетке Том 2 - Д. Мецлер 1980
Коферменты - особые природные специализированные реагенты
Связанный биотин в роли простетической группы
Механизм действия биотина
Может показаться удивительным, что для протекания реакций карбоксилирования необходим кофермент. Однако если бы эти реакции не были сопряжены с расщеплением АТР, то равновесие было бы сильно смещено в сторону декарбоксилирования. В результате сопряжения с расщеплением АТР карбоксилирование может протекать самопроизвольно. Например, экспериментально определяемая кажущаяся константа равновесия К' для карбоксилирования пропионил-СоА до S-метилмалонил-СоА при pH 8,1 и 28°С выражается следующим уравнением [5]:

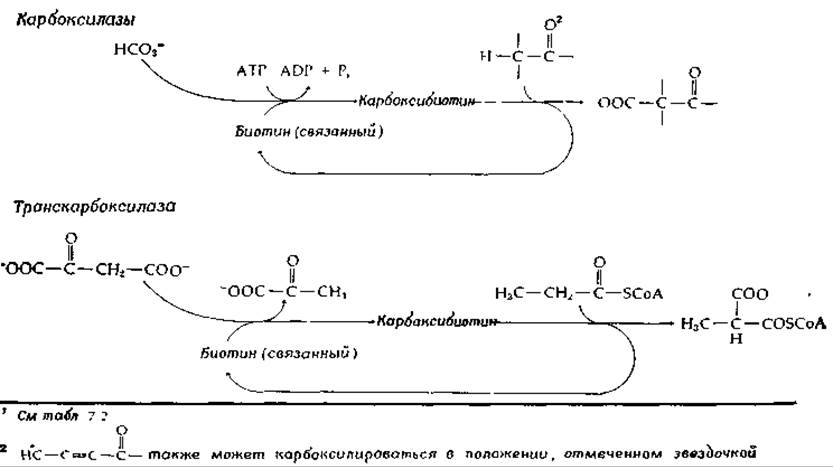
Роль биотина заключается в осуществлении сопряжения расщепления АТР с карбоксилированием. Это достигается двухстадийным процессом, в ходе которого образуется промежуточное соединение карбоксибиотин. Существует лишь один биотинсодержащий фермент, который не нуждается в АТР. Пропионовокислые бактерии содержат карбоксилтрансферазу, которая обратимо переносит карбоксильную группу от метилмалонил-СоА на пируват с образованием щавелевоуксусной кислоты и пропионил-СоА. АТР в этой реакции не нужен, поскольку свободный НСО3 не служит субстратом. Однако биотин и здесь играет роль переносчика карбоксильной группы. В табл. 8-2 приведены функции биотина в реакциях ATP-зависимого карбоксилирования и транскарбоксилирования.
Таблица 8-2 Зависимое от биотина ß-карбоксилирование (реакция типа S5A)a
Структура биотина (дополнение 8-В) указывала на то, что бикарбонат может обратимо присоединяться к витамину в положение 2'. Однако оказалось, что это не так. Ключ к разгадке механизма действия биотина удалось найти Ф. Линену с сотрудниками [6] на основании изучения «модельной реакции». Они показали, что очищенная ß-метилкротонил-СоА — карбоксилаза крысы катализирует карбоксилирование свободного биотина бикарбонатом (Н14СO-3) в присутствии АТР. В то время как карбоксилированный биотин очень лабилен, обработка его диазометаном приводит к более устойчивому диметилоbomv эфиру, который является производным N-1'-карбоксибиотина:
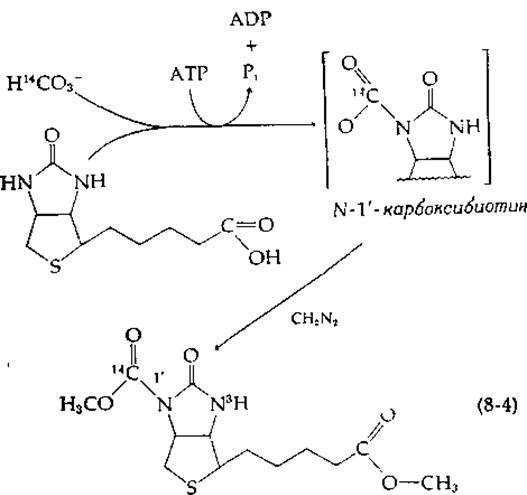
Это означает, что карбоксилированной формой биотина является N-1'-карбоксибиотин. Расщепление АТР необходимо на начальной стадии для присоединения СO2 и НСО3 к биотину. В биотин, ковалентно связанный в активных центрах ферментов, была успешно введена также радиоактивная метка из 14СO2, а обработка ферментов диазометаном с последующим гидролизом трипсином и пепсином приводила к образованию продукта, идентифицированного как N-1'-карбоксибиоцитин. Для завершения каталитического действия фермента необходимо только перенести карбоксильную группу от карбоксибиотина к карбоксилируемому субстрату. Предложенный механизм действия биотина подтвержден в настоящее время данными по ферментативному переносу карбоксильной группы от химически синтезированного карбоксибиотина на специфические субстраты [7].
Биотинзависимые ферменты, по крайней мере в некоторых случаях, могут диссоциировать на отдельные субъединицы. Например, ацетил-СоА — карбоксилаза из Е. coli способна диссоциировать на три фрагмента: 1) биотинкарбоксилпереносящий белок (с мол. весом 22 000), содержащий связанный ковалентно биотин, 2) биотинкарбоксилазу (димер с мол. весом 100 000) и 3) транскарбоксилазу (также димер с мол. весом 90 000). Биотинкарбоксилаза необходима для катализа начального ATP-зависимого карбоксилирования биотина, связанного биотинкарбоксилпереносящим белком. Транскарбоксилаза содержит ацетил-СоА-связывающий центр и катализирует перенос карбоксильной группы от связанного карбоксибиотина к ацетил-СоА с образованием пирувата. По-видимому, важно, что биотин присоединен к белку на конце гибкой «ножки» (длиной в 1,6 нм), которая позволяет биотину перемещаться от активного центра карбоксилазы к активному центру транскарбоксилазы.
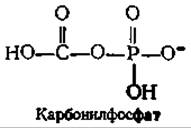
Имеется ряд важных вопросов, касающихся как механизма синтеза карбокснбиотина, катализируемого субъединицей биотинкарбоксилазы, так и механизма транскарбоксилазной реакции. Тот факт, что 18О из меченого бикарбоната включается в Р1, отщепляемый от АТР в первой реакции, свидетельствует об образовании в качестве промежуточного соединения карбонилфосфата в результате нуклеофильной атаки АТР ионом НСО3. Карбоксильная группа этого реакционноспособного ангидрида переносится затем на биотин путем атаки на положение N-1' биотина. Эта двухстадийная последовательность является по существу последовательностью типа S7C (табл. 7-2). Косвенным доводом в пользу промежуточного образования карбонилфосфата служит способность биотинкарбоксилазы ускорять перенос фосфогруппы карбамоилфосфата, аналога карбонилфосфата, на ADP:
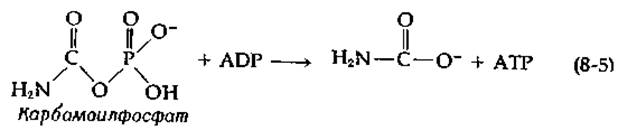
Эта реакция аналогична обращению той стадии, на которой, согласно существующим представлениям, происходит, по-видимому, образование карбонилфосфата из АТР и бикарбоната.
Другая возможность заключается в том, что концевая фосфатная группа АТР переносится на биотин с образованием енолфосфата [стадия а в уравнении (8-6)], который реагирует с бикарбонатом (стадия б) аналогично тому, как это происходит в фосфоенолпируват-карбоксилазной реакции (уравнение 7-80):
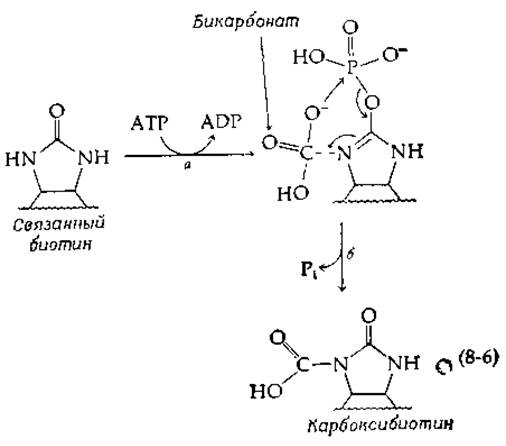
Расщепление енолфосфата на стадии б путем атаки ионом НСО3 создает высоконуклеофильный центр у N-1'. Одновременно мог бы образоваться промежуточный реакционноспособный карбонилфосфат, способный к реакции с N-1’.
Карбоксильная группа карбоксибиотина, вероятно, переносится в конечные продукты в результате нуклеофильной атаки карбонильного углерода енолят-анионом:
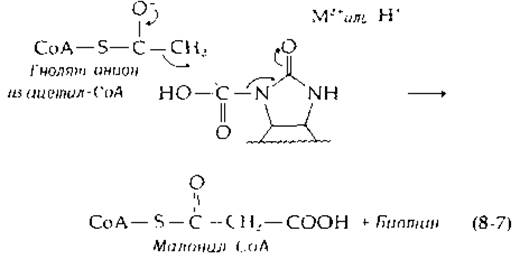
В карбоксилтрансферазной реакции (табл. 8-2) наблюдался перенос трития от 3-3Н-пирувата в пропионил-СоА. Исходя из этого, можно сделать предположение о возможности участия 2'-карбонильной группы биотина в качестве протонакцепторной группы при образовании переходного енолят-иона [7а].
Для протекания стадии транскарбоксилирования необходимо присутствие определенного, связанного с белком иона двухвалентного металла, обычно Мn2+. Это обстоятельство позволило исследовать геометрию связывания субстратов относительно Мn2+ релаксационными методами (ЭПР и ЯМР) [8—10]. Роль металла может состоять прежде всего в облегчении енолизации акцептора карбоксила. Однако в случае пируваткарбоксилазы анализ влияния связанного Мn2+ на времена релаксации 13С в субстрате показал, что расстояние между карбонильным углеродом и Мn2+ составляет ~0,7 нм. Это слишком большое расстояние, чтобы можно было предположить образование прямой координационной связи между металлом и карбонильным кислородом. Другое довольно привлекательное объяснение состоит в допущении образования связи между металлом и карбонильной группой биотина, как показано в уравнении (8-7); результатом (который мог бы быть вызван и образованием водородной связи с протоном) будет улучшение свойств биотина как уходящей группы в реакции замещения [11].
Дополнение 8-В
Биотин
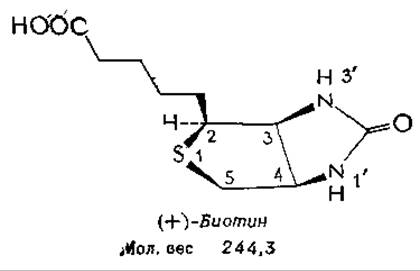
К 1901 г. было установлено, что для роста дрожжей необходимо какое-то еще неизвестное вещество, которое получило название биос. В конце концов было показано, что биос — это смесь пантотеновой кислоты, инозитола и третьего компонента, который назвали биотином. К 30-м годам этот же витамин был распознан по двум другим эффектам: как фактор ускорения роста и дыхания у Rhizobium trifolii, обитающего в корневых клубеньках клевера, и как витамин Н. Этот витамин необходимо вводить в рацион крыс для предупреждения дерматита и паралича, которые развиваются при скармливании крысам больших количеств сырого яичного белка. Выделение чистого витамина было героической работой, которую завершил Кeгль в 1935 г. В одном из экспериментов из 250 кг сухого яичного желтка было получено 1,1 мг кристаллического биотина (что составляет 1,4% общего количества биотина, содержащегося в исходном материале).
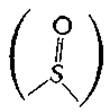
Изомеры и производныеа. В молекуле биотина имеется три хиральных центра, а поэтому существует восемь стереоизомеров биотина. Из них лишь один, правовращающий (+)-биотин, проявляет биологическую активностьб. Биотин легко окисляется до сульфоксида
и до сульфона
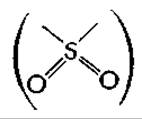
Дезтиобиотин, в котором атом серы удален и замещен двумя атомами водорода, может восполнять потребность в биотине у некоторых организмов и, по-видимому, лежит на одном из путей биосинтеза биотинав. Оксибиотин, в ротором атом серы замещен кислородом, активен во многих организмах, но в некоторых организмах активен лишь частично. Никаких данных о превращении оксибиотина в биотин не публиковалось, и оксибиотин может сам по себе удовлетворительно функционировать по крайней мере в некоторых ферментах.
Суточная потребность. Считается, что взрослому человеку достаточно 0,15—0,3 мг биотина в день.
а Langer В. W., Jr., Gyоrgy Р. (1968). In: The Vitamins, 2nd ed., (W. H. Sebrell, Jr, Harris R. S., eds.), vol. 2, p. 294—322, Academic Press, New York
б DeTitta G. T., Edmonds I. W., Stallings W., Donohue J. (1976). J. Am. Chem Soc, 98, 1920—1926.
в Parry R. J., Kunitani M. G. (1976). J. Am. Chem. Soc, 98, 4024—4025.